生物标志物在海洋溢油污染评价中的应用*
曲 良
(中海石油环保服务(天津)有限公司 天津 300457)
生物标志物在海洋溢油污染评价中的应用*
曲 良
(中海石油环保服务(天津)有限公司 天津 300457)
生物标志物是指能够描述或表征生物机体所产生的各种变化的标志物或指标,在海洋污染评价领域具有较好的应用前景。文章详细综述了国内外应用于海洋溢油污染评价的生物标志物类型、特点和研究现状。同时结合海洋开发与管理,提出了目前研究的不足之处,指出了今后开展相关研究的方向,包括针对海洋溢油污染特点筛选特异性强、稳定性好的生物标志物以及基于生物标志物的海上平台石油污染预警系统的建立等。
生物标志物;海洋溢油污染;评价;应用
海洋溢油是指由人类活动所引起的原油向海洋的泄漏。随着海上原油开采和原油远洋运输等业务的日益增加,海洋溢油事故频繁发生。在近20年由于船舶事故所引发的溢油污染中,溢油量在7 t以上的事故约1 780起,其中700 t以上的重大溢油事故458起[1]。随着有史以来美国海域最严重的溢油事故——“深水地平线”平台溢油事故的发生,海洋溢油污染已经成为现阶段海洋开发与管理领域所关注的重点。
溢油污染严重影响到海洋的生态安全。对于较低营养级的细菌,溢油污染可能会改变浮游细菌的营养源(如,碳源),并进一步影响其群落结构的组成[2]。对于浮游植物,溢油在海上形成的油膜会影响其光合作用过程,从而影响其生长[3];一些研究也表明石油烃也可能促进浮游植物的生长,进而一定程度上促进赤潮的发生[4]。对于高营养级的浮游动物,溢油污染物中的毒性物质通过吸收和摄食等途径进入生物体内后,会影响其代谢过程、造成神经以及生殖系统的损伤,如多环芳香烃类物质能够与DNA分子碱基共价结合,形成DNA加合物,成为致突变或致癌因子[5]。因此,准确、快速检测溢油浓度和分析溢油污染程度,不仅是客观评估溢油污染损害的基础,而且是及时响应和确定应急处置措施以降低溢油污染对海洋生态环境破坏的关键,因而是目前溢油污染防治领域研究中的重点。目前,溢油污染主要通过化学方法检测,主要包括:重量法、环己烷萃取荧光分光光度法、氟利昂-环己烷体系荧光分光光度法、紫外分光光度法、红外法和填充柱气相色谱法等。但是,这些化学方法仅能检测石油烃的浓度,而无法评价溢油污染物对海洋生态系统的损害程度以及生态系统对溢油污染物的响应变化。生物标志物的检测是一种快速、灵敏以及准确评价污染物的方法,在海洋污染物评价方面得到广泛的应用,在溢油污染方面也得到越来越多的应用。
1 生物标志物
生物标志物(biomarker或biological marker)是指能够描述或表征生物机体所产生的各种变化的标志物或指标[6]。由于生物标志物具有反应灵敏、易于检测且与污染物之间具有较强的剂量效应关系,因此可以用来反映环境污染物对生物体的作用,如可以将生物体DNA、蛋白质结构或性质、免疫系统或解毒系统的变化作为生物标志物来反映生物体受污染的程度(图1)。
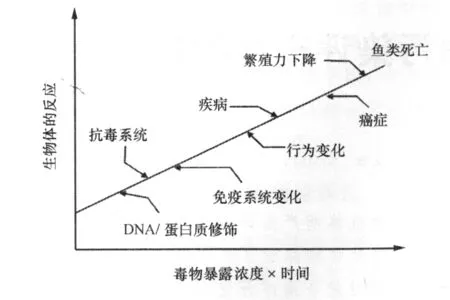
图1 生物体对毒物暴露的反应[7]
目前,被广泛应用于海洋污染检测的生物标志物有DNA加合物、DNA完整性、细胞色素4501 A、金属硫因蛋白、乙酰胆碱酯酶和抗氧化防御系统等(表1)。
2 生物标志物在海洋溢油污染评价中的应用
通过研究生物标志物的变化与污染物的剂量效应关系,可以揭示污染物对环境生物的致毒机理和其对生态环境的损害程度。随着海洋溢油污染事故的频繁发生,生物标志物逐渐成为溢油污染发生早期预警和有效监测评价污染物的新型技术手段。目前,广泛研究的用以溢油污染检测和评价的生物标志物有抗氧化防御系统、7-乙氧基异吩恶唑-O-脱乙基酶(7-ethoxyresorufin-O-deethylase,EROD)、DNA完整性、DNA加合物和溶酶体稳定性等(表2)。

表1 应用于海洋污染监测的常见生物标志物类型和检测方法[8-13]

表2 生物标志物在溢油事故污染评价中的应用[14-24]
2.1 抗氧化酶系统
生物体内以抗氧化酶为主体的抗氧化防御系统是生物抵御环境污染胁迫的重要屏障。其中还原型谷胱甘肽(glutathione sulphydryl,GSH)能够与体内的自由基结合,以达到降低机体受外源污染产生过氧化的风险。谷胱甘肽过氧化物酶(glutathione peroxidase,Gpx)和谷胱甘肽硫转移酶(glutathione S-transferases,GSTs)能够催化体内过氧化物的还原反应。其中GSH能够使H2O2转化为H2O,Gpx能够催化外源污染物与还原型谷胱甘肽相偶联。过氧化氢酶(catalase,CAT)可以催化H2O2的还原反应,使其分解为H2O和O2,保护细胞免受过氧化物的胁迫。由于抗氧化酶与生物体对外源污染胁迫的响应有着密切的关系,因此,其活性或含量的变化可以作为评价海洋溢油污染的生物标志物。
一些学者在实验室条件下研究了腹足纲软体动物(Austrocochlea porcata)受原油污染胁迫后抗氧化酶系统的响应。受试生物暴露于含有不同浓度原油水溶性组分的海水中96小时后,暴露于25%、50%和100%原油水溶性组分海水中的受试生物体内Gpx活性显著高于对照组,并且Gpx活性的变化与原油水溶性组分浓度的变化表现出显著的正相关性[14]。对溢油现场的调查研究中也发现了相似的现象。如,一些研究者发现溢油现场不同站位采集的鱼类体内GST、GR和CAT活性随沿岸沉积物中溢油污染物浓度的增大而呈升高的趋势[17]。学者们在对“Coral Bulker”号货轮溢油事故海域沿岸污染情况的调查中发现,受试生物贻贝(Mytilus galloprovincialis)体内GSTs活性也表现出与上述现场试验相似的结果[15]。这些研究表明抗氧化酶系统在抵御原油污染过程中起着重要的作用,生物体内抗氧化酶系统活性的变化可以作为一种指示原油污染程度的生物标志物。
2.2 细胞色素P4501 A
细胞色素P4501 A(cytochrome P4501 A,CYP4501 A)在二恶英、呋喃、多氯联苯以及多环芳香烃等污染物的生物转化过程中起着非常重要的作用。当生长环境受到这些污染物的污染时,生物体内该酶的活性将显著提高,从而催化生物体中异源性物质的降解[25]。
CYP4501 A的EROD活性已经在一些溢油事故现场的污染检测中得到了应用。如一些研究者发现与未受溢油污染海域相比较,污染严重海域受试生物的EROD表现出较高的活性,但EROD活性的变化与溢油污染程度并未表现出的显著的相关性[6,15,19,26]。在Exxon Valdez溢油事故发生10年后,学者们利用鱼类肝部CYP4501 A的EROD作为指标对原本受污染的海域沿岸进行污染评价时发现,溢油污染海域受试生物CYP4501 A的EROD活性依然表现出显著地高于未污染海域,表明溢油污染对该海域环境仍然具有胁迫效应[27]。也有学者在Prestige溢油事故发生5个月后利用底栖鱼类(Lepido rhombus boscii和Callionymus lyra)肝部的EROD作为生物标志物检测评价了受溢油污染海岸线的环境污染情况[28]。通过主成分分析方法发现采样区域石油烃PAH组分含量与EROD的活性表现出一致的空间变化趋势。此外,季节温度的变化对EROD活性的影响并不显著,表明可以通过检测EROD的活性检测评价该污染海域的溢油污染。
2.3 DNA加合物
DNA加合物是由具有毒性的环境异源物在代谢过程中与DNA的特异性位点共价结合形成的复合物。DNA加合物形成后,会导致生物体基因在复制过程中产生突变,进而产生一系列的遗传毒性[29]。因此可以利用DNA加合物的形成作为生物体受环境毒性异源物(如石油烃类化合物)胁迫产生遗传毒性的早期预警。
学者们通过实验室研究和现场调查相结合的方法,成功应用鱼类肝部细胞DNA加合物的形成量为生物标志物指示了环境中PAHs的污染状况。研究发现受试生物DNA加合物的变化与环境中PAH的含量表现出一致的变化趋势[30-33]。在近期开展的一项研究中,学者们利用极地鳕鱼(Boreogadus saida)为受试生物,利用现场采样分析和实验研究的方法,通过检测其肝部组织中的DNA加合物含量评价研究区域石油烃污染状况[34]。该研究发现实验室条件与现场分析表现出相似的研究结果,受试生物肝部DNA加合物含量在石油烃污染物胁迫下显著地高于对照组,并且与石油烃污染物(2或3环PAHs)浓度的变化表现出显著一致变化,表明利用鳕鱼肝部组织DNA加合物的变化检测石油烃污染物的环境损害是一种可行的方法。
2.4 溶酶体的稳定性
溶酶体是含有多种酸性水解酶的细胞器,在生物体细胞中起着分解细胞(自噬作用)或阻止由细胞外进入细胞内物质的作用(异噬作用)[35]。软体动物的溶酶体是多种有毒污染物的作用靶位点。在污染胁迫条件下,溶酶体结构(细胞膜稳定性或细胞体积大小)会发生显著的改变,如由于膜的通透性增大,引起其中的水解酶活性显著增加以及次级溶酶体(溶酶体残体,residual bodies)的浓度也发生变化[36-39]。因此,溶酶体结构的稳定性以及水解酶活性的变化,可以作为检测生物体受环境污染物胁迫的生物标志物之一。
学者们在Prestige油轮溢油事故后,利用贻贝消化细胞溶酶体膜的稳定性作为生物标志,对受污染海域的环境损害情况进行了为期一年的采样分析[24]。研究发现,溶酶体膜稳定性都现出了下降的变化趋势。通过比较溶酶体细胞膜不稳定间隔(labialization period,LP),发现贻贝样品消化腺的溶酶体LP均为小于10 min,显著低于正常值(20~25 min)。另外,溶酶体体积随着其数量的减少也表现出显著的增大。表明该海域溢油污染物显著影响了溶酶体膜结构的稳定性。作用机理可能是由于生物体自身的解毒效应,使受污染胁迫影响的溶酶体破裂,造成其数量的降低。
2.5 多种生物标志物的联合应用
单一生物标志物虽然能够反应对石油烃污染物对生物体产生的毒害效益,但由于污染物成分的复杂性和多样性,使用单一生物标志物往往无法准确全面检测和评价石油烃污染物对环境产生的毒害效应。
利用多种生物标志物对溢油污染物的响应变化评价溢油污染的环境效应已经在一些研究中得到了应用[40-41]。在近期开展的一项溢油事故环境污染评价中,学者们以鱼类(Lipophrys pholis)肝部CYP4501 A的EROD和胆汁作为一组生物标志物检测评价了目标海域的溢油污染状况。发现与对照组相比较,受污染海域鱼类肝组织中EROD活性和胆汁中多环芳烃浓度(FAC)表现出一致的变化,随着PAHs浓度的增加EROD活性显著增加了5倍,而FAC则显著提高了2倍,与实验室内开展的剂量效应试验表现出一致的变化趋势[42]。
3 生物标志物技术在海洋开发与管理中的发展
3.1 技术手段和标准体系的建立
近年来,生物标志物已经被广泛地应用于不同国家和地区的海洋环境污染的监测中。如,全球海洋观测系统沿岸海洋观测模块综合战略设计方案(The integrated,strategic design plan for the coastal ocean observations module of global ocean observing system,GOOS)中以生物标志物为基础制订了评价污染物和环境压力的海洋污染快速评价技术(rapid assessment of marine pollution,RAMP),用以评价由污水和化学污染物排放而引起的海洋环境污染以及由于沿岸开垦、旅游和海洋产业的发展而带来的环境压力[43]。该设计方案在1997年巴西沿岸海域成功实施的基础上,确定进一步评价的污染物有多环芳香烃、多氯联苯以及有机氯等污染物。我国目前尚未建立基于生物标志物的溢油污染检测和评价体系。因此,针对目前溢油事故频繁发生和溢油污染日益加剧的趋势,非常有必要建立一种有效的检测溢油污染物和评价溢油污染环境影响的技术手段和标准体系,以服务于我国的海洋开发与管理。
3.2 基于生物标志物的传感设备构建
生物标志物可作为传感设备中的识别组件,利用其与污染物之间的特异反应,经信号转换输出从而获得待检测和评价污染物的目的。以此为基础构建的生物传感器具有快捷、特异性强和样品用量少等优点,目前在环境污染物的检测和评价中已有一些应用。例如,一些研究者利用ssDNA与多环芳烃污染物之间的特异性剂量—效应关系构建了开发了ssDNA的电化学生物传感器,并用以检测和评价水体中的多环芳烃(PAHs)污染物[44-45]。近年来,随着应用于石油污染物检测评价的特异性生物标志物的筛选、信号转换途径和信号分析技术的不断发展,生物传感设备的构建将逐渐成为海上石油污染物检测评价的有效手段之一。
4 小结
生物标志物以其能够快速、准确检测和评价溢油污染物的特点,已经在海洋溢油污染的评价中得到了一定的应用,为海洋溢油污染防护措施的实施和污染区域修复治理方法的选择提供了有效的技术支持和决策依据。但由于溢油污染物的复杂性和海上环境变化的不确定性,生物标志物的应用依然面临着一些问题去解决。
(1)由于溢油污染物往往是烷烃、环烷烃、芳香烃和硫化物的混合物,因此有必要在分析溢油污染物与不同生物标志物之间的剂量效应关系的基础上,筛选能够指示环境污染变化的特异性生物标志,提高该技术的有效性和准确性。
(2)稳定指示海上溢油污染的生物标志物的筛选。由于海面环境的复杂性,筛选稳定的生物标志物,使其在不同海况自然条件下,均能够准确检测溢油污染物的出现,并对其产生的环境影响进行评价,是目前海洋溢油污染评价所需要解决的问题之一。
(3)基于生物标志物的海上平台石油污染预警系统的建立。利用生物标志对石油烃污染物的敏感反应,建立基于生物体早期生命响应的石油污染检测系统,能够为海上溢油污染的环境影响评价提供准确、有效的技术方法和科学依据。
[1] ITOPF.oil tanker spill statistics:2009[M].London:The International Tanker Owners Pollution Federation Ltd,2010:1-7.
[2] KASAI Y,KISHIRA H,SYUTSUBO K,et al.Molecular detection of marine bacterial populations on beaches contaminated by the Nakhodka tanker oil-spill accident[J].Environmental Microbiology,2001,3(4):246-255.
[3] STEPANIYAN O.Effects of crude oil on major functional characteristics of macroalgae of the Barents Sea[J].Russian Journal of Marine Biology,2008,34(2):131-134.
[4] SALAS N,ORTIZ L,GILCOTO M,et al.Fingerprinting petroleum hydrocarbons in plankton and surface sediments during the spring and early summer blooms in the Galician coast(NW Spain)after the Prestige oil spill[J].Marine environmental research,2006,62(5):388-413.
[5]VAN DER OOST R,BEYER J,VERLEUMEN NE.Fish bioaccumulation and biomarkers in environmental risk assessment:a review[J].Environmental Toxicology and Pharmacology,2003,13(2):57-149.
[6] PEAKALL D B.The role of biomarkers in environmental assessment(1)Introduction[J].Ecotoxicology,1994,3(3):157-160.
[7] SHUGART L R,McCARTHY J F,HALBROOK R S.Biological markers of environmental and ecological contamination:an overview[J].Rish Analysis,1992,12(3):353-360.
[8] AAS E,LIEWENBORG B,EINAR B,et al.DNA adduct levels in fish from pristine areas are not detectable or low when analysed using the nuclease P1 version of the32P-postlabelling technique[J].Biomarkers,2003,8(6):445-460.
[9] MITCHELMORE CL,CHIPMAN JK.DNA strand breakage in aquatic organisms and the potential value of the comet assay in environmental monitoring[J].Mutation Research,1998,399(2):135-147.
[10] GOLET G H,SEISER P E,MCGUIRE A D,et al.Long-term direct and indirect effects of the‘Exxon Valdez’oil spill on pigeon guillemots in Prince William Sound,Alaska[J].Marine Ecology Progress Series,2002,241:287-304.
[11] AMIARD J C,AMIARD-TRIQUET C,BARKA S,et al.Metallothioneins in aquatic invertebrates:their role in metal detoxification and their use as biomarkers[J].Aquatic Toxicology,2006,76(2):160-202.
[12] MDEGELA R H,MOSHA R D,SANDVIK M,et al.Assessment of acetylcholinesterase activity in Clarias gariepinus as a biomarker of organophosphate and carbamate exposure[J].Ecotoxicology,2010,19(5):855-863.
[13] WANG Y Y,ZHOU Q X,PENG S W,et al.Toxic effects of crude-oil-contaminated soil in aquatic environment on Carassius auratus and their hepatic antioxidant defense system[J].Journal of Environmental Sciences,2009,21(5):612-617.
[14] REID R G,MACFARLANE G R.Potential biomarkers of crude oil exposure in the gastropod mollusk,Austrocochlea porcata:laboratory and manipulative field studies[J].Environmental Pollution,2003,126(2):147-155.
[15] MOREIRA S M,MOREIRA-SANTOS M,RIBEIRO R,et al.The‘Coral Bulker’fuel oil spill on the North coast of Portugal:spatial and temporal biomarker responses in Mytilus galloprovincialis[J].Ecotoxicology,2004,13(7):619-630.
[16] MORALES-CASELLES C,MARTÍN-DÍAZ ML,RIBA I,et al.The role of biomarkers to assess oilcontaminated sediment quality using toxicity tests with clams and crabs[J].Environmental Toxicology and Chemistry,2008,27(6):1309-1316.
[17] MZARTÍNEZ-GÓMEZ C,CAMPILLO JA,BENEDICTO J,et al.Monitoring biomarkers in fish(Lepidorhombus boscii and Callionymus lyra)from the northern Iberian shelf after the Prestige oil spill[J].Marine Pollution Bulletin,2006,53(5-7):305-314.
[18] MORALES-CASELLES C,JIMENEZ-TENORIO N,LUISA GONZALEZ D E CANALES M,et al.Ecotoxicity of sediments contaminated by the oil spill associated tanker‘Prestige’using juveniles of the fish Sparus aurata[J].Archives of environmental contamination and toxicology,2006,51(4):652-660.
[19] KIRBY MF,NEALL P,TYLOR T.EROD activity measured in flatfish from the area of the Sea Empress oil spill[J].Chemosphere,38(12):2929-2949.
[20] LAFFON B,RáBADE T,PáSARO E,et al.Monitoring of the impact of Prestige oil spill on Mytilus galloprovincialis from Galician coast[J].Environment International,2006,32(3):342-348.
[21] DEASI S R,VERLECAR X N,ANSARI Z A,et al.Evaluation of genotoxic responses of Chaetoceros tenuissimus and Skeletonema costatum to water accommodated fraction of petroleum hydrocarbons as biomarker of exposure[J].Water Research,2010,44(7):2235-2244.
[22] HARVEY J S,LYONS B P,PAGE T S,et al.An assessment of the genotoxic impact of the Sea Empress oil spill by the measurement of DNA adduct levels in selected invertebrate and vertebrate species[J].Mutation Research-Genetic Toxicology and Environmental Mutagenesis,1999,441(1):103-114.
[23] FERNLEY P W,MOORE M N,LOWE D M,et al.Impact of the Sea Empress oil spill on lysosomal stability in mussel blood cells[J].Marine Environmental Research,2000,50(1-5):451-455.
[24] ORBEA A,GARMENDIA L,MARIGóMEZ I,et al.Effects of the‘Prestige’oil spill on cellular biomarkers in intertidal mussels:results of the first year of studies[J].Marine Ecology Progress Series,2006,306:177-189.
[25] WHYTE J J,JUNG R E,SCHMITT C J,et al.Ethoxyresorufin-O-deethylase(EROD)activity in fish as a biomarker of chemical exposure[J].Critical Reviews in Toxicology,2000,30(4):347-570.
[26] BURGEOT T,BOCQUENéG,PINGRAY G,et al.Monitoring biological effects of contamination in marine fish along french coasts by measurement of ethoxyresorufin-O-deethylase activity[J].Ecotoxicology and Environmental Safety,1994,29(2):131-147.
[27] JEWETT S C,DEAN T A,WOODINC B R,et al.Exposure to hydrocarbons 10 years after the Exxon Valdez oil spill:evidence from cytochrome P4501 A expression and biliary FACs in nearshore demersal fishes[J].Marine Environmental Research,2002,54(1):21-48.
[28] MARTÍNEZ-GÓMEZ C,FERNÁNDEZ B,VALDÉS J,et al.Evaluation of three-year monitoring with biomarkers in fish following the Prestige oil spill(N Spain)[J].Chemosphere,2009,74(5):613-620.
[29] VODICKA P,KOSKINEN M,ARAND M.Spectrum of styrene-induced DNA adducts:The relationship to other biomarkers and prospects in human biomonitoring[J].Mutation Research,2002,511(3):239-254.
[30] STEIN J E,COLLIER T K,REICHERT W L,et al.Bioindicators of contaminant exposure and sublethal effects:studies with benthic fish in Puget Sound,Washington[J].Environmental Toxicology and Chemistry,1992,11(5):701-714.
[31] VAN DER OOST R,HEIDA H,SATUMALAYET K,et al.Bioaccumulation,biotransformation and DNA binding of PAHs in feral eel(Anguilla anguilla)exposed to polluted sediments:a field survey[J].Environmental Toxicology and Chemistry,1994,13(6):859-870.
[32] ERICSON G,LINDESJÖÖE,BALK L,et al.DNA adducts and histopathological lesions in perch(Perca fluviatilis)and northern pike(Esox lucius)along a polycyclic aromatic hydrocarbon gradient on the Swedish coastline of the Baltic Sea[J].Canadian Journal of Fisheries and Aquatic Sciences,1998,55(4):815-824.
[33] AAS E,LIEWENBORG B,EINAR GRØSVIK B,et al.DNA adduct levels in fish from pristine areas are not detectable or low when analysed using the nuclease P1 version of the32P-postlabelling technique[J].Biomarkers,2003,8(6):445-460.
[34] JONSSON H,SUNDT R C,AAS E,et al.The arctic is no longer put on ice:Evaluation of Polar cod(Boreogadus saida)as a monitoring species of oil pollution in cold waters[J].Marine Pollution Bulletin,2010,60(3):390-395.
[35] DWT A U.The application of histo-cytopathological biomarkers in marine pollution monitoring:a review[J].Marine Pollution Bulletin,2004,48(9-10):817-834.
[36] WOODWORTH J G,MUNDAY B L,CAMPIN D.Evaluation of biomarkers for exposure of fish to eucalypt-based pulp mill effluent and for determination of routes of exposure[J].Environmental Toxicology and Water Quality,1998,13(4):285-296.
[37] ETXEBERRIA M,CAJARAVILLE M P,MARIGOMEZ I,et al.Changes in digestive cell lysosomal structure in mussels as biomarkers of environmental stress in the Urdaibai Estuary(Biscay coast,Iberian Peninsula)[J].Marine Pollution Bulletin,1995,30(9):599-603.
[38] DOMOUHTSIDOU GP,DIMITRIADIS VK.Lysosomal and lipid alternations in the digestive gland of mussels,Mytilus galloprovincialis(L.)as biomarkers of environmental stress[J].Environmental Pollution,2001,115(1):123-137.
[39] MARIGóMEZ I,BAYBAY-VILLACORTA L.Pollutant-specific and general lysosomal responses in digestive cells of mussels exposed to model organic chemicals[J].Aquatic Toxicology,2003,64(3):235-257.
[40] BOLOGNESI C,PERRONE E,ROGGIERI P,et al.Bioindicators in monitoring long term genotoxic impact of oil spill:Haven case study[J].Marine Environmental Research,2006,62(S1):287-291.
[41] GARMENDIA L,SOTO M,VICARIO U,et al.Application of a battery of biomarkers in mussel digestive gland to assess long-term effects of the Prestige oil spill in Galicia and Bay of Biscay:Tissue-level biomarkers and histopathology[J].Journal of Environmental Monitoring,2011,13(4):915-932.
[42] SANTOS MM,SOLéM,LIMA D,et al.Validating a multi-biomarker approach with the shanny Lipophrys pholis to monitor oil spills in European marine ecosystems[J].Chemosphere,2010,81(6):685-691.
[43] UNESCO.The Integrated,strategic design plan for the coastal ocean observations module of the global ocean observing system GOOS report No.125.IOC information documents series N°1183[R].France:United Nations Educational,Scientific and Cultural Organization,2003.
[44] MARRAZZA G,CHIANELLA I,MASCINI M.Disposable DNA electrochemical biosensors for environmental monitoring[J].Analytica Chimica Acta,1999,387(3):297-307.
[45] DEL CARLO M,DI MARCELLO M,PERUGINI M.Electrochemical DNA biosensor for polycyclic aromatic hydrocarbon detection[J].Mikrochimica acta,2008,163(3-4):163-169.
中国海洋石油总公司技术发展项目(C/KJF ETCY 002-2010).

