妊娠合并血液系统肿瘤20例临床分析
金珍琳 梁 彬
妊娠合并血液系统肿瘤临床较少见。由于血液系统肿瘤是一组多样性的恶性肿瘤,疾病的进程和治疗多种多样,且涉及到对母儿预后的影响,临床处理较为复杂。本研究收集笔者医院近10年来妊娠合并血液系统肿瘤患者20例,进行回顾性临床分析,以提高对妊娠合并血液系统肿瘤的认识和临床处理水平。
资料与方法
1.一般资料:收集笔者医院2001年2月~2012年4月期间妊娠合并血液系统肿瘤患者20例,发病年龄20~41岁,中位年龄27.9岁。急性髓细胞白血病(AML)6例,其中,急性早幼粒细胞白血病(M3)2例,急性粒-单核细胞白血病(M4)2例,急性粒-单核细胞白血病伴嗜酸细胞增多(M4Eo)1例,急性单核细胞白血病(M5)1例。急性淋巴细胞白血病(ALL)4例,慢性粒细胞白血病(CML)3例,非霍奇金淋巴瘤(NHL)(弥漫大B细胞型)1例。骨髓增生异常综合征(MDS)6例,其中诊断为难治性贫血(RA)3例,难治性贫血伴环状铁粒幼红细胞(RARS)1例,难治性血细胞减少伴多系发育异常(RCMD)1例,难治性贫血伴原始细胞增多-I(RAEB-I)1例。孕早期(妊娠1~3个月)发病4例,孕中期(妊娠4~6个月)发病7例,孕晚期(妊娠7~9个月)发病9例。
2.妊娠处理:孕早期行药物引产或人工流产,1例因宫外孕行手术治疗,孕中期行米非司酮药物引产或利凡诺尔羊膜腔内注射引产,孕晚期行剖宫产。终止妊娠前均纠正贫血、血小板升至50×109/L以上,输血浆纠正凝血功能障碍,并备好单采血小板、浓缩红细胞、血浆。
3.化疗方案:化疗多采用联合方案,1例M3型采用全反式维甲酸(ATRA)联合去甲氧柔红霉素(IDA)方案化疗;另1例M3采用ATRA联合小剂量阿糖胞苷(Ara-c)化疗,产后予三氧化二砷(As2O3)化疗。M4Eo,M4及M5采用DA(柔红霉素、阿糖胞苷)或IA(去甲氧柔红霉素、阿糖胞苷)方案化疗。M41例拒绝化疗,仅采用羟基脲(HU)降细胞治疗后出院,后失访。NHL患者采用 CHOP(表阿霉素、环磷酰胺、长春地新、泼尼松)方案化疗。ALL采用VDCLP(长春新碱、柔红霉素、环磷酰胺、左旋门氡酰胺酶、泼尼松)方案化疗。CML患者采用羟基脲、伊马替尼(imatinib)或联合HA(高三尖杉、阿糖胞苷)方案化疗。MDS患者采用CAG(阿糖胞苷、阿克拉霉素、粒细胞集落刺激因子)方案化疗或予促红素、维甲酸、雄激素、沙利度胺、输血等对症支持治疗。
结 果
1.孕期处理及妊娠结局:孕早期发病4例,2例予行药物流产后化疗;1例因宫外孕,行手术治疗后化疗;1例MDS(RARS)患者,人工流产后予对症支持治疗。孕中期发病7例,4例予引产后化疗;1例M4患者因起病时为高白,予HU降细胞后予引产,后患者拒绝化疗出院,失访;2例MDS患者均予输血等对症支持治疗至孕晚期行剖宫产,1例MDS(RCMD)于产后化疗,1例MDS(RA)产后未化疗,予对症支持治疗;1例新生儿为健康女婴,1例为男婴,产后因“败血症、小于胎龄早产儿、极低出生体重儿、新生儿贫血等”送新生儿科住院治疗。孕晚期发病9例:9例均行剖宫产,产后7例行化疗治疗,2例MDS(RA)患者予对症支持治疗。1例M3患者妊娠期间并发妊高征、严重的心力衰竭和弥散性血管内凝血(DIC),予ATRA诱导分化,小剂量Ara-c降细胞,并予输血等对症支持治疗后于孕32周行子宫下段剖宫产术+子宫次全切除术,术后转入ICU予气管插管接呼吸机辅助通气,病情稳定后予三氧化二砷化疗。1例NHL患者于孕29周确诊,孕30周行剖宫产,新生儿出生后因“新生儿肺透明膜病,贫血,支气管肺发育不良”入住新生儿科,其余8例新生儿均为健康活婴。
2.母儿随访情况:20例患者除1例拒绝化疗出院以外,对其余19例均进行电话随访。目前存活13例,死亡6例,中位随访时间45.4个月(5个月~11年)。其中急性白血病患者10例,1例失访,存活5例,死亡4例。死亡的4例中,1例为M4Eo患者,引产后化疗达完全缓解,3.5年后复发,予挽救化疗效果欠佳,4年后死亡;3例为ALL患者,2例第1次化疗达部分缓解,1例达完全缓解,分别于诊断后2、2.5和3年后死亡。存活的5例目前均处于缓解期。CML患者3例,2例初始予HU治疗,其中1例加用HA方案化疗,获得完全血液学缓解,后均改用伊马替尼治疗,1例开始即予伊马替尼治疗,2例获得完全遗传学缓解,1例获得完全分子学缓解,目前3例均存活。NHL患者1例,诊断后即予行剖宫产终止妊娠,产后开始化疗,获部分缓解,患者因疾病进展较快,于1年后治疗无效死亡。MDS患者6例,存活5例,死亡1例。死亡1例为RAEB-I型,产后予化疗获得血液学改善,患者1年后转化为急性髓细胞白血病(M2a),挽救化疗效果差,2年后死亡。1例为RCMD型,产后予化疗,疾病未缓解,目前随访6个月,仍治疗中。1例RARS型流产后予促红素、维甲酸、雄激素、输血等对症支持治疗,获得血液学改善,4年后病情进展,原始细胞增多,目前予小剂量Ara-c化疗中,仍存活。其余3例目前病情稳定。共有11例新生儿,其中4例为足月新生儿,7例为早产儿,目前均存活,中位随访时间54.5个月(3个月~11年)。4例足月新生儿目前均正常。7例早产儿中,5例为适于胎龄早产儿,目前正常。其余2例早产儿住院治疗,其中1例早产儿产后因“败血症、小于胎龄早产儿、极低出生体重儿、新生儿贫血等”送新生儿科住院治疗,目前仍住院治疗中;1例新生儿出生后因“新生儿肺透明膜病、贫血、支气管肺发育不良”入住新生儿科。20例患者具体随访情况见表1。
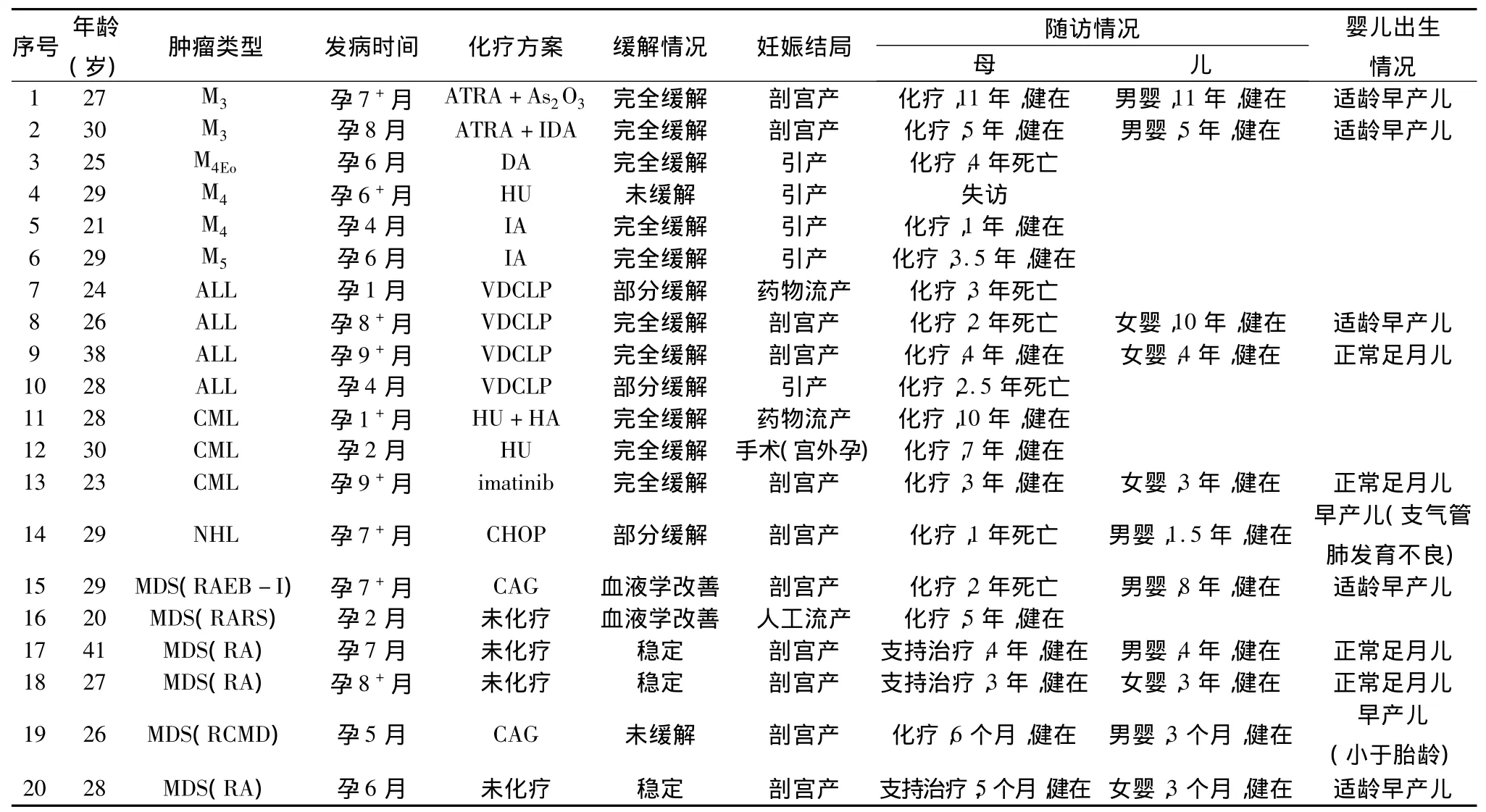
表1 妊娠合并血液系统肿瘤化疗方案及治疗结局
讨 论
妊娠发生肿瘤的概率为1‰,是孕妇死亡的第二大病因,而且,随着妊娠的推迟有上升趋势,妊娠期肿瘤主要为实体瘤,血液系统肿瘤较少见[1,2]。妊娠并发血液系统肿瘤主要有恶性淋巴瘤、急性白血病、慢性白血病、骨髓增生异常综合征、骨髓瘤等,但发病率低,处理比较困难[3]。虽然胎盘具有一定的防止血液系统肿瘤细胞进入胎儿体内的屏障作用,但以往临床研究仍证实,血液系统肿瘤对孕妇和胎儿均有不利影响:①三系异常导致的血小板减少、贫血、白细胞过多及感染,使患者在孕期和围生期面临的颅内出血、DIC、产后出血、脑栓塞、败血症的风险明显增加;②合并病理妊娠的机会增多,如胎盘早剥、妊娠高血压综合征等;③胎儿生长受限、胎死宫内、早产和自然流产的发生率增高。我们20例孕妇妊娠期间,共2例孕妇发生妊高征,1例发生胎盘早剥;出生的11名新生儿,7例为早产儿,其中4例因产妇病重需立即治疗,且考虑胎儿基本成熟,新生儿可存活予及早终止妊娠,其中2例早产儿需住院治疗。可见血液系统肿瘤对母儿均有不利影响。
目前多数学者认为妊娠对血液系统肿瘤没有明显影响,妊娠期患血液系统肿瘤的患者预后同非妊娠妇女相同[4~7]。越来越多的抗肿瘤药物用于治疗妊娠期肿瘤患者,药物对胎儿可能的影响多来源于回顾性分析。Dilek等[8]对18例血液系统肿瘤患者的21次妊娠进行分析,共有8例新生儿母亲在孕期接受了化疗,其中早产1例,低体重新生儿4例(其中1例伴拇指畸形),宫内死胎1例,共有3例出生时存活但最后死亡,笔者认为化疗对新生儿有不良影响。但有些学者持不同意见,Aviles等[9]对84例母亲妊娠期间接受了化疗的儿童进行了长期随访,包括生长发育,神经发育,性成熟,生育能力,学习能力等各个方面,最后认为化疗对子代没有影响。Cardonick等[10]也得出了类似的结论,认为母亲孕中晚期接受化疗的子代同正常人群没有区别。我们仅有1例M3患者孕期接受化疗,患者孕晚期(孕7+月余)发病,予ATRA诱导分化,并予小剂量Ara-c化疗降细胞,于孕32周早产1例健康男婴。目前已随访11年,无明显异常。由于例数尚少,随访时间仍不够长,妊娠期间接受化疗对子代有无影响可能需要进一步的病例积累及长期随访才能得出结论。
血液系统肿瘤是一组多样性的恶性肿瘤,疾病的进程和治疗多种多样。对于妊娠合并血液系统肿瘤的治疗,首要的目标是保护母亲的健康,同时最大限度地减少治疗相关的毒性对胎儿的影响。因此提供一个有效的治疗方案以治疗母亲同时能够使正常胎儿发育依赖于肿瘤的类型、特性(惰性或侵袭性)和妊娠阶段。对于在孕早期诊断为血液肿瘤,通常建议终止妊娠,从而能够接受足够的治疗[11]。我们孕早期发病的4例患者,1例为ALL,2例为CML,1例为MDS。除1例因宫外孕行手术治疗外,其余3例均采用流产方式终止妊娠。3例接受化疗或HU治疗,其中2例CML患者获得完全血液学缓解,1例ALL患者获得部分缓解。MDS患者予促红素、维甲酸、雄激素、输血等对症支持治疗,获得血液学改善。ALL患者于3年后死亡,其余患者目前均存活。而对于孕中期发病的7例患者,依据肿瘤类型及恶性程度采用不同的治疗方式,对于恶性度高的5例急性白血病患者,均采取引产的方式终止妊娠,1例因拒绝化疗出院后失访,其余4例均接受足剂量的化疗,其中3例获得完全缓解,1例获得部分缓解,2例分别于2.5年和4年后死亡,其余2例目前仍存活。而对于病情尚稳定的2例MDS患者,采用输血等支持治疗的方式直至妊娠结束。1例于产后接受化疗未缓解,另1例目前仍予促进造血等对症支持治疗中。孕晚期发病的9例患者,其中4例为急性白血病,1例为CML,1例为NHL,3例为MDS。1例急性白血病患者(M3)因孕期仅7+月,予化疗后再行剖宫产术,其余3例急性白血病患者均立即予终止妊娠并予产后开始化疗,4例均获得完全缓解。CML患者因已孕足月,予行剖宫产术,术后开始伊马替尼治疗并最终获得完全分子学缓解。NHL患者因病情进展快,肿瘤恶性度高,诊断后即予行剖宫产终止妊娠,产后开始化疗,获部分缓解,但患者于1年后因疾病进展,治疗无效死亡。3例MDS,诊断后均予输血等对症支持治疗,2例至孕足月后行剖宫产,产后仍予以促进造血、输血等对症支持治疗,目前病情稳定;1例于孕32周早产,产后予化疗,获血液学改善,2年后因疾病进展死亡。
对于妊娠合并血液系统肿瘤,我们的经验提示血液系统肿瘤对母儿均有不利影响,容易导致病理妊娠,早产儿,低体重出生儿,新生儿发育不良,甚至发生贫血,败血症等。只要及早诊断,并选择恰当的治疗方案,妊娠妇女的疗效通常比较满意。
1 Hurley TJ,McKinnell JV,Irani MS.Hematologic malignancies in pregnancy[J].Obstet Gynecol Clin North Am,2005,32(4):595 -614
2 Abadi U,Koren G,Lishner M.Leukemia and lymphoma inpregnancy[J].Hematol Oncol Clin North Am,2011,25(2):277 -291
3 Rizack T,Mega A,Legare R,et al.Management of hematologicalmalignancies during pregnancy[J].Am JHematol,2009,84(12):830 -841
4 Chelghoum Y,Vey N,Raffoux E,et al.Acute leukemiaduring pregnancy:a report on 37 patients and a review of theliterature[J].Cancer,2005,104(1):110 - 117
5 Pohlman B,Macklis RM.Lymphoma and pregnancy[J].SeminOncol 2000,27(6):657 -666
6 Wiechec M,Kempf Haber M,Zaluska A,et al.Non Hodgkin lymphoma duringpregnancy[J].Ginekol Pol,2005,76(2):135 - 140
7 Greenlund LJ,Letendre L,Tefferi A.Acute leukemia during pregnancy:a single institutional experience with 17 cases[J].Leuk Lymphoma,2001,41(5 -6):571 -577
8 Dilek I,Topcu N,Demir C,etal.Hematologicalmalignancy and pregnancy:asingle - institution experience of 21 cases[J].Clin Lab Haematol,2006,28(3):170 -176
9 Aviles A,Neri N.Hematologicalmalignancies and pregnancy:a final report of 84 children who received chemotherapy in utero[J].Clin Lymphoma,2001,2(3):173 -177
10 Cardonick E,Usmani A,Ghaffar S.Perinatal outcomesof apregnancy complicated by cancer,including neonatal follow -upafter in utero exposure to chemotherapy:results of an internationalregistry[J].Am JClin Oncol,2010,33(3):221 - 228
11 Brenner B,Avivi I,Lishner M.Haematological cancers in pregnancy[J].Lancet,2012,379(9815):580 -587

