酸性条件下高压均质对大豆蛋白结构与功能特性的影响
源博恩,赵强忠,赵谋明
(华南理工大学轻工与食品学院,广东广州510640)
酸性条件下高压均质对大豆蛋白结构与功能特性的影响
源博恩,赵强忠,赵谋明*
(华南理工大学轻工与食品学院,广东广州510640)
通过还原电泳、粒度分布以及内源荧光扫描光谱等手段研究了酸性条件(pH3.0)下高压均质处理对大豆蛋白结构的影响,并测定了改性样品功能特性的变化。结果表明,酸性条件下高压均质对大豆蛋白亚基组成影响较小。随着均质压力的上升,改性样品的粒径呈现先增大后下降的趋势,在40MPa时达到最大值,为94.33nm;而内源扫描最大吸收波长λmax也呈现先增大后下降的过程,表明大豆蛋白结构先展开后聚集,在20MPa时,其λmax为336.0nm,展开程度达到最大。功能特性方面,均值压力为20MPa时能有效改善大豆蛋白的溶解性;其乳浊液的粒径随着均质压力的增大而不断下降。
大豆蛋白,酸处理,高压均质,结构,功能特性
1 材料与方法
1.1 材料与仪器
低温脱脂豆粕 山东禹王实业有限公司产品,蛋白质含量(质量分数)为47.86%;牛血清蛋白(BSA) Sigma Fitzgerald公司产品;其它试剂 为分析纯。
高压均质机 丹麦APV公司;SP-721可见分光光度计 上海精密仪器仪表有限公司;pHS-25数显pH计 瑞士梅特勒-托利多公司;电泳槽 北京六一仪器厂;F7000荧光分光光度计 日本日立公司; Nano-ZS&MPT-2Zeta电位及纳米粒度分布仪 英国Malvern公司。
1.2 实验方法
1.2.1 酸解离-均质样品制备 样品的制备过程。豆粕与去离子水按1∶15(w/w)的比例混合,用2mol/L的NaOH调节 pH至7.5,浸提1h后,8000×g离心20min去除残渣,以1mol/L的HCl调节pH至4.5,酸沉后8000×g离心20min,所得沉淀加5倍(w/w)去离子水复溶,分散均匀之后,平均分成六等份,其中一份用1mol/L NaOH调至pH 7.0,用去离子水透析,然后冻干得到SPI。另外五份用1mol/L的HCl调节pH至3.0,并稳定2h。其中一份用1mol/L的NaOH调至pH7.0,用去离子水透析,然后冻干得到AT;另外四份分别使用20、40、60、80MPa进行均质处理,处理后用1mol/L的NaOH调至pH 7.0,用去离子水透析,然后冻干得到A-HPH20、A-HPH40、A-HPH60和A-HPH80。
1.2.2 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE) 参照LaemmLi方法[5]。分离胶浓度为12%(质量分数,下同),浓缩胶浓度为5%。电泳前将已和样品缓冲液混合的样品煮沸5min,上样量为10μL,凝胶电泳于恒流下进行,在浓缩胶中电流为40mA,进入分离胶后增至80mA。凝胶染色及脱色后,于凝胶成像系统进行成像处理。
1.2.3 荧光光谱分析 采用F-7000荧光分光光度计测定各样品的荧光光谱[6]。样品的质量浓度为0.10g/L,荧光发散光谱分析以蛋白质内部荧光基团为探针,荧光光谱在290nm激发,扫描波长为300~400nm,激发和发射狭缝宽均为5nm,电压为500mV。1.2.4 粒度测定 将1mg/mL的样品溶液用0.2mol/L的NaOH调至pH7.0,室温下搅拌并稳定1h。根据Zhang[7]的方法,采用激光纳米粒度测定仪进行粒度测定。
1.2.5 溶解性的测定 将1%的样品溶液用0.2mol/L的NaOH调至pH7.0,振荡10min,然后离心(10000×g,20min),上清液中的蛋白质采用Lowry法[8]测定,利用BSA做标准曲线,测定500nm处的吸光值。根据样品中蛋白质含量和溶液中蛋白质含量比值计算溶解度。1.2.6 乳化特性的测定 将各样品配成质量分数为2%的溶液,加入体积分数为20%的玉米油,30MPa高压均质1次,制成乳状液,于常温静置24h,按质量比1∶1000用去离子水稀释,采用粒度分布仪测定乳状液中粒子大小及其分布[9]。
1.2.7 数据统计与分析 数据均为三次测定的平均值,并使用Excel2003作图。
2 结果与讨论
2.1 改性样品的SDS-PAGE电泳分析
从SDS-PAGE电泳图 1可以看出,酸处理(pH3.0)以及在酸性条件下经过均质处理的大豆蛋白,其电泳图谱条带与原始SPI进行对比,并没有出现明显的差别,说明酸性条件下均质处理对大豆蛋白亚基结构的影响并不大。但在分子量约为20100u的区域以及分子量大于97000u的区域都产生了少量新的条带,并且随着均质压力的升高,条带颜色逐渐加深。说明在酸性条件下随着均质压力的升高,部分高分子量肽链发生断裂,形成分子量相对较小的肽链,而与此同时,亚基之间发生交联聚集,形成新的亚基,由于在SDS-PAGE电泳中使用到破坏二硫键、疏水相互作用以及氢键等作用力的试剂,因此新的高分子亚基可能是由于共价相互作用而形成的。

图1 SPI、各改性样品及标准分子量样品的SDS-PAGE图谱Fig.1 SDS-PAGE of all the samples and marker
2.2 各改性样品内源荧光扫描分析
在290nm辐射波激发下,大豆蛋白荧光发射光谱主要来自于色氨酸残基,又名内源荧光光谱,其峰位在波长325~350nm之间。荧光强度和最大吸收波长λmax的改变反映了色氨酸残基变化的程度和所处微环境的变化。Lakemond等人研究表明[10],11S在发生亚基解离的时候,内源荧光扫描的最大吸收波长λmax会向长波长的方向移动(红移)。
SPI、酸处理样品以及酸性条件下不同均质压力处理的样品,其内源荧光扫描最大吸收波长如图2所示。从图2可以看出,AT的λmax为335.2nm,大于常规工序(pH4.5酸沉后回调pH7.0复溶)所得SPI的333.0nm,这表明酸处理使大豆蛋白结构展开,内部活性基团暴露,在回调中性(pH7.0)之后,虽然大豆蛋白发生重聚集,但往往不能恢复到原来的结构,依然有部分活性基团暴露在蛋白质的表面,所以导致酸处理后的样品其色氨酸暴露程度大于原始SPI,最大吸收波长呈现出红移的趋势。当均质压力为20MPa时,λmax进一步红移,达到336.0nm,大豆蛋白展开程度进一步加大,导致回调中性后暴露的活性基团更多。而从40MPa开始,随着均质压力的增大,最大吸收波长开始下降(蓝移),当均质压力达到80MPa时,λmax仅为333.6nm,表明随着均质压力的增大,大豆蛋白的聚集程度加大,结构越来越紧密,包裹于蛋白内部的活性基团越来越多。
2.3 各改性样品粒径的变化
SPI、酸处理以及酸性条件下不同均质压力处理后,大豆蛋白的粒径变化如图3所示。从图3可以看出,单纯酸处理后回调中性所得样品的粒径为63.42nm,大于SPI的51.07nm。结合内部荧光扫描数据可以发现,在酸处理的过程中,大豆蛋白结构发生展开,结构变得松散,内部活性基团暴露,在回调中性的过程中,大豆蛋白虽然会发生重聚集,但难以恢复到天然的紧密球状结构,因此导致粒径相对于天然SPI变大,这一结果与Utsumi等人所得结论一致[11]。

图2 SPI及各改性样品内源扫描最大吸收波长的变化Fig.2 λmaxof fluorescence spectroscopy of all the samples
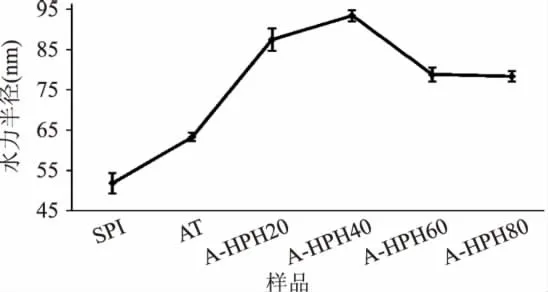
图3 SPI及各改性样品平均粒径的变化Fig.3 The average hydrodynamic diameter of all the samples
而在酸性条件下,随着均质压力的升高,大豆蛋白粒径呈现先增大后减小的过程,这主要是由于蛋白的展开和聚集而导致的。在均质压力为20MPa时,大豆蛋白粒径增大至86.55nm,同时其样品内源荧光最大吸收波长发生红移,可以证实20MPa均质导致了大豆蛋白结构进一步展开,从而使其粒径增大。当均质压力达到40MPa时,其粒径继续增大至94.33nm,但其内源扫描最大吸收波长发生蓝移,说明在40MPa均质的过程中,前期发生展开的大豆蛋白开始发生聚集,形成粒径较大的聚集体。而随着均质压力的进一步升高,大豆蛋白粒径下降。当均质压力达到80MPa时,其粒径为79.80nm,同时内源荧光扫描最大吸收波长继续蓝移,说明80MPa形成的聚集体结构较其他改性样品更紧密。
2.4 各改性样品溶解性的分析
SPI、酸处理样品以及酸性条件下不同压力均质处理的样品,溶解性的变化如图4所示。由图4可知,酸处理的样品溶解性略高于SPI,这可能是因为酸处理过程中大豆蛋白结构展开,暴露出活性基团,增强了蛋白的水合作用[12]。而在酸性条件下,随着均质压力的增加,蛋白的溶解度呈现先增大后下降的趋势。可能的原因是,在酸性条件下,均质压力较低时(20MPa),可以有效促使蛋白结构的进一步展开,暴露更多的活性基团,因此溶解性得到改善。而当均质压力进一步增大时,由于大豆蛋白分子开始发生聚集,活性基团包埋于分子内部,水合能力下降,因此溶解性下降。

图4 中性条件下SPI及各改性样品溶解度的变化Fig.4 The solubility in pH 7.0 of all the samples
2.5 各改性样品乳状液粒度分析
乳状液中粒度分布是影响乳状液稳定性的关键因素,也是评价样品乳化性的重要指标,乳状液粒子越大,乳析过程越快,乳析率越高[13]。SPI、酸处理样品及酸性条件下不同均质压力处理的样品,其乳状液的粒度分布如图5和表1所示。可以看出,酸处理后的样品,其乳状液表面积加权平均值D[3,2]为1.508小于SPI的1.572,这是由于酸处理后的样品表面暴露较多的活性基团,有效降低油滴的表面张力而导致的。而随着均质压力的升高,样品乳状液的D[3,2]和D[4,3]均呈现先增大后降低的趋势,对应乳化性则呈现先下降后提升的趋势。在20MPa时,可能由于大豆蛋白展开程度过大,内部基团暴露过多,造成分子之间静电排斥力较大,不利于大豆蛋白分子间的相互作用,无法在油滴表面形成网络结构阻止油滴的聚集,因此所得乳状液D[3,2]为1.555,乳化性较差。而随着均质压力的增大,在40~80MPa之间,乳状液D[3,2]和D[4,3]都不断下降,D[3,2]最小可达0.631。这是因为在较高的均质压力下大豆蛋白分子之间相互作用加强,形成聚集体,并且结构不断趋于紧密,分子间通过一系列共价或非共价作用力在油滴表现形成具有一定强度的网络结构,大大降低油滴的表面张力,有效阻止油滴之间的聚集,体现出较好的乳化特性。
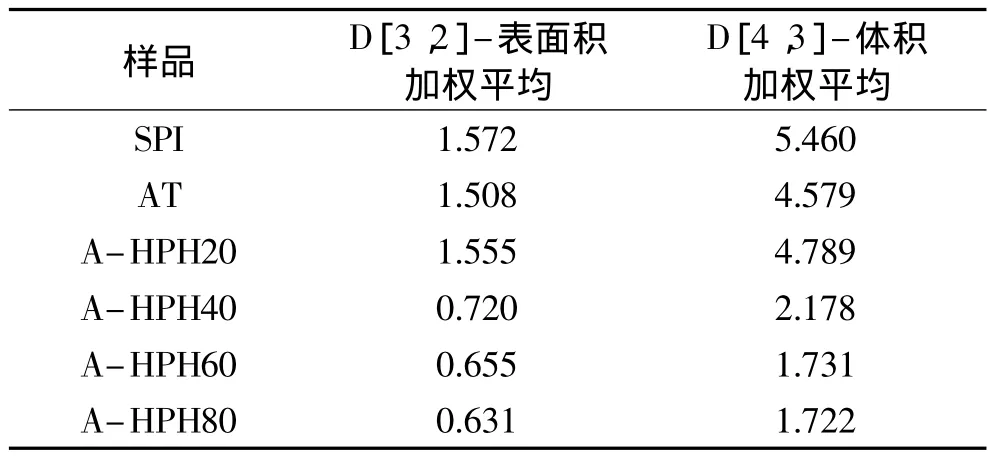
表1 SPI及各改性样品乳状液D[3,2]和D[4,3]的变化Table 1 D[3,2]and D[4,3]of all the samples’emulsion
3 结论
通过SDS-PAGE分析、内部荧光扫描最大吸收波长的变化以及平均粒径的分析可以看出,pH3.0酸处理可以有效使蛋白结构发生展开,暴露出更多的活性基团,其功能特性相对于SPI有所改善。而在酸性条件下经过不同均质压力处理的样品,呈现出先进一步解离而后发生聚集的变化趋势,并且聚集程度和紧密度随着均质压力的增大而增大。在功能特性方面,低压均质(20MPa)可以有效提高大豆蛋白的溶解性,而较高均质压力(40~80MPa)有利于乳化特性的改善,这与蛋白的聚集与解离程度有关。

图5 SPI及各改性样品乳状液的粒度分布Fig.5 The particle size distribution of all the samples’emulsions
[1]Liu C,Wang X S,Ma H,et al.Functional properties of protein isolates from soybeans stored under various conditions[J].Food Chemistry,2008,111:29-37.
[2]Luo D H,Zhao Q Z,Zhao M M,et al.Effects of limited proteolysis and high-pressure homogenisation on structural and functional characteristics of glycinin[J].Food Chemistry,2010,122:25-30.
[3]Tang C H,Wan X S,Yang X C.Enzymatic hydrolysis of hemp (Cannabis sativa L.)protein isolate by various proteases and antioxidant properties of the resulting hydrolysates[J].Food Chemistry,2009,114:1484-1490.
[4]涂宗财,张雪春,刘成梅.动态超高压均质对花生蛋白溶解性和乳化性的影响[J].食品工业科技,2007,28(6):88-89.
[5]LaemmLi U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227 (8):680-685.
[6]VoutsinasL P,CheungE,NakaiS.Relationshipsof hydrophobicity to emulsifying properties of heat denatured proteins[J].Journal of Food Science,1983,48(1):26-32.
[7]Zhang Y H,Tang C H,Wen Q B,et al.Thermal aggregation and gelation of kidney bean(Phaseolus vulgaris L.)protein isolate at pH 2.0:Influence of ionic strength[J].Food Hydrocolloids,2010,24(4):266-274.
[8]Lowry O H,Rosebrough N J,Farr A L,et al.Protein measurement with the Folin-phenol reagent[J].Journal of Biological Chemistry,1951,193:265-268.
[9]Annett K,Inta S,Gerald M.Stability of water-in-oilemulsions containing phosphatidylcholine-depleted lecithin[J]. Food Hydrocolloids,2005,19:635-640.
[10]Lakemond C M M,de Jongh H H J,Hessing M,et al.Soy Glycinin:influence of pH and ionic strength on solubility and molecular structure at ambient temperatures[J].Journal of Agriculture and Food Chemistry,2000,48(6):1985-1990.
[11]Utsumi S,Nakamura T,Harada K,et al.Occurrence of dissociable and undissociable soybean glycinin[J].Agriculture and Biological Chemistry,1987,51(8):2139-2144.
[12]Turgeon S L,Cauthier S F,Paquin P I.Emulsifying property of whey peptide fractions as a function of pH and Ionic Strength[J].Food Sci,1992,57(3):601-604.
[13]龙肇,赵强忠,赵谋明.单甘酯和蔗糖酯复配比例对核桃乳稳定性的影响[J].食品发酵与工业,2009(5):181-185.
Effects of high-pressure homogenization in acid condition on the structure and functional properties of soybean proteins
YUAN Bo-en,ZHAO Qiang-zhong,ZHAO Mou-ming*
(College of Light Industry and Food Science,South China University of Technology,Guangzhou 510640,China)
Through SDS-PAGE,hydrodynamic diameter and fluorescence spectroscopy,the effects of highpressure homogenization in acid conditions(pH3.0)on the structure of soybean proteins were investigated.The changes of protein functional properties were also investigated.The results showed that high-pressure homogenization in acid conditions led to slight impacts on the subunits of soybean proteins.With the homogenization pressure increasing,the hydrodynamic diameter would increase,and decrease later,which was the highest(94.33nm)at 40MPa.A similar change tendency was observed on the λmaxof fluorescence spectroscopy of soybean proteins,indicating the structures of soybean proteins unfolded and then aggregated.When the homogenization pressure was 20MPa,a most significant unfolding was obtained,and the λmaxwas 336.0nm.As to the functional properties,the solubility was improved remarkably when the pressure reached 20MPa.The particle size distribution of emulsion decreased with the homogenization pressure increasing.
soybean protein;acid treatment;high-pressure homogenization;structure;functional properties
TS201.2+1
A
1002-0306(2012)08-0117-04
由于大豆蛋白富含营养成分及具有优良的功能性质,因此被广泛应用于乳制品、烘焙食品以及肉制品等各类型食品中。据报道,目前60%的食品均含有大豆蛋白[1]。为了满足生产需要及各类型食品对特定功能特性的要求,在实际生产中一般需要对大豆蛋白进行改性处理以提高某方面的功能特性。但由于大豆蛋白中的球蛋白,尤其是11S蛋白,结构紧密且功能特性较差,若使用单一改性手段进行改性处理,能耗高,效率低,且改性效果不佳[2]。因此,目前国内外倾向于研究复合手段对蛋白质的改性作用。研究报道表明,在酸性条件下大豆蛋白会发生亚基解离导致结构展开,内部活性基团暴露[3]。在此基础上配合其他处理手段能在较温和条件下使蛋白分子发生聚集,形成分子柔性较强的可溶性聚集体,有效改善功能特性。近年来,由于物理改性所得产品无毒无副作用而且可控性较强,多种物理改性方式已经广泛应用到实际生产中。由于高压均质对蛋白产生剪切效应、空穴作用以及热效应等作用,其对蛋白改性具有较好的效果[4]。因此高压均质已成为国内外对于蛋白改性方法的研究热点。本文在pH3.0的条件下使用不同均质压力对大豆蛋白进行酸解离-高压均质处理,研究其对大豆蛋白功能特性的影响,以期为大豆蛋白改性技术的发展提供理论指导。
2011-06-24 *通讯联系人
源博恩(1986-),男,硕士研究生,研究方向:食品生物技术。
广东省高等学校高层次人才项目(粤教师函(2010)79号);国家自然科学基金(20806030)。

