高原酸奶中乳酸链球菌产生的乳酸链球菌素纯化鉴定研究
杜 琨,陈锦屏,苏凤贤,陈 雪
(1.陕西师范大学食品工程与营养科学学院,陕西西安710062;2.武警工程学院军事经济系,陕西西安710086;3.河西学院农业与生物技术学院,甘肃张掖734000)
高原酸奶中乳酸链球菌产生的乳酸链球菌素纯化鉴定研究
杜 琨1,2,陈锦屏1,苏凤贤3,陈 雪1
(1.陕西师范大学食品工程与营养科学学院,陕西西安710062;2.武警工程学院军事经济系,陕西西安710086;3.河西学院农业与生物技术学院,甘肃张掖734000)
目的:对从高原酸奶中提取的乳酸链球菌产生的乳酸链球菌素进行纯化及鉴定。方法:采用分离、凝胶层析、抑菌实验、高效液相色谱法来纯化乳酸链球菌素,用凝胶电泳来鉴定其纯度,确定其分子量。结果:生产的乳酸链球菌素具有抑菌性,将该抑菌成分与乳酸链球菌素标准品进行SDS-PAGE凝胶电泳,通过比较电泳图谱一致。结论:本实验得到的抑菌成分即为乳酸链球菌素,且纯度高,分子量大约为3300u。
高原酸奶,乳酸链球菌素,纯化,鉴定
乳酸链球菌素又称乳酸菌肽,它是由乳酸链球菌发酵产生的一种线型多肽,呈白色、淡黄色至浅棕色易流动状粉末,分子式是C14H228N42O37S7,平均分子量为3348u,乳酸链球菌素作为一种新型安全高效的天然防腐剂,已经被广泛应用于肉制品、乳制品、罐头食品、植物蛋白食品以及酿酒、果汁饮料和焙烤食品的防腐[1]。目前国内常采用将发酵液经各种层析分离的方法来制备乳酸链球菌素。如陈秀珠等[2]用正丙醇从氯化钠饱和的发酵液中提取2次,再用丙酮沉淀得到乳酸链球菌素粗制品,再经CM-SephadexC-25柱层析,得到聚丙烯酰胺凝胶电泳纯的乳酸链球菌素组分;刘稳等[3]采用先将发酵液调至pH2左右,离心去除细胞,上清液经中空纤维超滤器超滤,大孔树脂XAD-2吸附,CM-SephadexC-25柱层析和SephadexG-50柱层析的方法,得到乳酸链球菌素。前者需要使用大量的正丙醇、丙酮等有机溶剂,存在着有机溶剂处理及对环境的污染问题;后者虽然没有使用有机溶剂,但去除细胞以后的发酵液成分很复杂,有培养基的降解物、细菌的各种代谢产物等,乳酸链球菌素的回收率难以提高。菌种的来源会影响其生产乳酸链球菌素的能力,同时实验菌种的逆生能力较差导致实验的可重复性差,而高原酸奶中的乳酸链球菌具有很强的逆生能力,可以大大提高实验的可重复性。因此,本实验采用高原酸奶中分离的乳酸链球菌作为实验菌株,培养取其发酵液,在通过一系列的实验对其中的乳酸链球菌素进行分离纯化和鉴定,以期为国内乳酸链球菌素的生产和开发提供新的技术路线和理论依据。
1 材料与方法
1.1 材料与仪器
乳酸链球菌 高原酸奶中分离得到,并经过上海生工有限公司鉴定为乳酸链球菌;金黄色葡萄球菌 由陕西师范大学食品工程与营养科学学院微生物发酵研究室提供;发酵培养基[4]准确称取蔗糖30g、酵母膏20g、磷酸氢二钾12.5g、硫酸镁0.4g、蛋白胨10g、氯化钠3g、4mL吐温80,溶解于1000mL蒸馏水中;指示菌培养基 准确称取蛋白胨8g、酵母膏5g、葡萄糖5g、氯化钠5g、磷酸氢二钠2g、10mL吐温80、琼脂15g,溶解于1000mL蒸馏水中,并调节pH为6.8。将乳酸链球菌斜面菌种用接种针挑取少量接种于液体培养基中,混合均匀后于摇床中培养,培养温度:37℃,摇床速度:200r/min,培养时间:30h;磷酸氢二钠,柠檬酸,氢氧化钠,HCl,SephadexG-50,磷酸氢二钾,乙腈(色谱纯),乳酸链球菌素标准品(Nisin),Marker(3~4.5u),SDS-PAGE凝胶,考马斯亮蓝R-250,其余试剂均为分析纯。
高效液相色谱仪 Breeze1525,美国Waters公司;小型Trans Blot垂直电泳仪 北京六一仪器厂;层析柱 ø1.0cm×100cm,上海楚柏实验室设备有限公司;HL-2S型恒流泵 上海青浦沪西仪器厂;XWT-S型台式记录仪 上海自动化仪表三厂;微量进样器 上海安亭微量进样器厂。
1.2 实验方法
1.2.1 乳酸链球菌素的分离 乳酸链球菌素粗提样品的制备[5]:取发酵液离心除去沉淀,转速2500r/min,时间20min。取上清液用碱液将pH调节至9.0,室温放置20min,出现絮状沉淀后收集沉淀,并用pH2.2的磷酸氢二钠-柠檬酸缓冲溶液溶解沉淀,过滤,取上清液。再用碱液将pH调节至9.0,出现沉淀后收集沉淀,并用无菌水溶解,用酸液调节pH至2.0,出现沉淀后过滤除去沉淀,取上清液,即为乳酸链球菌粗体样品。
1.2.2 乳酸链球菌素的纯化
1.2.2.1 SephadexG-50凝胶层析[6-8]利用凝胶柱G50进行分离纯化,收集不同纯化时间所出现的洗脱峰的洗脱溶液。将收集器参数设定为每5min收集一管,流速设定为213mL/min,用0.02mol/L的HCl进行洗脱,灵敏度设定为0.5A,检测波长设定为λ=280nm,根据记录仪显示峰值的时间可以判断出哪些管中收集的液体含有较多量的蛋白质类物质,并且对不同洗脱峰的物质进行进一步性质判断及纯化。
1.2.2.2 抑菌活性的测定 采用杯碟法测定各洗脱峰的活性[9]。
1.2.2.3 高效液相色谱分析[10]将经过SephadexG-50处理的第十一管分离物与未经过处理的发酵液和乳酸链球菌素标准品分别以高效液相色谱测定其色谱图。检测波长为215nm,流速1mL/min,流动相0.01mol/L磷酸氢二钾∶乙腈(75∶25)。
1.2.2.4 乳酸链球菌素的纯化效果鉴定 采用SDSPAGE(十二烷基硫酸钠—聚丙烯酰胺)凝胶电泳法[15-18]对乳酸链球菌素的纯化效果进行鉴定,并将实验得到的具有抑菌性质的分离物质与乳酸链球菌素标准品在同一块胶上进行电泳,从而对提取得到的乳酸链球菌素进行初步鉴定。
2 结果与分析
2.1 SephadexG-50凝胶层析
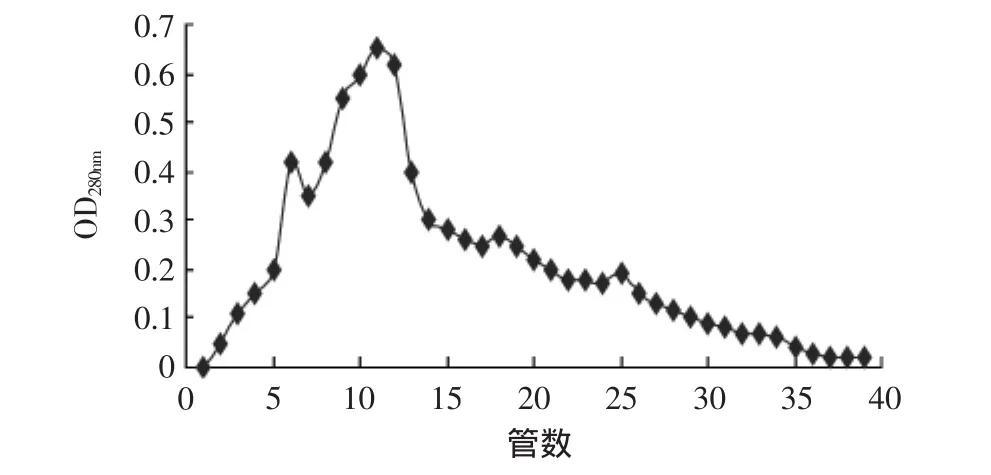
图1 发酵液中乳酸链球菌素SephadexG-50凝胶层析分离图Fig.1 Broth of Nisin SephadexG-50 gel chromatography separation
图1为发酵液粗提物凝胶层析记录仪记录图,图中出现两个洗脱峰,分别是在第六管和第十一管时出现了大小不同的两个峰值,表明在第六管和第十一管内分离出的物质中均含有蛋白质类物质,具体成分需要通过进一步的实验才能确定。
2.2 抑菌性分析
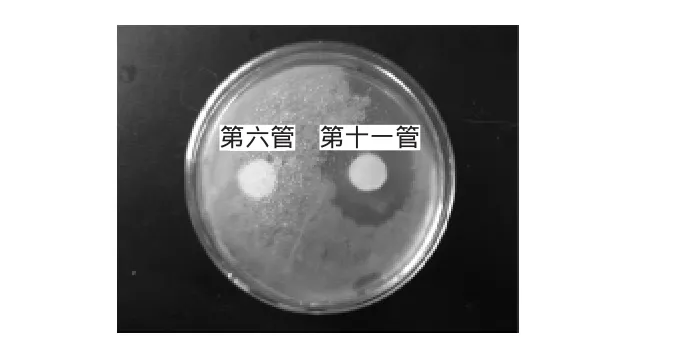
图2 抑菌圈对比图Fig.2 Comparison of bacteriostatic ring
图2为两个峰值的物质对金黄色葡萄球菌的抑菌性分析图,从图中可看出,第六管不具有抑菌性,第十一管具有抑菌性。这说明,通过SephadexG-50凝胶层析达到了分离发酵液中不同蛋白组分的目的。
2.3 高效液相色谱分析
图3为发酵液的高效液相色谱图,图中出峰较多,分别是在2.4847、2.8324、3.6456min时出了共三个峰。这说明发酵液中含有的蛋白质种类较多,成分并不单一。
图4为第十一管分离物的高效液相色谱图,图中出峰较少,主峰只有一个,即在2.4857min出现的一个高峰,说明SephadexG-50凝胶层析达到了一定的分离效果,经过SephadexG-50处理的洗脱物质成分比较单一。
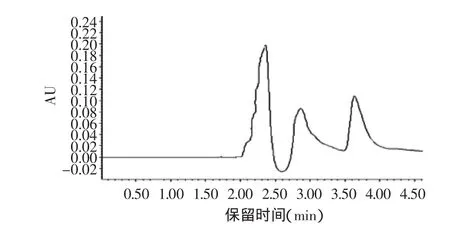
图3 发酵液的高效液相色谱图Fig.3 Fermentation broth by high performance liquid chromatography graph
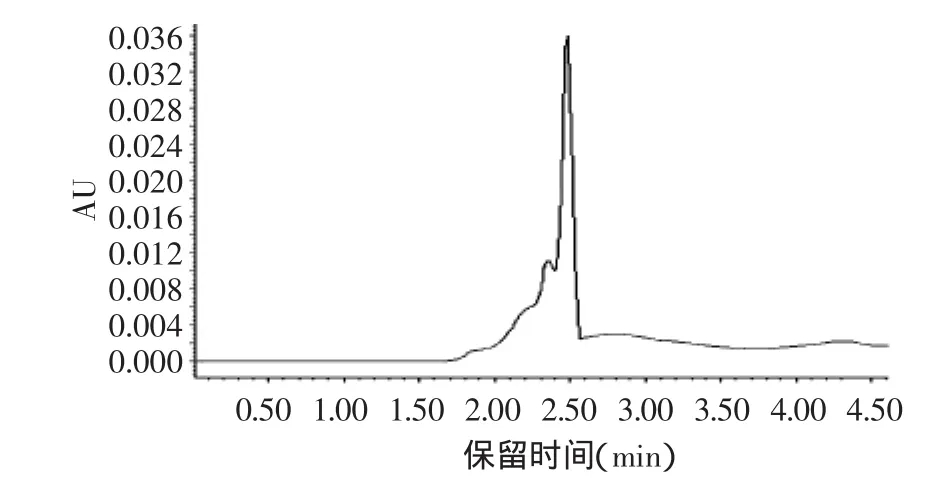
图4 第十一管分离物的高效液相色谱图Fig.4 The eleventh tubular isolate HPLC graph
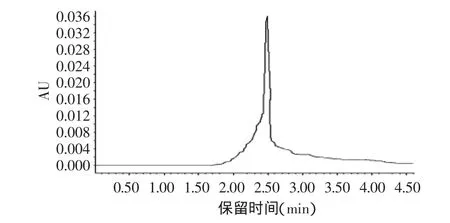
图5 乳酸链球菌素标准品高效液相色谱图Fig.5 Nisin standard HPLC chromatogram
图5是乳酸链球菌素标准品的高效液相色谱图。图中只出现一个峰值,表明只含有一种物质乳酸链球菌素,出峰时间在2.4275min,出峰时间基本与第十一管分离提取的乳酸链球菌素出峰时间相同。
2.4 乳酸链球菌素的纯化效果鉴定

图6 发酵液(A)与第11管洗脱液(B)的电泳图谱Fig.6 Broth(A)and the eleventh eluents(B)electrophoresis atlas
图6为具有抑菌活性的洗脱液和发酵液进行SDS-PAGE电泳的对比图,由图可知发酵液中有多个蛋白条带,经过凝胶层析分离的样品中仅出现一个蛋白条带,说明SephadexG-50凝胶层析处理的样品纯度得到很大提高。
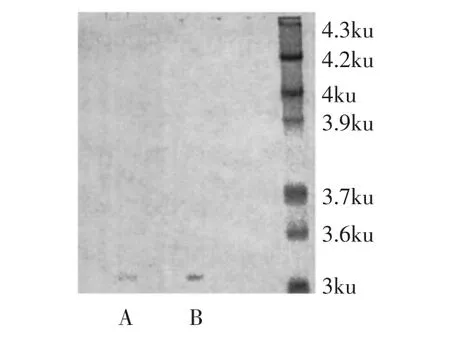
图7 乳酸链球菌素(A)与标准品(B)的电泳图谱Fig.7 Nisin(A)and standard(B)electrophoresis atlas
图7为乳酸链球菌素标准品和实验得到抑菌成分SDS-PAGE凝胶电泳对比图。图中可以看出,两者的条带基本一致,说明本实验得到的抑菌成分即为乳酸链球菌素,且分子量大约为3300u。
3 结论
本实验对高原酸奶中分离得到的乳酸链球菌进行培养,得到发酵液,并对其中的乳酸链球菌素进行了有效的纯化与鉴定,通过SephadexG-50凝胶层析分离得到了具有抑菌活性的物质成分,并将该抑菌成分与乳酸链球菌素标准品进行SDS-PAGE凝胶电泳,通过比较电泳图谱,可确定该成分即为乳酸链球菌素。
[1]Larid R,Kheadr E E,Benech R-O,et al.Liposome encapsulated Nisin Z:optimization,stability and release during milk fermentation[J].International Dairy Journal,2003,13(4):325-336.
[2]陈秀珠,何松,龙力红,等.乳酸乳球菌AL2产生的乳酸菌肽的提纯和性质[J].微生物学报,1996,36(4):269-275.
[3]刘稳,朱文淼,马桂荣.乳酸菌肽的分离纯化和部分生物学性质[J].生物化学杂志,1996,12(5):588-592.
[4]朱会霞,孙金旭,魏淑珍,等.HS-5乳酸链球菌发酵培养基优化研究[J].酿酒科技,2008,6(6):35-37.
[5]吴红艳,陈飞,桓明辉,等.乳酸菌肽分离纯化研究[J].微生物学杂志,2006,27(2):104-106.
[6]刘进元,潘乃遂,陈章良.抗菌蛋白LCILB的纯化及性质[J].微生物学报,1993,33(4):269-273.
[7]赵荣乐,郑光宇.离子交换层析和凝胶过滤分离纯化抗凝血多肽[J].北京师范大学学报:自然科学版,2002,38(4):544-548.
[8]张春艳,林学颜.人血清载脂蛋白赶的大量分离、纯化及鉴定[J].中国动脉硬化杂志,1996,4(2):136-140.
[9]中华人民共和国卫生部.中华人民共和国药典[M].北京,1985:95-98.
[10]吴琼,生英涛,唐名山,等.乳酸乳球菌发酵液中乳链菌肽的分离纯化[J].食品科学,2003,25(9):103-106.
Purification and identification of Nisin produced by Lactococcus lactis in plateau yogurt
DU Kun1,2,CHEN Jin-ping1,SU Feng-xian3,CHEN Xue1
(1.College of Food Engineering and Nutritional Science,Shaanxi Norma University,Xi’an 710062,China;2.Department of Military Economics,Engineering College of Chinese Armed Police Force,Xi’an 710086,China;3.College of Agriculture and Biotechnology,Hexi University,Zhangye 734000,China)
Objective:To purify and characterize the Nisin that was produced by Lactococcus lactis which separated from plateau yogurt.Method:Methods including separation,gel chromatography,antibacterial experiment and high performance liquid chromatography(HPLC)were used to purify the Nisin.Its pureness and molecular weight were determined by using gel electrophoresis.Results:The Nisin with antibacterial and its standard substance were electrophoresed on polyacrylamide gel.The electrophoresis pattern were analyzed to find the differentially.The results showed that it was well agreement between the products and its standard substance.Conclusion:The antibiotic composition was the Nisin,and it was high purity and its molecular weight was about 3300u.
plateau yogurt;Nisin;purification;identification
TS201.3
A
1002-0306(2012)07-0169-03
2011-06-22
杜琨(1975-),男,博士研究生,副教授,研究方向:动物资源利用及功能食品研究。

