高产琥珀酸放线杆菌的诱变选育
林日辉,黄新林,黄文勤
(1.广西民族大学化学与生态工程学院,化学与生物转化过程新技术广西高校重点实验室,广西南宁530006;2.南宁奕德环境科技有限公司,广西南宁530003)
高产琥珀酸放线杆菌的诱变选育
林日辉1,黄新林1,黄文勤2
(1.广西民族大学化学与生态工程学院,化学与生物转化过程新技术广西高校重点实验室,广西南宁530006;2.南宁奕德环境科技有限公司,广西南宁530003)
对琥珀酸放线杆菌(Actinobacillus succinogenes mdrh-5)进行紫外-亚硝基胍复合诱变,采用变色圈、氟乙酸耐受和CuSO4快速分析结合的筛选方法,获得1株高产琥珀酸突变菌株。与野生菌相比,突变株琥珀酸产量提高了43%,副产物乙酸降低了66%,突变株遗传性质稳定。
琥珀酸,发酵,紫外-亚硝基胍复合诱变
1 材料与方法
1.1 材料与仪器
琥珀酸放线杆菌(A.succinogenes mdrh-5) 本实验室从牛的瘤胃中分离保存;琥珀酸 sigma公司;亚硝基胍 北京中胜华腾科技有限公司;酵母提取物 广东环凯微生物科技有限公司;胰蛋白胨 OXOID公司;氟乙酸钠 本实验室制备;其他试剂 均为国产分析纯。
LC-20A高效液相色谱仪 日本岛津公司;Aminex HPX-87H色谱柱 美国伯乐公司;F254硅胶板 德国Merck公司;THZ-C恒温摇床,磁力搅拌器等。
1.2 实验方法
1.2.1 培养基的制备
1.2.1.1 菌种传代保藏培养基(1L) 酵母提取物3.0g,蛋白胨10.0g,氯化钠5.0g,琼脂20.0g,pH7.0~7.2。
1.2.1.2 平板分离培养基(1L) 酵母提取物5.0g,蛋白胨5.0g,葡萄糖20.0g,氯化钠5.0g,琼脂20.0g,溴甲酚氯0.1g,pH7.0~7.4,添加适宜浓度氟乙酸钠。
1.2.1.3 种子培养基(1L) 胰蛋白胨10.0g,酵母提取物5.0g,氯化钠10.0g,pH7.0~7.2。
1.2.1.4 发酵培养基(1L) 葡萄糖20.0g,酵母提取物5.0g,磷酸氢二钾1.0g,氯化钠0.5g,硫酸铵1.0g,二水氯化钙0.5g,六水氯化镁0.5g,碱式碳酸镁1.3g,pH7.0~7.2。
1.2.2 诱变及选育
1.2.2.1 野生菌株生长曲线的绘制 将野生菌株按1%接种量接种于五瓶同一时期配制的种子培养基中,于37℃、150r/min条件培养30h,每隔2h取样,测定OD600,绘制菌株生长曲线。
1.2.2.2 菌悬液的制备 用接菌环挑取少量斜面种子接种于50mL/250mL种子培养基中,37℃水浴摇床培养10~12h,使菌体处于对数生长期,无菌操作下离心收获菌体,用0.9%的生理盐水洗涤两次,并制备菌悬液,使细胞个数在107cfu/mL。
1.2.2.3 紫外诱变致死率的测定 取上述菌悬液10mL移入灭菌培养皿中,磁力搅拌50r/min,在20W紫外灯下20cm分别照射0、15、25、45、65、90s,取样1mL适当稀释,涂布于LB平板,37℃避光厌氧培养48h计菌落数,计算致死率。
1.2.2.4 NTG诱变致死率的测定 取预处理菌悬液5mL,添加NTG至0.3mg/mL,150r/min振荡处理0、20、40、60、80min,分别取0.5mL菌悬液,用0.16mol/L硫代硫酸钠溶液稀释10倍,终止诱变反应,离心收集细菌细胞,用生理盐水洗涤后制备菌悬液,适当稀释,涂布于LB平板,37℃厌氧培养48h计菌落数,计算致死率。
1.2.2.5 野生菌株氟乙酸钠抑制浓度的确定 在分离平板上添加氟乙酸钠浓度分别为0、0.3、0.7、1.0、1.5g/L,取0.5mL浓度约为103cfu/mL的野生菌悬液涂布平板,观察平板上菌落生长情况,确定氟乙酸钠对A.succinogenes mdrh-5的抑制浓度。
1.2.2.6 复合诱变 无菌取107cfu/mL的菌悬液10mL于灭菌平皿中,用紫外线照射25s。红光灯下,取照射后菌液5mL加入NTG处理40min后,用硫代硫酸钠中止反应,洗涤并收集菌体细胞,制备菌悬液,稀释涂布于分离平板,遮光37℃厌氧培养48h,挑取菌落较大,变色圈直径大于5mm单菌落。
1.2.2.7 摇瓶发酵培养 12h种龄的种子,按5%的接种量接种于发酵培养基。通入CO2至饱和,胶塞密封,在37℃、150r/min培养20h。发酵液于12000r/min下离心5min,上清于-20℃保存待测。
1.2.3 发酵液成分分析
1.2.3.1 CuSO4甲醇溶液显色分析 取5μL上清液,直接点样至干燥的硅胶板上,吹干,用15g/L的CuSO4甲醇溶液均匀喷洒,干燥显色。
1.2.3.2 HPLC定量分析 使用岛津LC-20A系统,色谱柱为Aminex HPX-87H柱,柱温65℃,流动相为0.005mol/L H2SO4,流速为0.6mL/min;检测器为CTO-10vp型折光示差检测器。发酵上清液经过0.45μm滤膜过滤,适当稀释后进样,进样量20μL。
1.2.4 突变株稳定性测定 将筛选出的诱变菌株在固定培养基上连续培养传8代,每代均在相同条件下发酵,测定其琥珀酸产量,考察菌种的遗传稳定性。
2 结果与分析
2.1 A.succinogenes mdrh-5生长曲线
图1表明,以种子培养基进行批式培养,A. succinogenes mdrh-5生长对数期约在2~12h,其中8~ 12h为对数生长期的中后期,此时,细胞代谢活力旺盛,并且对各种异常的条件包括诱变因素比较敏感。因此,本研究选用培养8~12h的A.succinogenes mdrh-5菌株进行诱变。

图1 野生菌A.succinogenes mdrh-5生长曲线Fig.1 Growth curve of A.succinogenes mdrh-5
2.2 紫外诱变的致死率
紫外线作为物理诱变因子,能使DNA分子形成嘧啶二聚体,减弱双键间氢键的作用,并引起双链结构扭曲变形,阻碍碱基间的正常配对,导致突变或死亡。由图2的紫外致死曲线可以看出,在0~25s内致死率随照射时间延长迅速提高,其中25s照射时间致死率为76.5%,45s后致死曲线趋于平缓并接近100%。有报道介绍70%~80%致死率有利于正突变的产生[9],故实验采用紫外线照射时间为25s。
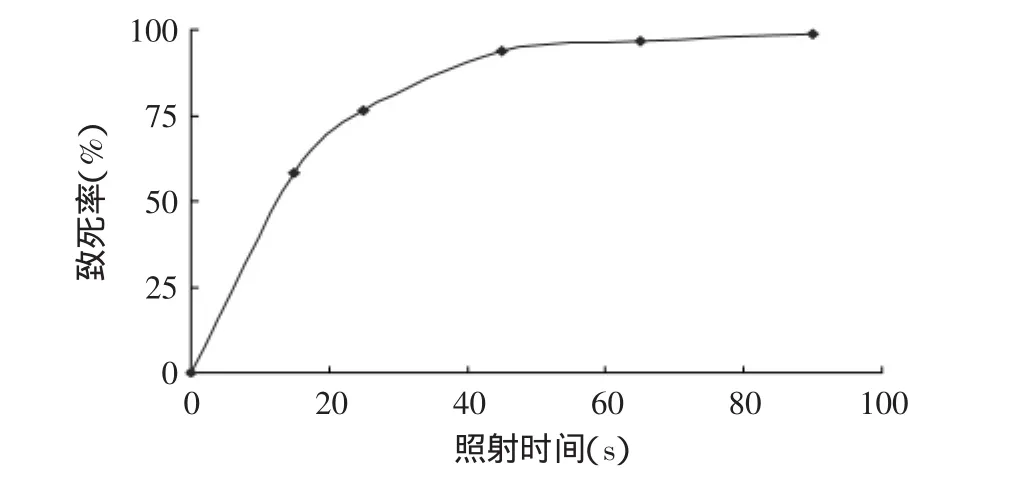
图2 紫外线诱变的致死率Fig.2 Mortality rates of ultraviolet mutation
2.3 NTG诱变的致死率

图3 NTG诱变的致死率Fig.3 Mortality rates of NTG mutation
NTG是应用广泛的化学诱变剂之一,细胞经NTG处理,可诱发GC-AT的转换,另外还可诱发DNA小范围切除、移码突变及GC对缺失的突变发生。0.3mg/mL的NTG诱变致死率如图3所示,可见,致死率随处理时间延长而增加,80min致死率接近100%。处理时间为40min的致死率为88.3%,实验选择40min作为NTG诱变处理时间。
2.4 氟乙酸浓度的选择
A.succinogenes mdrh-5副产物中杂酸含量较大(表2),其中,乙酸占副产物总量的31.4%,降低发酵产乙酸可以大幅降低副产物含量。氟乙酸为乙酸类似物,经磷酸转乙酰基酶-乙酸激酶途径转化为氟代柠檬酸,阻断正常的三羧酸循环,导致细菌细胞死亡[10]。筛选氟乙酸抗性菌株则有可能阻断磷酸转乙酰基酶-乙酸激酶途径,降低发酵过程副产物乙酸的产量,促进代谢碳流流向主产物琥珀酸。表1表明,氟乙酸钠在0~1.0g/L时,对A.succinogenes mdrh-5抑制率随氟乙酸钠浓度提高而提高,1.5g/L氟乙酸钠的抑制率达100%。本实验选择1.5g/L氟乙酸钠作为抗性突变株的筛选浓度。

表1 氟乙酸的抑制浓度Table 1 Inhibit concentration of fluoroacetic acid
2.5 琥珀酸高产菌株的筛选
2.5.1 分离平板初筛 经紫外、NTG复合诱变的菌悬液稀释涂布于含1.5g/L氟乙酸分离平板进行初筛(图4),获得463个氟乙酸抗性单菌落。根据变色圈大小从中挑取60株产酸量较大的菌株(变色圈大于5mm)。

图4 分离平板的初筛结果Fig.4 Preliminary screening result of plate separation
2.5.2 发酵液检测分析
2.5.2.1 CuSO4显色分析 H.Socˇicˇ[11]等报道了薄层层析后使用CuSO4显色对发酵产琥珀酸进行定性分析,然而TLC展开操作耗时较长、操作繁杂。本实验探索了直接用CuSO4显色半定量分析发酵液琥珀酸的方法。结果表明:在1~10g/L浓度范围内,琥珀酸浓度与色斑深浅正相关;甲酸、乙酸、乳酸等发酵副产物均不能与CuSO4显色。部分初筛菌株发酵液CuSO4显色检测结果见表2。根据5g/L标准琥珀酸色斑深浅,迅速在60株产酸菌种检出了8株疑似琥珀酸高产突变菌。
2.5.2.2 HPLC分析 由于CuSO4显色法主要用于对发酵液中琥珀酸定性分析,为了验证CuSO4分析结果,将所挑取的8株疑似琥珀酸高产突变株进行重新发酵,并采用HPLC对发酵液进行了定量分析。HPLC分离结果见图5。可见,HPLC可以有效分离发酵液中的底物、琥珀酸及各种副产物,应用外标法即可精确计算各菌株发酵液中产物及副产物含量,结果见表3。
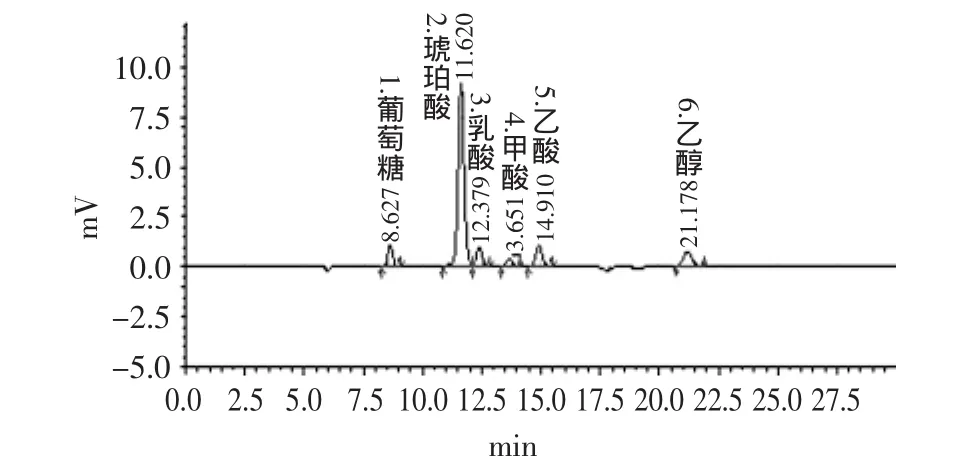
图5 M4发酵液HPLC图Fig.5 HPLC of the strain M4’s fermentation broth

表2 突变菌株发酵液的CuSO4显色检测结果Table 2 CuSO4analysis result of the mutants’fermentation broth
表3结果表明,根据CuSO4显色半定量分析法挑取的疑似琥珀酸高产菌中,87.5%菌株琥珀酸产量高于野生菌,说明本实验设计的CuSO4检测分析方法可以快速有效地从大量突变菌中鉴定出琥珀酸高产菌。其中,编号M4突变株的琥珀酸产量最高,达到7.87g/L,比野生型提高43%;主要副产物乙酸的积累比野生菌株降低66%;副产物乳酸、甲酸及乙醇的积累分别降低21%、20%和43%。
2.6 突变株的稳定性
由表4可知,突变株M4各世代琥珀酸产量基本稳定,可见经复合诱变后,菌株的基因发生了突变,有较好的遗传稳定性,该菌株可作为后续发酵优化及代谢调控研究的菌株。

表3 野生菌株mdrh-5及部分突变株的发酵结果Table 3 Fermentation results of A.succinogenes mdrh-5 and the mutants
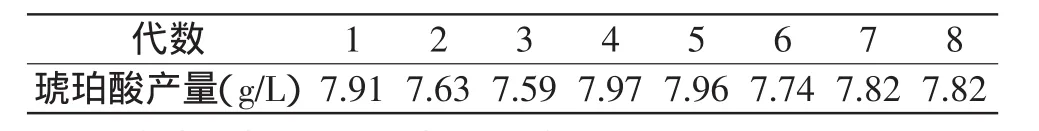
表4 突变株M4传代稳定性Table 4 Heredity stability of the mutant M4
3 结论
本研究通过紫外-NTG对A.succinogenes mdrh-5进行复合诱变处理,利用溴甲酚绿-氟乙酸平板初筛、发酵液CuSO4显色快速分析以及HPLC复检的高效筛选方法,迅速选育出一株有潜力的琥珀酸发酵突变菌。20g/L初糖浓度摇瓶发酵结果,琥珀酸产量为7.87g/L,比原始菌株提高了43%,副产物乙酸积累比野生菌株降低了66%。经过传代实验,该菌遗传性能稳定,可为后续发酵优化及代谢调控研究提供基础。
[1]Zeikus J,Jain M,Elankovan P.Biotechnology of succinic acid production and markets for derived industrial prducts[J]. Applied Microbiology and Biotechnology,1999,51(5):545-552.
[2]张洪勋,罗海峰,庄绪亮.琥珀酸发酵研究进展[J].微生物学通报,2003,30(5):102-106.
[3]李春丽,陈新志,赵新丽.丁二酸的制备及用途[J].青海大学学报:自然科学版,1999,17(6):21-25.
[4]Jang Y S,Jung Y R,Lee S Y,et al.Construction and characterization of shuttle vectors for succinic acid producing rumen bacteria[J].Applied and Environmental Microbiology,2007,73(17):5411-5420.
[5]Wang Qingzhao,Wu Chanyuan,Chen Tao,et al.Expression of galactose permease and pyruvate carboxylase in Escherichia coli ptsG mutant increases the growth rate and succinate yield under anaerobic conditions[J].Biotechnology Letters,2006,28(3):89-93.
[6]Henry Lin,George N Bennett,Ka-Yiu San.Metabolic engineering of aerobic succinate production systems in Escherichia coli to improve process productivity and achieve the maximum theoretical succinate yield[J].Metabolic Engineering,2005(7):116-127.
[7]徐敏,郑璞,倪晔,等.琥珀酸放线杆菌的耐高浓度钠离子菌株选育[J].工业微生物,2008,38(5):7-11.
[8]姜岷,陈可泉,蔡婷,等.超高静压在琥珀酸生产菌株选育中的应用[J].微生物学通报,2008,35(4):561-564.
[9]柴虹宇,张莉力,王玉田.苯乳酸高产菌株的诱变育种[J].食品工业科技,2010,31(8):154-156.
[10]朱彤波,杨蕴刘,焦瑞身.大肠杆菌抗氟乙酸变株的选育及应用[J].微生物学报,2000,40(1):100-104.
[11]H SocˇicˇV,Gaberc-Porekar.Micromethod for the quantitative determination of succinic acid in the fermentation media[J]. Applied Microbiology and Biotechnology,1980,9(1):53-58.
Mutation and screening for high yield Actinobacillus succinogenes
LIN Ri-hui1,HUANG Xin-lin1,HUANG Wen-qin2
(1.Key Laboratory of New Techniques for Chemical and Biological Conversion Process,College of Chemistry and Ecological Engineering,Guangxi University for Nationalities,Nanning 530006,China;2.Nanning YiDe Environment Technology Limited Cooperation,Nanning 530003,China)
The Actinobacillus succinogenes mdrh-5 was treated with ultraviolet and nitrosoguanidine.A mutant was isolated based on an efficient screening method combining color-changing circle,monofluoroacetate tolerance with CuSO4fast analysis.Compared with the wild type strain,the mutant’s succinic acid production increased 43%,together with 66%decrease of acetic acid production,and the mutant’s heritability was stable. Key words:succinic acid;fermentation;ultraviolet-nitrosoguanidine mutagenesis
TS201.3
A
1002-0306(2012)07-0161-04
琥珀酸(succinic acid),又称丁二酸,既是三羧酸循环(TCA)的中间产物,也是一些厌氧微生物代谢的发酵产物之一[1]。琥珀酸作为化工原材料,广泛使用于食品、医疗药品、清洁剂、生物可降解塑料、表面活性剂等应用领域[2]。目前琥珀酸的生产主要通过石蜡氧化法、反丁烯二酸加氢法、氯乙酸甲酯水解法等化学方法合成[3],但传统的化学合成法不但成本高,而且易造成环境污染等问题。利用微生物发酵生产琥珀酸具有成本较低、环境友好、原料可再生的优势;此外,发酵法生产琥珀酸是一种消耗和利用二氧化碳的工艺过程(理论上每发酵生产1t琥珀酸可固定0.37t CO2),这对于缓解大气中的温室效应有着积极的意义。目前,利用微生物发酵法生产琥珀酸逐渐成为生物化工领域的研究热点。随着微生物学、分子生物学的发展,利用代谢工程、基因工程等手段定向育种的方法也广泛应用于琥珀酸生产菌的选育[4-6],并取得良好的效果,但仍存在缺乏针对性的工具质粒、或突变株遗传稳定性差等问题,目前这些方法成功应用于生产的例子还很少。诱变育种操作简单,突变株遗传稳定性好,结合高效筛选方法,仍是一种有效的菌种选育手段[7-8]。研究以本实验室分离获得的琥珀酸放线杆菌(A.succinogenes mdrh-5)作为原始菌株,利用紫外及亚硝基胍(NTG)进行复合诱变处理,结合高效筛选及分析方法,获得1株琥珀酸高产突变株。
2011-06-20
林日辉(1972-),男,副教授,博士,主要从事发酵工程,酶工程方面的研究。
国家民委科研项目(10GX07);广西教育厅科研项目(201012MS072);广西民族大学重点项目科研基金(200701YJ01)。

