采后一氧化氮处理对油桃抗软腐病的诱导
李永才,陈松江,毕 阳,尹 燕,赵转霞
(甘肃农业大学食品科学与工程学院,甘肃兰州730070)
采后一氧化氮处理对油桃抗软腐病的诱导
李永才,陈松江,毕 阳,尹 燕,赵转霞
(甘肃农业大学食品科学与工程学院,甘肃兰州730070)
以油桃为实验对象,研究了采后NO供体硝普钠(SNP)处理对低温贮藏期间油桃根霉软腐病的控制效果及其机理。研究结果表明硝普钠处理能显著地抑制损伤接种Rhizopus stolonifer的油桃果实软腐病的扩展,其中较低浓度5mmol/L的硝普钠处理效果最好,其病斑直径仅为对照的75.83%。进一步研究表明SNP浸泡处理能显著地提高低温贮藏期间油桃果实组织苯丙氨酸解氨酶(PAL)和过氧化物酶(POD)的活性,且在贮藏后期对组织过氧化氢酶(CAT)和超氧化物歧化酶(SOD)酶活性具有抑制作用,然而对多酚氧化酶(PPO)的活性没有明显的诱导作用。可见一氧化氮是通过改变油桃抗性相关酶的活性来增强果实的抗病性。
硝普钠,油桃,抗性相关酶,软腐病,Rhizopus stolonifer
1 材料与方法
1.1 材料与仪器
供试油桃 兰州市园艺实验场,无病虫害,无机械伤的七八成熟油桃,纸箱包装后运抵实验室冷藏待用;供试匍枝根霉菌(Rhizopus stolonifer) 参照方中达[11]方法分离于自然发病的油桃果实,纯化鉴定后PDA上保存待用;NO供体硝普钠(SNP) 天津市光复精细化工研究所。
HH-4型恒温水浴锅 金坛市荣华仪器制造有限公司;超净工作台 苏净集团苏州安泰技术有限公司;高压灭菌锅 北京广顺科技发展有限公司;电热恒温培养箱 上海一恒科技有限公司;UV-2450型紫外-可见分光光度计 日本岛津。
1.2 实验方法
1.2.1 SNP处理对损伤接种油桃病斑直径的影响 参照刘志等[12]方法并改进,选择外观整齐、无病虫害的油桃洗净、晾干,75%酒精表面消毒后,用灭菌打孔器在果实表面等距离打深3mm,直径2mm的孔4个,然后将浓度为1、5和10mol/L的SNP 20μL注入孔内,以无菌水为对照。24h后接入1×106个/mL的R.stolonifer孢子悬浮液20μL,晾干后用聚乙烯袋包裹,然后在低温下(4℃)贮藏并观察发病情况,采用十字交叉法测量病斑直径并记录结果。每次处理果实用10个,重复三次。
1.2.2 酶液提取及酶活性测定
1.2.2.1 粗酶液的制备 取经SNP处理后0、4、8、12、16、20d的油桃果实,取果皮面下1mm处果肉组织样品3g,用锡箔纸分包后液氮冷冻,并保存在-85℃超低温冰箱中备用,每次处理果实用10个。参照曹建康等[13]方法取待测果肉组织3g于预冷的研钵中,加入4mL提取缓冲液,在冰浴条件下充分研磨成匀浆,在4℃,12000×g条件下离心15min,上清液为粗酶液。
1.2.2.2 酶活的测定 PAL活性测定参照曹建康等[13]方法,以每分钟反应体系在波长290nm处吸光度增加1所需的酶量为一个酶活单位,表示为U/mg鲜重;POD活性测定参照Lurie等[14]方法,以每分钟每毫克果肉组织吸光度增加1时为一个过氧化物酶活性单位,表示为△OD470/(min·mg)鲜重;PPO活性测定参照曹建康等[13]方法,制作OD420值随时间变化曲线,根据曲线的初始线性部分计算每分钟吸光度变化值△OD420,以每分钟每毫克果肉组织(鲜重)吸光度增加0.01时为一个酶活性单位,表示为是△OD420/(min·mg)鲜重;CAT活性测定参照Clairbone等[15]方法,以每分钟每毫克果肉组织(鲜重)吸光度减少0.01时为一个过氧化氢酶活性单位,表示为△OD240/(min·mg)鲜重;SOD活性测定参照 Prochazkova等[16]方法,以每分钟每克果肉组织的反应体系对氮蓝四挫光化还原的抑制为50%为一个SOD活性单位(U),表示为U/mg鲜重。
1.3 结果统计
数据处理采用Microsoft Excel 2003软件进行分析,并计算标准误差(±SE)。采用 SPSSStatistics 16.0软件进行显著性差异分析。
2 结果与分析
2.1 SNP处理对油桃抗软腐病病的诱导效果
由图1可见,SNP处理后24h接种R.stolonifer的油桃果实病斑直径均显著低于对照(p<0.05),其控制效果并未随着浓度增加而增强。其中5mmol/L SNP的控制效果最好,其病斑直径仅为对照的75.83%。
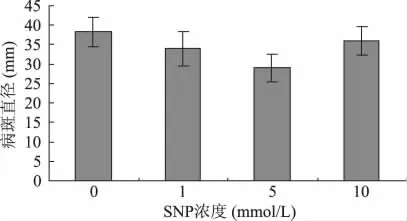
图1 SNP处理对油桃根霉病病斑直径的影响Fig.1 Effect of SNP treatment on leison diameter of Rhizopus rot in nectarine fruit
2.2 SNP处理对贮藏期间油桃组织PAL活性的影响
SNP处理的果实在整个贮藏期内组织PAL活性均高于对照,其变化趋势与对照一致,贮藏前期PAL活性呈上升趋势,在第12d达到最大值,然后迅速下降。而SNP处理的果实PAL活性16d后处于平衡状态(图2)。NO处理后12d和16d油桃组织PAL活性分别比同期对照高33.8%和59.94%。
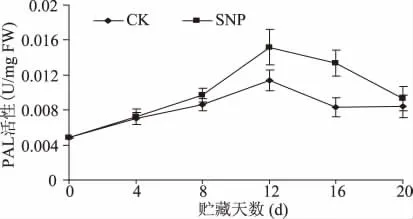
图2 SNP处理对油桃组织PAL活性的影响Fig.2 Effect of SNP treatment on PAL activity of nectarine fruit tissue
2.3 SNP处理对油桃组织POD活性的影响
SNP处理对贮藏期间油桃果实POD活性具有一定的影响(图3),在0~4d处理果实POD呈上升趋势,而后开始下降,贮藏8d后,处理果POD活性变化平稳。而对照果实POD活性在整个贮藏期内均高于对照,且其变化趋势不明显。可见SNP处理能有效的稳定果实组织的POD活性,其中在第16d其活性显著高于对照48.91%。
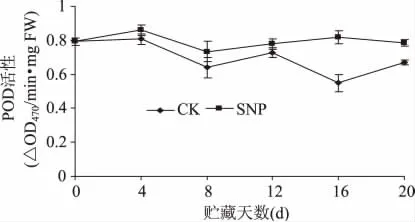
图3 SNP处理对油桃组织POD活性的影响Fig.3 Effect of SNP treatment on POD activity of nectarine fruit tissue
2.4 SNP处理对油桃组织PPO活性的影响
SNP处理对贮藏期间油桃果实PPO活性影响没有明显的规律(图4)。在贮藏初期(0~4d)处理和对照果实PPO活性均升高,第4d升至最大值,对照果实的峰值比处理果实高30.7%。随后即开始下降,与对照相比,处理果实PPO活性的下降速度较为缓慢。除第16d外,在整个贮藏期内处理果实的PPO酶活性始终低于对照,说明SNP处理对油桃组织PPO酶活性不具有诱导作用。
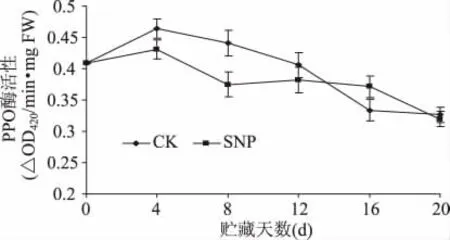
图4 SNP处理对油桃组织PPO活性的影响Fig.4 Effect of SNP treatment on PPO activity of nectarine fruit tissue
2.5 SNP处理对油桃组织CAT活性的影响
未处理的油桃果实组织CAT活性在整个贮藏期呈上升趋势(图5)。而NO处理果在贮藏前期也逐渐增加,第12d达到最大值,随后后开始下降。可见SNP处理在贮藏后期对油桃组织CAT活性具有明显的抑制作用,在第20d,NO处理果CAT活性仅为对照果的67%。
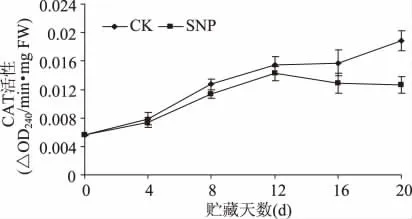
图5 SNP处理对油桃组织CAT活性的影响Fig.5 Effect of SNP treatment on CAT activity of nectarine fruit tissue
2.6 SNP处理对油桃组织SOD活性的影响
由图6可知,在贮藏前期(0~12d),对照和处理果实的SOD活性保持平稳,且两者之间也没有明显的差异。贮藏后期果实SOD活性总体呈下降趋势,但SNP处理果实SOD活性下降更为明显,第20d处理果实的SOD活性仅为对照的69%。可见SNP处理在贮藏后期可明显地抑制油桃组织SOD活性。
3 讨论
NO作为一种广泛存在于植物体内的信号分子,在植物的抗病反应中起到重要的作用[17]。本研究表明不同浓度的NO供体SNP处理能显著地抑制损伤接种Rhizopus stolonifer的油桃果实软腐病的扩展,这与McDoell等[18]和刘零怡等[10]的研究结果一致,他们认为NO在番茄等植物抵抗病原菌侵染方面起到了重要的作用。从SNP处理浓度比较我们可以看出,较低浓度处理(5mmol/L)能显著地抑制病斑的扩展,而高浓度SNP处理(10mmol/L)虽然也能起到一定的抑制作用,但效果不及1mmol/和5mmol/L SNP处理,这可能与NO在体内主要作为信号分子有关。
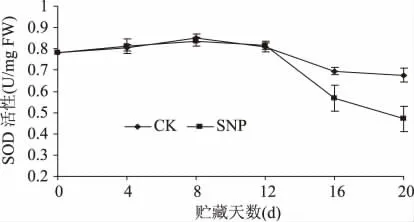
图6 SNP处理对油桃组织SOD活性的影响Fig.6 Effect of SNP treatment on SOD activity of nectarine fruit tissue
苯丙氨酸解氨酶(PAL)是许多植物次生物质生成合成途径-苯丙烷代谢的关键酶,与植物的抗逆境胁迫和抗病性密切相关,在植物的正常生长发育和抵御病原菌侵害过程中起着重要作用[19]。本实验结果表明,NO处理提高了油桃苯丙氨酸解氨酶(PAL)活性,加速了油桃组织内苯丙氨酸的裂解。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)是植物体主要的抗氧化酶系统,能有效地清除机体内的过多的活性氧,以保证机体正常的生理代谢。有研究表明,NO通过对CAT、SOD活性的影响来调节内源H2O2和·的含量[20-21]。本研究中的NO浸泡处理对贮藏后期油桃对组织CAT和SOD酶活性具有抑制作用。多酚氧化酶(PPO)是一种以铜为辅基的酶,能催化多种简单酚类物质氧化形成醌类化合物,醌类化合物进一步聚合形成呈褐色、棕色或黑色的聚合物。在后熟衰老过程或在采后的贮藏加工过程中,果蔬出现的组织褐变与组织中的多酚氧化酶活性密切相关[22]。NO处理后的油桃多酚氧化酶(PPO)活性除第16d外均低于对照,有效地延缓油桃组织的褐变。综上所述NO处理能通过调节抗病相关酶及活性氧代谢体系酶的活性而增强油桃果实的抗病性。但有关NO作为信号分子在诱导抗病性中的具体作用机理及其与其它信号分子如水杨酸、H2O2等之间的协作关系等均需进一步系统研究。
[1]朱惠琴.油桃主要病虫害防治措施[J].农业科技与信息,1999(11):17.
[2]杨振,郭红莲,张晓波,等.枯草芽孢杆菌BS-331防治油桃采后病害的研究[J].中国果树,2008(6):35-38.
[3]吴士云,孙力军,周声,等.植物内生多粘类芽孢菌对油桃采后青霉病抑制效果的研究[J].食品科学,2007(11): 579-583.
[4]吴振宇,王燕,艾启俊.鹿蹄草素对桃褐腐病菌的抑制作用及其抑菌机理[J].中国农业科学,2009(8):2784-2792.
[5]张海燕,饶景萍,戴斯琴,等.外源腐胺对油桃采后生理及与其相关酶活性的影响[J].植物生理学通讯,2007(6): 1061-1064.
[6]Neill S J,Desikan R,Clarke A,et al.Nitric oxide is a novel component of abscisic acid signaling in stomatal guard cells[J]. Plant Physiology,2002,128(1):13-16.
[7]李顺民,明建,曾凯芳.一氧化氮对果蔬成熟衰老和抗病性的影响[J].食品工业科技,2009(10):330-332.
[8]Durner J,Wendehenne D,Klessing D F.Defence gene induction in tobacco by nitric oxide,cyclic GMP,and cyclic ADP-ribose[J].Proceedings of the National Academy of Sciences USA,1998,95:10328-10333.
[9]Noritake T,Kawak ita K,Doke N.Nitric oxide induces phytoalexin accumulation in potato tuber tissues[J].Plant Cell Physiology,1996,37:113-116.
[10]刘零怡,于萌萌,郑杨,等.采后一氧化氮处理调控番茄果实茉莉酸类物质合成并提高灰霉病抗性[J].食品科学,2010 (22):457-461.
[11]方中达.植病研究方法[M].第三版.北京:中国农业出版社,1998.
[12]刘志,张华磊,谢兴斌,等.激发子物质处理富士苹果果实后抗轮纹病病菌侵染的研究[J].果树学报,2009,26(5): 666-670.
[13]曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007.
[14]Lurie S,Fallik E,Handros A,et al.The possible involvement of peroxidase in resistance to Botrytis cinerea in heat-treated tomato fruit[J].Physiological and Molecular Plant Pathology,1997 (50):141-149.
[15]Clairbone A.Catalase activity[M].Boca Raton:handbook of methods of oxygen radical research,1985.
[16]Prochazkova D,Sairam R K,Srivastava G C,et al.Oxidative stress and antioxidant activity as the basis of senescence in maize leaves[J].Plant Science,2001,161:765-771.
[17]Wendehenne D,Durner J,Klessig D F.Nitric oxide:A new player in plant signalling and defence responses[J].Current Opinion in Plant Biology,2004,7(4):449-455.
[18]Mcdowell J,Dangl J.Signal transduction in the plant immune response[J].Trends of Biochemitry Science,2000,25(2):79-82.[19]江昌俊,余有本.苯丙氨酸解氨酶的研究进展[J].安徽农业大学学报,2001,28:425-430.
[20]Wills R B H,Ku V V V,Leshem Y Y.Fumigation with nitric oxide to extend the postharvest life of strawberries[J].Postharvest Biology and Technology,2000(18):75-79.
[21]Floryszak-Wieczorek J,Milczarek G,Arasimowicz M,et al. Do nitric oxide donors mimic endogenous NO-related response in plants[J].Planta,2006,224:1363-1372.
[22]藤田修二,杨昌鹏,松藤加代子,等.香蕉多酚氧化酶在乙烯催熟期间的活性变化[C].2003年广西植物生理学年会论文汇编,2003.
Induced resistance to Rhizopus rot(Rhizopus stolonifer) in nectarine fruit by postharvest treatment with nitric oxide
LI Yong-cai,CHEN Song-jiang,BI Yang,YIN Yan,ZHAO Zhuan-xia
(College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China)
Control effect of sodium nitroprusside(SNP)treatment on Rhizopus rot of nectarine fruit during storage at low temperature and its mechanism were studied.The result showed that postharvest SNP treatment significantly inhibited the development of Rhizopus rot in nectarine fruit inoculated with Rhizopus stolonifer,relative lower concentration of SNP at 5 mmol/L had the best control effect,and its lesion diameter was only 75.83%of the control.Meanwhile activity of phenylalanine ammonia lyase(PAL),peroxidase(POD)in nectarine tissue were significantly increased during whole storage,catalase(CAT)and superoxide dismutase(SOD)were inhibited by SNP treatment during later storage,but SNP did not stimulate polyphenoloxidase(PPO)activity.These findings suggested that NO might enhance disease resistance of nectarine through changing resistant-related enzyme activities.
sodium nitroprusside;nectarine;resistant-related enzyme;Rhizopus rot;Rhizopus stolonifer
TS255.3
A
1002-0306(2012)10-0340-04
油桃因其果皮光滑无毛、色泽艳丽、风味浓甜且营养丰富,深受人民的喜爱。但油桃采收期集中,并正逢高温季节,致使油桃采后损失严重,贮藏期短。尤其由青绿霉病、黑斑病、软腐病等采后病害引起的腐烂严重影响油桃的货架期[1]。目前果蔬采后病害控制仍以使用化学杀菌剂为主,但化学杀菌剂长期使用会对环境和人类造成危害,同时病原物也会产生抗药性,因此寻求安全的采后病害控制新方法已势在必行。生物防治及低毒化学药物处理已在油桃采后病害控制中进行了研究[2-5]。一氧化氮(NO)作为一种存在于动物、植物和微生物体内的信号分子,能够调节植物的生长、发育,并参与植物体对各种生物和微生物胁迫反应的信息传递,尤其在植物抗病反应中起重要作用[6]。NO能有效地调控果蔬的成熟和衰老,包括抑制果蔬组织内乙烯的合成、减缓果蔬的呼吸速率、改善果蔬的色泽、硬度等品质特征[7]。同时许多研究表明,外源NO处理能够诱导番茄和马铃薯等果蔬系统产生抗病性[8-10]。但关于外源 NO诱导抗病性的机理及在油桃果实上的应用目前尚未见报道。因此本文以油桃为实验对象,研究NO供体硝普钠(SNP)处理对低温贮藏期间油桃软腐病的控制效果及其机理,以期为油桃采后病害的安全控制方法研究提供理论依据。
2011-07-25
李永才(1973-),男,博士,副教授,研究方向:果蔬采后贮藏保鲜与病害控制。
国家自然科学基金(30960243)。

