实现人源FGF-21高效可溶性表达的两种策略
李 娟, 刘 雯, 肖 磊, 劳 勋, 赵丽芬, 黄 静, 吴自荣
(华东师范大学 生命科学学院,上海 200062)
0 引 言
成纤维生长因子21(fibroblast growth factor 21,FGF-21)是FGF家族新成员,属于FGF19亚族,与FGF19同源性达35%,主要存在于哺乳动物的肝组织、骨骼肌组织以及胸腺组织中[1,2].FGF-21的重要生理功能包括调节脂肪组织对葡萄糖的摄取,调节机体血糖[3],提高胰腺β细胞的存活率,改善β细胞的功能[4],抵制肥胖,加速能量消耗[5],而且尚未发现产生低血糖、体重增加等[5]副作用,因此在2型糖尿病治疗中有良好的应用前景.
根据国外 Kharitonenkov[3]和国内姜媛媛[6]等人的文献报道,人源FGF-21在大肠杆菌中可溶性差,常以包涵体表达,为后续研究带来不便.分子伴侣能够帮助蛋白质正确折叠,提高蛋白的可溶性.沈继红等[7]使用4种分子伴侣蛋白实现低温脂肪酶Lip-837可溶性表达,Arayo Haga等[8]利用分子伴侣质粒pTf16表达了可溶性人源自分泌运动因子Autotaxin.本文采用引入分子伴侣Tig协助蛋白折叠的方法以期实现FGF-21高效可溶性表达.
在pET表达系统中,通常采用非代谢性乳糖类似物异丙基-β-D-巯基半乳糖苷(IPTG)作为诱导物进行诱导.IPTG虽能够诱导蛋白表达,但其本身对于细胞有一定的毒害作用,影响细菌的正常生长[9].20世纪80年代Coffey等[10,11]利用自诱导方法在人角化细胞中获得了大量TGF-α蛋白.美国布鲁克黑文国家实验室的Studier[12]和他的小组成员们不断地摸索探究,总结出自诱导培养基配方,并且在如Ding Y[13]高效表达TAP碱性磷酸酶、顾娟[9]表达的胰高血糖素样肽-1突变体(mGLP-1)等实验中得到证实.自诱导发酵的最终菌体密度大,蛋白产量高,但目前该系统的应用研究较少.本研究拟考察在大肠杆菌中自诱导表达FGF-21融合蛋白的可行性,以提高蛋白产量.
1 材料和方法
1.1 材料
1.1.1 菌种和质粒
大肠杆菌DH5α、BL21(DE3)和质粒pET32a(+)均为本实验室保藏.
质粒pDONR223-FGF-21购于上海英基生物科技有限公司.质粒pTf16由上海生物制品研究所提供.
1.1.2 主要试剂及仪器
工具酶,Takara公司;BCA蛋白质定量测定试剂盒,上海博彩生物科技有限公司;Mini-ProteinII型聚丙烯酰胺凝胶垂直电泳槽(Bio-rad公司);血糖测试仪,上海新立医疗器械有限公司.
1.1.3 乳糖自诱导培养基
胰蛋白胨1%,酵母提取物0.5%,NaCl 0.5%,甘油0.5%,葡萄糖0.05%,乳糖0.2%,Na2HPO450 mmol/L,KH2PO450 mmol/L,(NH4)2SO425 mmol/L,MgSO42 mmol/L.
1.1.4 实验动物
清洁级雄性健康C57BL/6小鼠购于上海斯莱克实验动物有限公司,许可证号:SCXK(沪)2007-0005.
1.2 方法
1.2.1 重组载体pET32a(+)-FGF-21的构建
利用Clone Manager生物软件,根据FGF-21 cDNA序列设计上游引物P1和下游引物P2.上下游引物的5′端分别引入酶切位点BglⅡ和EcoRⅠ.引物由上海英骏生物技术有限公司合成,序列如下:
P1 5′-GAAGATCTGGACGACGACGACAAGCACCCCATCCCTGAC-3′,BglⅡ;
P2 5′-ATGAATTCTCAGGAAGCGTAGCTGGGGCTTCGGCCCTGG-3′,EcoRⅠ.
以质粒pDONR223-FGF-21为模板,利用上述引物进行PCR反应.将PCR产物和质粒pET32a(+)用限制性内切酶BglⅡ/EcoRⅠ酶切,分别回收大片段进行连接,连接产物转化到大肠杆菌DH5α中.提取重组质粒,用BglⅡ/EcoRⅠ双酶切鉴定和菌落PCR鉴定,鉴定为阳性的克隆进行DNA测序.
1.2.2 FGF-21融合蛋白的自诱导表达及分离纯化
将含有分子伴侣Tig基因的质粒pTf16和测序正确的重组质粒pET32a(+)-FGF-21分别转化到大肠杆菌BL21(DE3)中.挑取转化后的单菌落接种于含有氨苄青霉素和氯霉素的LB液体培养基中,37℃、210 r/min培养12 h.将培养12 h的菌液按1%的比例转接入乳糖自诱导培养基中,27℃、210 r/min培养16 h,离心收集菌体.
取少量菌液进行菌密度检测,同时收集菌体进行超声破碎,分别收集上清和沉淀,进行SDSPAGE电泳.目的蛋白在上清中表明融合蛋白为可溶性表达,若在沉淀中表明其为包涵体.
剩余菌体重悬于IDA0(20 mmol/L Tris-HCl pH7.4,0.5 mol/L NaCl)中,超声破碎并收集上清.上清经镍离子亲和层析柱纯化,收集各洗脱组分,用SDS-PAGE检测融合蛋白所在组分,将对应洗脱液超滤浓缩并脱盐,得到融合蛋白.
1.2.3 凝胶成像分析
通过天能凝胶成像系统获得凝胶图谱,用软件ImageJ对凝胶图谱上的蛋白条带进行光密度扫描半定量分析,计算融合蛋白总表达量和可溶性融合蛋白的比例.融合蛋白总表达量通过计算融合蛋白TrxA-FGF-21占全菌总蛋白的百分比而得,可溶性融合蛋白的比例=上清中融合蛋白TrxA-FGF-21/(上清融合蛋白 TrxA-FGF-21+沉淀融合蛋白 TrxA-FGF-21)×100%.总可溶性蛋白相对产量=表达量(%)×可溶性(%)×菌体密度OD600.
1.2.4 FGF-21蛋白的纯化
肠激酶酶解TrxA-FGF-21融合蛋白,30℃裂解10~16 h,终止反应,再次进行镍离子亲和层析,收集含FGF-21的组分,用截留分子量为10 kD的Millipore Amicon Ultra-15超滤管将蛋白脱盐并浓缩,得到重组蛋白FGF-21.BCA法测定蛋白含量.
1.2.5 FGF-21的降血糖活性检测
雄性健康C57BL/6小鼠分为2组(n=6).A组为生理盐水对照组;B组为给药组.
连续注射7 d FGF-21,于第7天进行小鼠口服糖耐量(OGTT)实验.糖耐量实验是在小鼠禁食16 h后,于第7天早上测基础血糖,然后按0.5 mg/kg皮下注射FGF-21,对照组注射0.9%NaCl溶液.1 h后,对小鼠(4 g/kg)进行口服50%葡萄糖,此时计为0时刻,再分别于第15、30、45、60、75、90和105 min进行小鼠尾静脉取血,测定血糖浓度,以检测FGF-21的降血糖活性.
1.2.6 FGF-21对脂代谢的影响
雄性健康C57BL/6小鼠分为2组(n=6).A组为生理盐水对照组;B组为给药组.
连续注射28 d FGF-21,于第29天对小鼠眼球采血,血样4℃放置30~60 min后,4 000r/min离心10 min,取血清,委托德赛诊断系统(上海)有限公司测定血清中甘油三酯水平.
1.2.7 统计学分析
实验所得数据以平均数±标准差表示(X±SD),并用t检验统计组间差异,P<0.05为差异显著,P<0.01为差异极显著.
2 结果与分析
2.1 FGF-21表达载体的构建与序列分析
重组质粒pET32a(+)-FGF-21进行BglⅡ/EcoRⅠ双酶切和PCR鉴定,双酶切后大、小片段位置与理论值相符.PCR鉴定所得目的片段约578 bp,与FGF-21基因片段大小一致(见图1).将该阳性克隆委托上海博尚生物技术有限公司测序,测序结果正确.
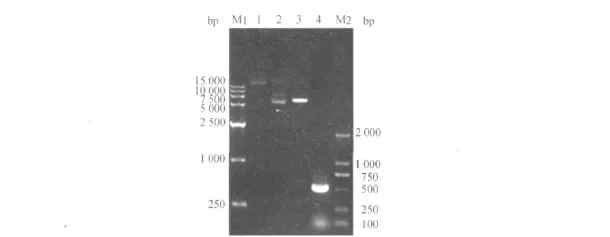
图1 重组质粒pET32a(+)-FGF-21的双酶切鉴定和PCR鉴定Fig.1 Identification of recombinant pET32a(+)-FGF-21 plasmid by BglⅡ/EcoRⅠdouble enzymy digestion and PCR
2.2 融合蛋白TrxA-FGF-21的诱导表达
基因工程菌株pET32a(+)-FGF-21/BL21(DE3)经0.1 mmol/L IPTG诱导,融合蛋白表达量为15.6%,可溶性仅为34.7%(见图2).0.1 mmol/L IPTG诱导16 h,OD600达到1.84,融合蛋白 TrxA-FGF-21表达量为17.5%,可溶性达到92.4%.在分子伴侣协同表达下,TrxA-FGF-21融合蛋白的可溶性大大提高(见图3).
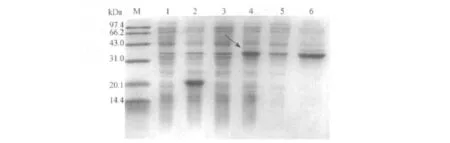
图2 pET32a(+)-FGF-21在BL21(DE3)的IPTG诱导表达Fig.2 Expression of pET32a(+)-FGF-21 in BL21(DE3)by IPTG induction
-
-
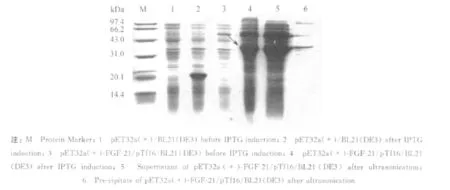
图3 pTf16和pET32a(+)-FGF-21在BL21(DE3)的IPTG诱导表达Fig.3 Expressions of pTf16 and pET32a(+)-FGF-21 in BL21(DE3)by IPTG induction
利用乳糖自诱导培养基诱导表达菌株pET32a(+)-FGF-21/pTf16/BL21(DE3),并对表达的蛋白进行可溶性鉴定(见图4).结果显示经乳糖自诱导培养基诱导培养16 h后,TrxA-FGF-21融合蛋白表达量占菌体总蛋白约17.4%左右,菌体OD600达到了12.4,且可溶性达到76.1%(见表1).
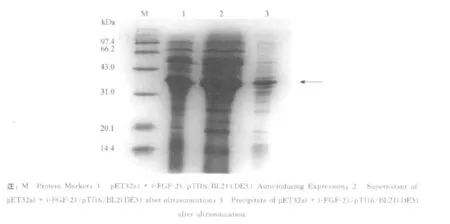
图4 pTf16和pET32a(+)-FGF-21在BL21(DE3)的乳糖自诱导表达Fig.4 Expressions of pTf16 and pET32a(+)-FGF-21 in BL21(DE3)by Lactose auto-induction
由表1可知采用乳糖自诱导策略,融合蛋白TrxA-FGF-21的可溶性虽只有76.1%,但菌体生物量达到12.4.因此,总的可溶性TrxA-FGF-21表达产量较IPTG诱导的高,按公式:相对产量=表达量(%)×可溶性(%)×菌体密度OD600,可知IPTG诱导的可溶性TrxA-FGF-21相对产量为0.30,乳糖自诱导的的可溶性TrxA-FGF-21相对产量为1.64,乳糖自诱导的可溶性TrxA-FGF-21产量是IPTG诱导的5.5倍.

表1 IPTG诱导与乳糖自诱导表达FGF-21融合蛋白的比较Tab.1 Comparison of expression TrxA-FGF-21 fusion protein by IPTG and Lactose auto-induction
2.3 融合蛋白TrxA-FGF-21的Western blotting鉴定
利用FGF-21单克隆抗体对表达的融合蛋白进行Western blotting分析,结果表明在全菌液和上清的泳道中约39 kD处有明显的识别条带,即为TrxA-FGF-21融合蛋白(见图5).
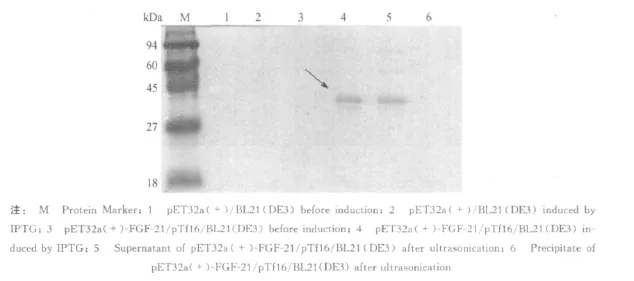
图5 TrxA-FGF-21融合蛋白 Western Blotting鉴定Fig.5 Identification of TrxA-FGF-21 fusion protein by Western Blotting
2.4 FGF-21的降血糖活性检测
纯化后FGF-21在C57BL/6小鼠体内进行降血糖活性测定.
FGF-21给药组在45、60和75 min,均能明显降低小鼠血糖,与对照组相比有显著差异(P<0.05)或极显著差异(P<0.01),糖耐量得到改善(见图6).说明本研究方法制备的重组FGF-21蛋白具有降低小鼠血糖的生物学活性.
2.5 FGF-21对脂代谢的影响
对小鼠连续28 d注射FGF-21后,取其血清测定甘油三酯水平,结果表明,给药组能明显降低小鼠甘油三酯水平,与对照组相比有极显著差异(P<0.01)(见图7).说明FGF-21参与了脂代谢的调节,可能通过提高脂肪组织中脂肪酶的表达,促进脂肪的分解和生酮作用的发生而降低甘油三酯.
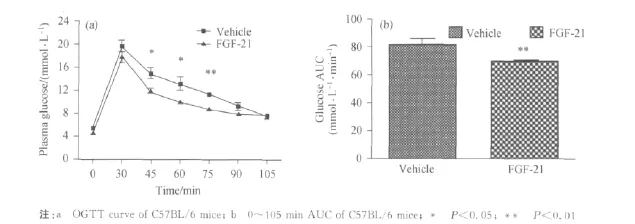
图6 FGF-21在C57BL/6小鼠体内活性测定Fig.6 Determination of activity on mice

图7 FGF-21对C57BL/6小鼠甘油三酯水平影响Fig.7 Effects of FGF-21Triglyceride levels on mice
3 讨 论
利用基因工程能够较快地制备重组蛋白,人源FGF-21在大肠杆菌中主要是以包涵体形式表达[3,6],难以获得高效稳定的可溶性蛋白.本文利用在线软件(http://www.biotech.ou.edu)对FGF-21在大肠杆菌中的可溶性进行了预测,预测结果显示,FGF-21在大肠杆菌中表达不可溶性达到86.2%.于是将FGF-21与硫氧还蛋白A(Thioredoxin A,TrxA)融合表达,通过TrxA提高FGF-21的可溶性.根据pET32a(+)的结构,将FGF-21基因序列连接在TrxA序列下游合适的位置,利用同样的在线软件对该融合蛋白可溶性进行预测,预测结果显示,加入TrxA后,融合蛋白的可溶性比之前提高,但不可溶性还是达到65.9%.实验结果也表明,融合蛋白主要以包涵体形式存在.
根据文献报道,分子伴侣能够介导蛋白质在生物体内进行正确折叠,获得正确的构型,增强其可溶性等[14].本研究共转化含有分子伴侣Tig基因的质粒pTf16和重组质粒pET32(+)a-FGF-21于大肠杆菌表达菌株BL21(DE3)中,该分子伴侣pTf16质粒的启动子为araB,可以阿拉伯糖作为诱导物诱导分子伴侣Tig的表达,同时带有氯霉素抗性基因作为筛选标记.结果显示,经阿拉伯糖诱导,分子伴侣Tig表达,并能协助FGF-21正确折叠,表达的FGF-21融合蛋白主要以可溶性形式存在,在IPTG诱导下,FGF-21融合蛋白的可溶性高达92.4%.由于分子伴侣本身是独立表达的,在对目的蛋白纯化的过程中,不需要采用额外的方法来去除分子伴侣蛋白,因此采用本策略在大肠杆菌中表达难溶性蛋白简便、快捷.
另外,在基因工程表达外源目的蛋白时,人们常选用pET系统的质粒,因其含有lacI表达元件,蛋白的表达需要用IPTG诱导,一定浓度的IPTG会对细菌产生毒性,直接影响目的蛋白的产量.因此,本研究的另一个策略采用乳糖自诱导的方式来提高目的蛋白的产量.在相同影响因素下,本文比较了乳糖自诱导和IPTG诱导的蛋白表达量及产量,发现目的蛋白表达量差异虽不大,但是乳糖自诱导所获得的菌体密度远高于IPTG诱导,约为IPTG诱导的6~7倍,因此,采用乳糖自诱导策略可通过提高生物量来获得更高产量的目的蛋白.
综上所述,分子伴侣协助蛋白表达的方法及乳糖自诱导的策略实现了人源FGF-21在大肠杆菌中的高效可溶性表达,且用此方法获得的重组FGF-21在小鼠体内表现生物学活性,这为基因工程表达难溶性蛋白以及新型治疗2型糖尿病药物FGF-21的研究奠定了一定的基础.
[1] NISHIMURA T,NAKATAKE Y,KONISHI M,et al.Identification of a nove FGF,FGF-21,preferentially expressed in the liver[J].Biochim Biophys Acta,2000,1492(1):203-206.
[2] IZUMIYA Y,BINA H A,OUCHI N,et al.FGF-21 is an Akt-regulated myokine[J].FEBS Lett,2008,582(17):3805-3810.
[3] KHARTONENKOV A,SHIYANOVA T L,KOESTER A,et al.FGF-21 as a novel metabolic regulator[J].J Clin Invest,2005,115(6):1627-1635.
[4] WENTE W,EFANOV A M,BRENNER M,et al.Fibroblast growth factor-21 improves pancreatic beta-cell function and survival by activation of extracellular signal-regulated kinase 1/2 and Akt signaling pathways[J].Diabetes,2006,55(9):2470-2478.
[5] COSKUN T,BINA H A,SCHNEIDER M A,et al.Fibroblast growth factor 21 corrects obesity in mice[J].Endocrinology,2008,149(12):6018-6027.
[6] 姜媛媛,尹成凯,李晋南,等.SUMO融合系统高效表达可溶性重组蛋白的研究[J].东北农业大学学报,2008,39(10):57-62.
[7] 崔硕硕,林学政,沈继红.分子伴侣共表达对低温脂肪酶Lip-837异源可溶性表达的影响[J].海洋科学进展,2011,29(1):105-111.
[8] ARAYO H,KAZUNORI H,NOBUTADA T,et al.Scalable purification and characterization of the extracellular domain of human autotaxin from prokaryotic cells[J].Protein Expression and Purification,2008,59(1):9-17.
[9] 顾娟,劳勋,金明飞,等.人胰高血糖素样肽-1突变体融合蛋白在大肠杆菌中的自诱导表达优化[J].微生物学通报,2010,37(5):726-731.
[10] 冯杉.T7表达系统及自诱导蛋白产出策略[J].北京教育学院学报:自然科学版,2009,4(3):10-15.
[11] COFFEY R J Jr,DERYNCK R,WILCOX J N,et al.Production and auto-induction of transforming growth factor-alpha in human keratinocyte[J].Nature,1987,328(6133):817-820.
[12] STUDIER F W.Protein production by auto-induction in high density shaking cultures[J].Protein Expr Purif,2005,41(1):207-234.
[13] LU Z S,CHEN W T,DING Y,et al.A novel method for high-level production of psychrophilic TAB5 alkaline phosphatase[J].Protein Expression and Purification,2010,74(2):217-222.
[14] 刘爽,胡宝成.原核系统可溶性表达策略[J].生物技术通讯,2005(2):172-175.

