REGγ,p53,NOTCH1 和BRAF 在甲状腺癌中的表达及其临床意义
亓 龙, 左 娣, 王 辉, 李晓涛
(1.上海交通大学医学院附属新华医院 核医学科,上海 200092;2.华东师范大学 生命医学研究所,上海 200241)
0 引 言
REGgamma(即REGγ,或PSME3,或11Sγ,或PA28γ)是蛋白酶体调节因子,有研究表明REGγ在未分化甲状腺癌中高表达[1],而p53,BRAF的突变并高表达和甲状腺癌远处转移是预后不佳的主要表现[2,3].NOTCH1是NOTCH 信号通路中NOTCH 家族的4个主要蛋白之一,其与肿瘤细胞的增殖、侵袭及转移有密切的关系[4].近年来在分化型乳头状甲状腺癌(PTC)中检测出BRAF 基因突变,且逐渐成为研究热点[5].目前REGγ,p53,NOTCH1和BRAF之间的相关性报道尚未发现.本文通过对2009年1月至2011年7月间的40例乳头状甲状腺癌患者的临床资料和术后病理,结合REGγ,p53,NOTCH1和BRAF表达的研究,分析它们之间的相关性及其临床意义.
1 材料和方法
1.1 一般资料 乳头状甲状腺癌及乳头状甲状腺癌伴淋巴结转移患者40例,患者均采用甲状腺叶全切除+峡部切除+部分淋巴结切除术并经病理明确诊断,无其他原发性恶性肿瘤,术前未经放疗及化学药物治疗,且知情同意.
1.2 主要试剂 18S,REGγ,p53,NOTCH1和BRAF引物均由invitrogen公司合成,兔抗人REGγ多克隆抗体(Invitrogen公司)、鼠抗人p53、BRAF单克隆抗体及山羊抗人NOTCH1单克隆抗体和鼠抗兔、兔抗鼠及兔抗山羊二抗(Santa Cruz公司),妙通免疫组化试剂盒(上海妙通生物公司)均由华东师范大学生命医学研究所李晓涛教授实验室惠赠.
1.3 Realtime-PCR 总RNA的提取与逆转录Realtime-PCR分别对甲状腺癌组织按照Trizol(TaKaRa公司)说明书提取组织总RNA.分别取3μg总RNA用RevertAidTM逆转录试剂盒(Invitrogen公司)进行逆转录.用Sybgreen试剂盒(Toyobo公司)和Realtime—PCR仪(Agilent Technologies公司)进行扩增.引物序列如表1所示.扩增程序:95℃,5min;95℃,5s;58 ℃,30s;72 ℃,25s,共40循环.均进行溶解曲线分析.采用相对定量法进行数据处理:


表1 引物序列
1.4 组织切片及免疫组织化学检测 标本经4%多聚甲醛固定、石蜡包埋切片;免疫组织化学采用链霉素抗生物素蛋白—过氧化物酶连结法即SP法,一抗分别为REGγ(稀释度为1∶300),p53(稀释度为1∶100),NOTCH1(稀释度为1∶300)和BRAF(稀释度为1∶400)单克隆抗体,DAB显色,苏木精复染,脱水、透明、封片.每批染色均设阳性及阴性对照片,以排除假阳性及假阴性.
1.5 结果判断 阳性表达结果呈棕黄色或棕褐色.一般按阳性细胞数[无(-),偶见、通常<5%(+/-),5%~25%(+),26%~50%(++),>50%(+++)]和染色深浅[浅(+),中(++),深(+++)]进行综合评分[6].NOTCH1,p53,BRAF和REGγ阳性细胞多数为核着色,呈棕黄色颗粒,少数为较弱的细胞质染色.
1.6 统计学方法 采用SPSS 11.0for window统计软件包进行数据处理,采用χ2检验及Spearman相关性分析.P<0.05为差异有统计学意义.
2 结 果
2.1 Realtime-PCR检测REGγ,p53,NOTCH1 及BRAF mRNA表达
通过Realtime-PCR检测6例乳头状甲状腺癌组织发现,与正常甲状腺组织相比,甲状腺癌组织中REGγmRNA水平呈上升趋势,BRAFmRNA水平呈下降趋势,NOTCH1及p53 mRNA水平变化无统计学意义(见图1).
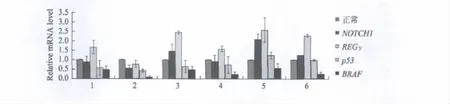
图1. NOTCH1,p53,BRAF,REGγmRNA在甲状腺癌中的表达Fig.1 The relative mRNA level of NOTCH1,p53,REGγand BRAFin thyroid cancer
2.2 REGγ、p53、NOTCH1和BRAF在甲状腺癌中的表达
40例乳头状甲状腺癌组织中,有35例REGγ染色呈阳性,阳性率为87.5%;同时检测出p53,BRAF 和NOTCH1 阳性表达率分别为47.5%(19/40)、25.0%(10/40)、20.0%(8/40),(见图2).由此可见,REGγ蛋白在甲状腺癌组织中阳性表达率最高,BRAF 和NOTCH1阳性表达率相对较低(见表2).
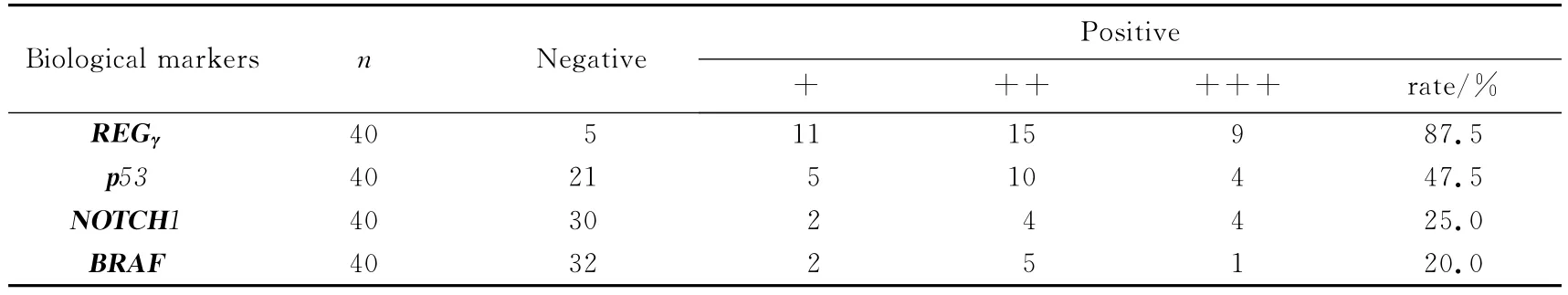
表2 REGγ,p53,NOTCH1和BRAF在甲状腺癌组织中的表达Tab.2 Expressions of REGγ,p53,NOTCH1 and BRAFin thyroid cancer
2.3 REGγ、p53、BRAF和NOTCH1的表达与甲状腺癌临床病例因素的关系
REGγ表达与甲状腺癌患者年龄、淋巴结转移有关,伴淋巴结转移的45岁以上患者REGγ阳性越明显(P=0.0151<0.05,见图3);而与患者性别无显著相关性(P=0.742>0.05);p53,BRAF和NOTCH1的表达与淋巴结转移状况呈正相关(P=0.0253<0.05).(见表3)
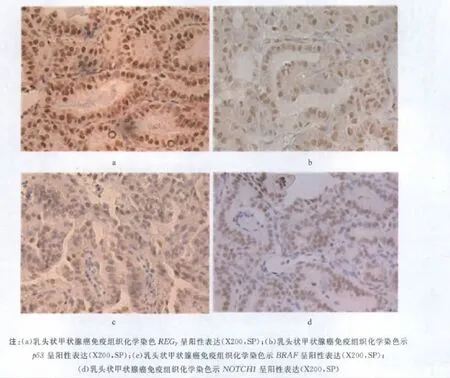
图2 REGγ,p53,NOTCH1和BRAF在甲状腺癌中的表达Fig.2 The expression of REGγ,p53,NOTCH1 and BRAFin thyroid cancer
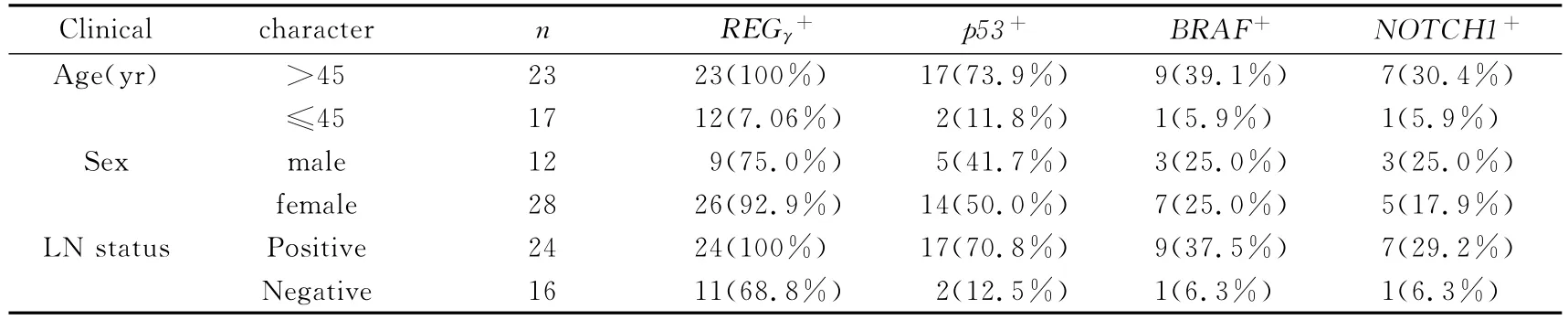
表3 REGγ,p53,BRAF和NOTCH1阳性表达与甲状腺癌临床病理因素的关系Tab.3 Relationship between prevalence of REGγ,p53,BRAF and NOTCH1 and various clinicopathological features(n,%)
2.4 REGγ与NOTCH1,p53,BRAF的关系
REGγ阳性表达与NOTCH1,p53,BRAF 表达呈正相关(P<0.05)(见表4).经Spearman相关性分析,p53阳性表达患者,NOTCH1(r=0.021 1,<0.05)和BRAF(r=0.023 3,<0.05)均高表达;NOTCH1阳性表达与BRAF(r=0.243,>0.01)无显著性相关(见表4).

图3 REGγ的表达与临床病理因素的相关性Fig.3 The relevance of clinical pathological factors and expression of REGγ
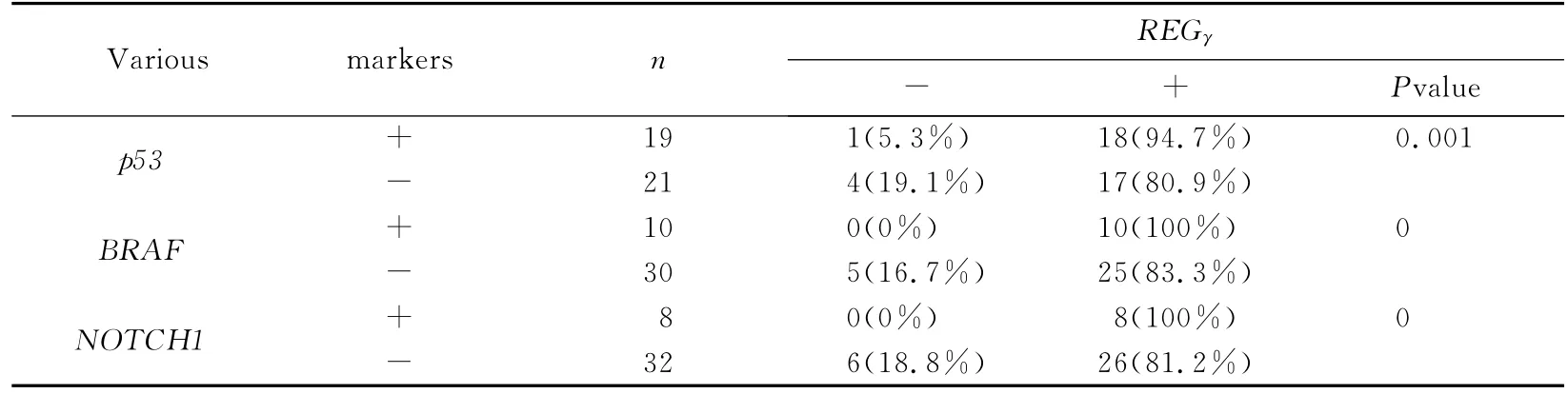
表4 REGγ阳性表达与NOTCH1,p53,BRAF的关系Tab.4 Relationship between the expressions of REGγand NOTCH1,p53,BRAF
3 讨 论
REGγ,亦称PA28γ,11Sγ或PSME3,在系统性红斑狼疮的患者血清中首次被发现,是一种自身免疫性抗体的核内靶蛋白[7,8].REGγ属于11S蛋白酶激活因子家族或REG家族.REGγ在大肠癌[9]和甲状腺癌[10]中存在差异表达,并在癌症发展过程中发挥作用[9-11].REGγ表达的高低对评价细胞的增殖状态、研究肿瘤的生物学行为、判断其预后具有重要科研和临床意义.
本研究显示REGγ表达与年龄、淋巴结转移呈正相关,随着年龄增长,REGγ阳性率增高,且两个年龄段REGγ阳性率差异有统计学意义(P<0.05);伴有淋巴结转移的患者其REGγ阳性率也增高,且REGγ阳性率差异有统计学意义(P<0.05).这说明REGγ表达与肿瘤生长和转移密切相关.关于REGγ表达与乳头状甲状腺癌远处转移的相关性研究,国内外尚鲜见报道,故此结果未能参照比较.
p53基因是重要的细胞凋亡调控基因,位于17号染色体,编码一个由393个氨基酸组成的核磷蛋白,在许多组织中均有表达.p53存在野生型和突变型两种亚型,免疫组织化学所检测的主要为突变型,突变型p53基因可引起细胞的转化和癌变,导致细胞无限增生.研究表明[12],大约50%的人类肿瘤都有p53基因突变.最近有实验表明,REGγ可以通过促进MDM2介导的p53蛋白泛素化途径而使p53水平降低,但对突变型p53作用则相反[13].本研究显示在甲状腺癌中p53蛋白的阳性率为47.5%,且与REGγ表达呈正相关,说明p53基因在部分甲状腺癌中存在明显突变,两者在肿瘤的生长、侵袭过程中有协同和相互调节作用.
BRAF基因位于7号染色体,编码B型有丝分裂原激活的蛋白激酶依赖性激酶的激酶(B-Raf kinase,BRAF),它是RAS/RAF/MEK/ERK 信号通路(即 MAPK 通路)的关键成分,此信号通路能调节细胞的增殖、分化和凋亡等[14],当其发生突变时,该通路将持续激活,使细胞异常增殖、分化最终导致肿瘤的发生[15].本研究显示在甲状腺癌中BRAF蛋白的阳性率为25.0%(10/40),且与REGγ表达呈正相关,说明BRAF基因在部分甲状腺癌中可能存在突变,两者在肿瘤的生长、侵袭过程中可能存在协同和相互调节作用.
NOTCH是一种在进化上十分保守的跨膜受体蛋白家族.哺乳动物中有4个受体,分别为NOTCH1—NOTCH4.有研究显示,NOTCH1高表达可引起人类乳腺癌的低分化和低生存率[16],显示出NOTCH 基因的原癌基因作用.但也有不同的报道,在瞬时转染NOTCH的SMMC-ICD7721细胞中,NOTCH通过作用于细胞内的多条信号转导通路而抑制肝癌细胞的增殖和促进凋亡[17],显示出抑癌基因的所用.这些结果提示,同一种NOTCH受体在不同的组织类型中作用不同.本研究显示在甲状腺癌中NOTCH1蛋白的阳性率为20.0%(8/40),且与REGγ表达呈正相关,提示NOTCH 基因的表达在部分甲状腺癌中存在异常,两者在肿瘤的生长、侵袭过程中可能存在协同和相互调节作用.
综上所述,甲状腺癌组织中REGγ的表达与p53、BRAF和NOTCH1的表达呈正相关,其与患者年龄、淋巴结转移状况呈正相关,推测REGγ可能是甲状腺癌中p53、BRAF、NOTCH信号通路异常的共同关键因子,但具体机制尚在进一步研究中.同时REGγ最初是在系统性红斑狼疮患者的血清中被发现的,故有望应用于甲状腺癌患者的血清中,结合本研究的临床价值,从而减少了不必要的医疗资源的浪费,也为个体化诊断与治疗提供理论依据.
[1] OKAMURA T,TANIGUCHI S,OHKURA T,et al.Abnormally high expression of proteasome activator-gamma in thyroid neoplasm[J].J Clin Endocrinol Metab,2003,88(3):1374-1383.
[2] RODERICK M,HELEN G,PAOLO G,et al.Evidence that one subset of anaplastic thyroid carcinomas are derived from papillary carcinomas due to BRAF and p53 mutations[J].CANCER,2005,103(11):2261-2268.
[3] KIMURA E T,NIKIFOROVA M N,ZHU Z,et al.High prevalence of BRAFmutations in thyroid cancer genetic evidence for constitutive activation of the RET/PTC-RAS-BRAF signaling pathway in papillary thyroid carcinoma[J].CANCER RESEARCH,2003,63:1454-1457.
[4] PRATHIBHA R,WEAVER K L,CAPOBIANCO A J.Notch signalling in solid tumours:a little bit of everything but not all the time[J].Nature,2011(11):338-351.
[5] NIKIFOROVA M N,KIMURA E T,GANDHI M,et al.BRAF mutations in thyroid tumors are restricted to papillary carcinomas and anaplastic or poorly differentiated carcinomas arising from papillary carcinomas[J].J Clin Endocrinol Metab,2003,88(11):5399-5540.
[6] 沈铭昌.免疫组化在病理学中的应用进展与评价[J].实用肿瘤杂志,2002,17(5):293-294.
[7] MAO I,LIU J,LI X,et al.REGgamma,aproteasome activator and beyond[J].Cell Mol Life Sci,2008,65(24):3971-80.
[8] NIKAIDO T,SHIMADA K,SHIBATA M,et al.Cloning and nucleotide sequence of cDNA for Ki antigen,a highly conserved nuclear protein detected with sera from patients with systemic lupus erythematosus[J].Clin Exp Immunol,1990,79(2):209-214.
[9] ROESSLER M,ROLLINGER W,MANTOVANI-ENDL L,et,al.Identification of PSME3as a novel serum tumor marker for colorectal cancer by combining two-dimensional polyacrylamide gel electrophoresis with a strictly mass spectrometry-based approach for data analysis[J].Mol Cell Proteomics,2006,5(11):2092-2101.
[10] OKAMURA T,TANIGUCHI S,OHKURA T,et al.Abnormally high expression of proteasome activator-gamma in thyroid neoplasm[J].J Clin Endocrinol Metab,2003,88(3):1374-1383.
[11] SALVATORE G,NAPPI TC,SALERNO P,et al.A cell proliferation and chromosomal instability signature in anaplastic thyroid carcinoma[J].Cancer Res,2007,67(21):10148-10158.
[12] DAVIDOFFf A M,HEMDON J E,GLOVER N S,et al.Relation between p53 overexpression and established prognostic factors in breast cancer[J].Surgery,1991,110(2):259-264.
[13] ZHANG Z,ZHANG R.Proteasome activator PA28gamma regulates p53 by enhancing its MDM2-mediated degradation[J].EMBO J,2008,27(6):852-64.
[14] PEYSSONNAUX C,EYCHENE A.The RAF/MEK/ERKpathway:new concepts of activation[J].Biol Cell,2001,93:53-62.
[15] DUESBERY N S,WEBB C P,VANDE W G F.MEK wars,a new front in the battle against cancer[J].Nat Med,1999(5):736-742.
[16] PARR C,WATKINS G,JIANG W G.The possible correlation of Notch-1and Notch-2with clinical outcome and tumer clinicopathological parameters in human breast cancer[J].Int J Med,2004,14(5):779-786.
[17] QI R,AN H,YU Y,et al.NOTCH1 signaling inhibits growth of human hepatocellular crcinoma through induction of cell cycle arrest and apoptosis[J].Cancer Res,2003,63:8323-8329.

