草鱼肽的体外生理功能
林利美,陈季旺,吴永宁,宫智勇,*
(1.武汉工业学院食品科学与工程学院,湖北 武汉 430023;2.国家食品安全风险评估中心,北京 100021)
草鱼肽的体外生理功能
林利美1,陈季旺1,吴永宁2,宫智勇1,*
(1.武汉工业学院食品科学与工程学院,湖北 武汉 430023;2.国家食品安全风险评估中心,北京 100021)
以草鱼为原料制取生理活性肽,采用高效液相色谱法(HPLC)测定其对血管紧张素转化酶(ACE)的抑制活性,采用DPPH自由基清除法、氧自由基清除能力(ORAC) 法研究其抗氧化性。结果表明:草鱼肽抑制ACE活性IC50为0.229mg/mL,清除DPPH自由基的IC50为7.630mg/mL,ORAC值为1317.962μmol Trolox/g,采用草鱼制备有效的生理活性肽是可行的。
草鱼肽;ACE抑制活性;DPPH自由基;ORAC
生物活性肽是指能够调节生物机体的生命活动或有特殊生理作用的肽类,具有涉及神经、激素和免疫调节、抗高血压、抗胆固醇、抗氧化、改善氮素吸收关系和矿质运输、调节食品风味、硬度等多重功效[1-2],因而在功能食品中具有重要的作用。
近年来,通过酶解鱼类蛋白制取活性肽已经成为国内外研究的热点。草鱼是我国产量最高的淡水鱼。但因其肉质水分含量高、鱼体内组织酶活跃、易腐败、固有的土腥味等,受到我国现有的贮藏以及加工条件的限制,每年造成的腐败损失率在30%以上,加工率不到10%[3]。因此,以淡水鱼作为原料制取活性肽对我国渔业的深加工具有重要的意义。本实验研究草鱼肽体外对血管紧张素转化酶的抑制作用,并用两种方法评价其抗氧化性,为草鱼肽保健食品的开发提供科学的理论依据。
1 材料与方法
1.1 材料与试剂
草鱼 市售。
血管紧张素转化酶(ACE)、马尿酰-组氨酰-亮氨酸(HHL)、马尿酸(Hip)、荧光素(FL)、水溶性VE(Trolox)、2,2,-偶氮二(2-脒基丙烷)二盐酸盐(AAPH)、1,1-二苯基-2-三硝基苯肼(DPPH) 美国Sigma公司;其他试剂均为分析纯。
1.2 仪器与设备
1525-2998 高效液相色谱仪 美国Waters 公司;SpectraMaxM2e 荧光酶标仪 美国分子仪器公司;7200可见分光光度计 尤尼柯(上海)仪器有限公司;LG-3型冷冻干燥机 宁波市生化仪器厂。
1.3 方法
1.3.1 草鱼肽的制备
参照文献[4],具体工艺流程为:草鱼清洗干净后去头、去内脏、去骨,绞碎成匀浆,配成溶液,并调p H9后,选择碱性蛋白酶进行酶解,酶解条件为pH9、温度50℃、酶与底物比48AU/kg,水解度在34.52%左右时95℃灭酶活 15min,10000r/min 离心20min,取上清液进行真空浓缩、冷冻干燥,得到粗制品,再进行超滤、脱盐,即为鱼活性肽。测得其分子质量<3000D、肽含量80.12%、灰分含量3.58%。
1.3.2 ACE抑制活性的测定[5-7]
采用高效液相色谱法测定草鱼活性肽对ACE的抑制活性。在一定条件下,HHL经ACE的作用生成马尿酸和组氨酰亮氨酸,马尿酸在228nm波长处有最大吸收,因此可以通过马尿酸的生成量来反应ACE的活力的大小。将HHL溶解在0.05mol/L含0.3mol/L氯化钠的硼酸盐缓冲液(pH8.3)中,配制成浓度为2.5mmol/L的HHL溶液,依次加入30μL的HHL、10μL草鱼肽,37℃恒温水浴5min,然后加入20μL ACE,恒温反应1h后加入70μLHCl终止反应,得到供试液。
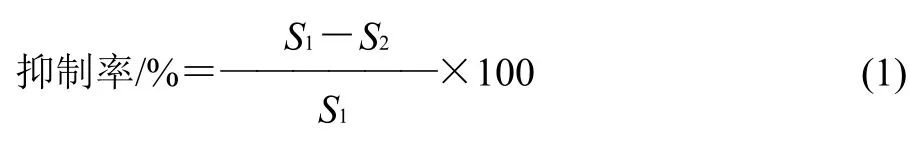
式中:S1为对照马尿酸峰面积;S2为样品马尿酸峰面积。
色谱条件:色谱柱:ODS C18分析型色谱柱(4.6mm×1 5 0 m m,5μm);二极管阵列检测器,检测波长:228nm;流速:0.8mL/min;流动相A:水(含0.05%TFA);流动相B:乙腈(含0.05% TFA);进样量:20μL;柱温:25℃;梯度洗脱条件:10%~60%B(15min);60%~10%B(3min)。
1.3.3 草鱼肽抗氧化能力的测定
1.3.3.1 DPPH自由基清除率的测定[8]
DPPH自由基清除率的测定是利用DPPH溶液的特征紫红色团的吸收峰,以分光光度法测定加抗氧化剂或植物提取液后吸光度的下降,以此表示对DPPH自由基的清除能力[9]。用双蒸水配制一系列浓度梯度的样品溶液,以无水乙醇溶解DPPH配成浓度为0.1mmol/L。取样品溶液2mL与2mLDPPH混合均匀,室温条件下放置30min后测其517nm波长处吸光度。每个样品进行3个平行实验。

式中:Ai为DPPH溶液与肽液的吸光度;Aj为肽液与无水乙醇的吸光度;A0为DPPH溶液与无水乙醇的吸光度。
1.3.3.2 氧自由基清除能力的测定
草鱼肽氧自由基清除能力(oxygen radical absorbance capacity,ORAC)的测定参照Wolfe等[10]的方法,向96孔板各孔分别加入20μL不同浓度的Trolox标准品溶液或按一定比例稀释的肽液,稀释标准品或溶解样品等均以75mmol/L磷酸钾缓冲液(pH 7.4)为工作液,空白孔直接加入20μL缓冲液,再向每孔中加入 200μL 0.96μmol/L的FL,37℃孵育20min后,用多道移液器迅速向各孔加入20μL新鲜配制的119mmol/L AAPH溶液。立即启动多功能荧光酶标仪,在3 7℃条件下以激发波长485nm,发射波长538nm连续测定各孔的荧光强度监测荧光衰退情况,每4.5min重复测定1次,测试直至荧光强度曲线衰减到基线为止,荧光强度值分别记为f0、f1、f2、f3…fn。将提取液自由基作用下荧光衰退曲线的延缓面积(Net AUC)代入6.25、12.5、25、50μmol/L标准抗氧化物质 Trolox的Net AUC,与Trolox浓度所做标准曲线。得到草鱼肽的ORAC值,以每克肽中有μmol Trolox当量/g肽表示(μmol Trolox/g)[11]。其中AUC=1+f1/f0+f2/f0+f3/f0+…+fn/f0。
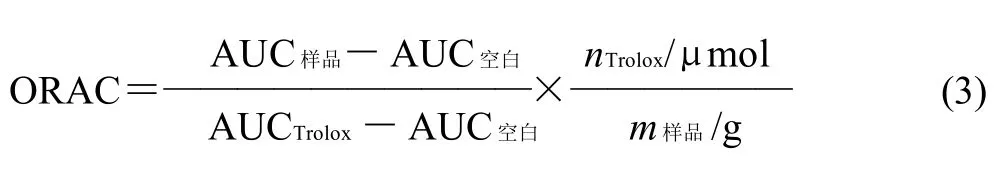
1.4 数据处理
数据采用SPSS17.0统计分析软件进行处理。
2 结果与分析
2.1 不同质量浓度草鱼肽对ACE的抑制活性
ACE可以通过水解作用把血管紧张素Ⅰ转化为血管紧张素Ⅱ,同时,还可以钝化血管激肽,这两种作用均可导致血管收缩,引起高血压[12]。研究发现,活性肽可以通过抑制ACE的活性而达到降压的目的。草鱼肽对ACE的抑制率见图1,回归分析得线性方程:y=48.596x3-153.44x2+159.07x+18.079(R2=0.9977),规划求解其IC50为0.229mg/mL。
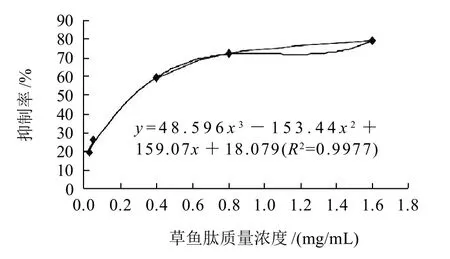
图1 不同质量浓度草鱼肽对ACE的抑制率Fig.1 ACE inhibitory activity of grass carp peptides at different concentrations
2.2 草鱼肽对DPPH自由基的清除作用
图2 为草鱼肽对DPPH自由基清除率的测定结果,回归分析得线性方程,y=-0.007x3+0.0703x2+5.6885x+5.6108(R2=0.9951),求解得草鱼肽对DPPH自由基清除率的IC50为7.630mg/mL。
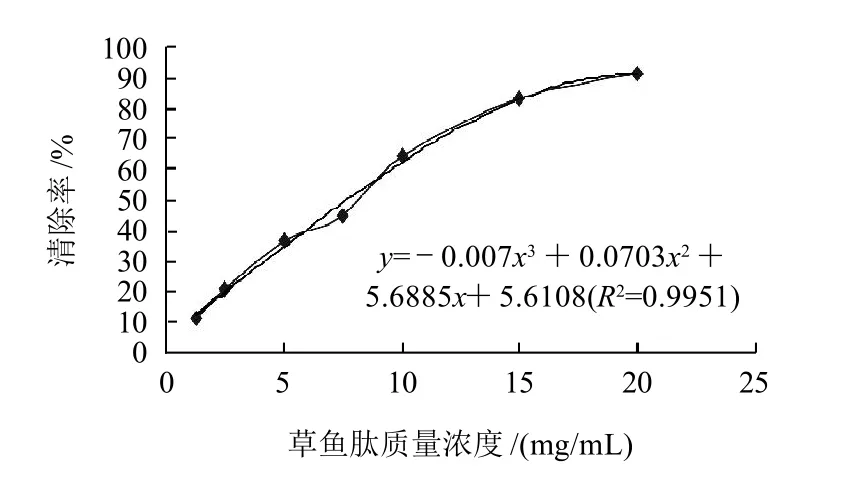
图2 不同质量浓度草鱼肽对DPPH自由基的抑制率Fig.2 DPPH free radicals scavenging capacity of grass carp peptides at different concentrations
2.3 草鱼肽对氧自由基的清除能力
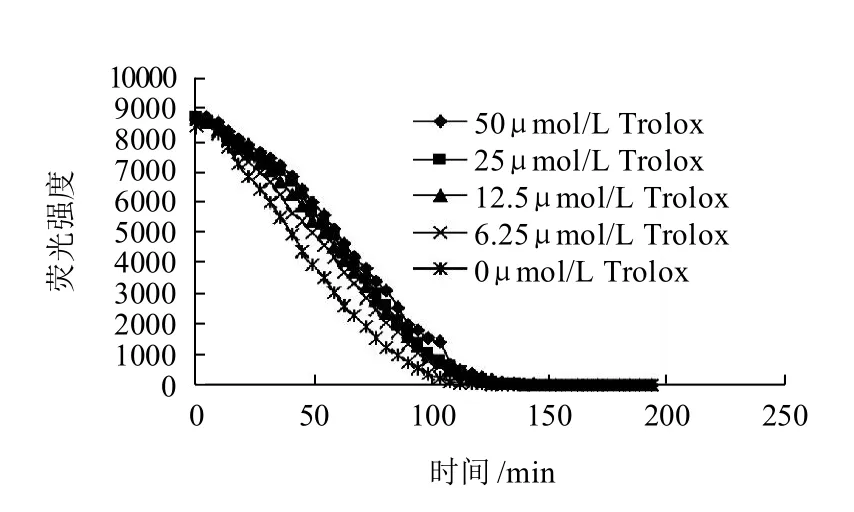
图3 Trolox的荧光衰减曲线Fig.3 FL fluorescence decay curves in the presence of different concentrations of trolox
草鱼肽氧自由基清除能力的ORAC值以Trolox当量表示,Trolox的荧光衰减曲线如图3所示。以Trolox的浓度为横坐标,不同浓度下的Net AUC值为纵坐标作图,对分散点进行线性拟合,即可得到Trolox的Net AUC与浓度的标准曲线:y=0.041x+2.0176(R2=0.9902),可知Trolox的Net AUC与其浓度具有良好的线性关系,根据公式可求得草鱼肽的ORAC值为1317.962μmolTrolox/g。
3 讨 论
近年来,随着生命科学研究的不断进展,氧化应激损伤及抗氧化保护理论倍受关注,而高血压等心脑血管疾病也被公认为与氧化应激损伤及自由基代谢失调有关[13]。因而筛选具有抗氧化及降压作用的天然资源已成为生命科学研究的新趋势。其中,活性肽就是重要的一类。ACE在血压调节中起着关键作用,其抑制活性的大小常用指标为百分比抑制率和半抑制浓度IC50,前者测定起来简单快捷,但缺点是不能比较不同水解物之间的抑制活性大小。IC50是评价降压肽体外抑制活性大小的一个十分直观、准确的指标。IC50值越小,抑制肽的活性就越强。近年来,已从多种物质中提取到了ACE抑制肽,并验证了显著的降压效果,如从小麦胚芽中水解得到的Ile-Val-Tyr (IC50=0.48μmol/L)[14],平菇中的 RLPSEFD LSAFLRA(IC50= 0.46 mg/mL)和RLSGQTIEVTSEYLFRH (IC50=1.14mg/mL)[15],金枪鱼中Trp-Pro-Glu-Ala-Ala-Glu-Leu-Met-Glu- Met-Val-Asp-Pro(IC50= 21.6μmol/L)[16]等,本实验通过HPLC法研究了草鱼肽的ACE抑制活性,其IC50为0.229mg/mL,具有良好的ACE抑制活性。
同时,本实验通过基于基于电子转移的DPPH自由基清除法和H原子转移的ORAC法全面的评价了草鱼肽的抗氧化性,分别以IC50和ORAC值表示。IC50值越小,清除DPPH自由基的能力越强,ORAC值越大,对氧自由基的清除能力越强,其抗氧化性就越强。结果表明,草鱼肽清除DPPH自由基的能力(IC50=7.630mg/mL)比任玮等[17]研究的卵白肽(IC50=5.767mg/mL)和大豆肽(IC50=6.268mg/mL)较弱,但比玉米肽和海洋胶原肽强。草鱼肽ORAC值达1317.962μmol Trolox/g,而Davalos等[18]测定了葡萄果汁和葡萄醋的ORAC值分别为25.0、11.5μmol Trolox/g。张芳轩等[19]分析了16个黑大豆种植间各单体花色苷和总花色苷的ORAC值的变幅为212.5~1834.6μmol Trolox/g,可见草鱼肽具有较强的对氧自由基的清除能力。综上所述,草鱼肽具有良好的ACE抑制活性及较强的抗氧化性,本研究将为草鱼肽保健食品的开发提供一定的理论依据。
[1] 任娇艳, 赵谋明, 崔春, 等. 草鱼源抗氧化肽的响应面法优化制备及活性评价[J]. 食品工业科技, 2009, 30(7): 69-73.
[2] 魏宗友, 潘晓花, 季昀. 生物活性肽的制备功能及在动物生产中的应用研究进展[J]. 中国饲料, 2010(23): 22-26.
[3] 中华人民共和国农业部渔业部. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2010: Ⅱ.-Ⅲ.
[4] 陈季旺, 夏文水, 黄爱妮, 等. 鱼降压肽的酶法制备工艺及其理化性质研究[J]. 水产学报, 2007, 31(4): 512-517.
[5] CHEUNG H S, CHUSHMAN D W. Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung[J]. Biochem Pharmacol, 1971, 20: 1637-1648.
[6] WU Jianping, DING Xiaolin. Characterization of inhibition and stability of soy protein derived angiotensin -Ⅰconverting enzyme inhibitory peptides[J]. Food Research International, 2002, 35: 367-375.
[7] CHEN Jiwang, WANG Yimei, ZHONG Qixin, et al. Purification and characterization of a novel angiotensin-Ⅰconverting enzyme (ACE)inhibitory peptide derived from enzymatic hydrolysate of grass carp protein[J]. Peptides, 2012, 33: 52-58.
[8] NAKAJIMA K, YOGHIE-STARK Y, OGUSHI M. Comparison of ACE inhibitory and DPPH radical scavenging activities of fish muscle hydrolysates[J]. Food Chemistry, 2009, 114: 844-851.
[9] 彭长连, 陈少薇, 林植芳, 等. 用清除有机自由基DPPH法评价植物抗氧化力[J]. 生物化学与生物物理, 2006, 27(6): 15-17.
[10] WOLFE K L, LIU Ruihai. Structure-activity relationships of flavonoids in the cellular antioxidant activity assay[J]. Journal of Agricultural and Food Chemistry, 2008, 56(18): 8404-8411.
[11] OU B, HAMPSCH-WOODILL M, PRIOR R L. Development and validation of an improved oxygen radical absorbance capacity assay using fluorescein as the fluorescent probe[J]. Agric Food Chem, 2001, 49(10): 4619-4626.
[12] ONDETTI MIGUEL A, RUBIN B, CUSHMAN D W. Design of specific inhibitors angiotensin-converting enzyme: new class of orally active antihypertensive agents[J]. Science, 1977, 196: 441-444.
[13] CUZZOCREA S, RILEY D, CAPUTI A P, et a1. Antioxidant therapy:a ilew pharmacological approach in shock, in flammation and ischemia/reperfilsion injury[J]. Pharmaeol Rev, 2001, 53: 135-139.
[14] AMHAR A, SAITO T, AIMAR M V, et a1. New derivation of the inhibitory activity against angiotensin converting enzyme (ACE) from sweet cheese whey[J]. Tohoku Journal of Agricultural Research, 1996,47: 1-8.
[15] JEONG-HOON J, SEUNG-CHAN J, JEONG-HAN K, et a1.Characterisation of a new antihypertensive angiotensinⅠ-converting enzyme inhibitory peptide fromPleurotus cornucopiae[J]. Food Chemistry, 2011, 127: 412-418.
[16] SANG-HOON L, QIAN Zhongji, SE-KWON K. A novel angiotensinⅠconverting enzyme inhibitory peptide from tuna frame protein hydrolysate and its antihypertensive effect in spontaneously hypertensive rats[J].Food Chemistry, 2010, 118: 96-102.
[17] 任玮, 金振涛, 陈亮, 等. 食源性低聚肽体外抗氧化活性的研究[J].食品与发酵工业, 2008, 34(12): 44-46.
[18] DAVALOS A, BARTOLOME B, GOMEZ-CORDOVE S C. Antioxidant properties of commercial grape juices and vinegars[J]. Food Chemisty,2005, 93: 325-330.
[19] 张芳轩, 张名位, 张瑞芬, 等. 不同黑大豆种质资源种皮花色苷组成及抗氧化活性分析[J]. 中国农业科学, 2010, 43(24): 5088-5099.
in vitroPhysiological Functions of Bioactive Peptides from Grass Carp Meat
LIN Li-mei1,CHEN Ji-wang1,WU Yong-ning2,GONG Zhi-yong1,*
(1. College of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, China;2. China National Center for Food Safety Risk Assessment, Beijing 100021, China)
In this study, bioactive peptides were prepared from grass carp meat by enzymatic hydrolysis and ultrafiltration.Their angiotensin I-converting enzyme (ACE) inhibitory activity was determined by high performance liquid chromatography(HPLC) and antioxidant activity was evaluated by DPPH radical scavenging and ORAC (oxygen radical absorbance capacity)assays. The results showed that the prepared bioactive peptides had strong ACE inhibitory activity with IC50 of 0.229 mg/mL.The concentration needed to scavenge 50% DPPH radicals was 7.630 mg/mL and an ORAC value of 1317.962 Trolox μmol/g was achieved. Thus, grass carp meat is a good source of ACE inhibitory peptides.
grass carp peptides;ACE inhibitory activity;DPPH free radical;ORAC
TS254.9
A
1002-6630(2012)15-0034-04
2012-05-15
国家“863”计划项目(2010AA023003);武汉工业学院校研究生创新基金项目(2011cx013)
林利美(1986—),女,硕士研究生,研究方向为食品安全。E-mail:llm2805810@163.com
*通信作者:宫智勇(1966—),男,教授,博士,研究方向为食品毒理学。E-mail:gongzycn@yahoo.com

