鲁米诺-铁氰化钾化学发光法测定盐酸肼屈嗪
陈建福,陈健旋,施伟梅
(1.漳州职业技术学院 食品与生物工程系,福建 漳州 363000;2.赣南医学院 药学院,江西 赣州 341000)
盐酸肼屈嗪是烟酸类衍生物,别名肼苯哒嗪、肼酞嗪,是一类具有降压和抗心律失常作用的药物,临床上主要用作扩张动脉血管药,可用于肾性高血压及舒张压较高的病人[1].目前测定盐酸肼屈嗪的方法主要有液相色谱法[2-3]、等离子体共振法[4]、光谱法[5-6]、茚三酮法[7]等,已有文献[8]报道化学发光法测定盐酸肼屈嗪,是基于磷酸化高锰酸钾氧化盐酸肼屈嗪后而产生的化学发光体系.在实验中发现,在碱性介质中,盐酸肼屈嗪对鲁米诺-铁氰化钾发光体系也存在增敏作用,据此结合流动技术建立了测定盐酸肼屈嗪的流动注射化学发光分析法[9].并用于盐酸肼屈嗪片剂中盐酸肼屈嗪含量的测定,这为盐酸肼屈嗪的测定提供了一个简便、易行、灵敏度和精密度高且分析线性范围宽的新方法.
1 实验部分
1.1 主要原料和试剂
盐酸肼屈嗪(上海江莱生物科技有限公司)标准储备液:准确称取1.966 4g的盐酸肼屈嗪标准品,用蒸馏水溶解后定容于100mL的棕色容量瓶中,得0.1mol/L标准溶液,使用时用蒸馏水逐级稀释至所需浓度.
鲁米诺(美国Sigma公司)标准储备液:准确称取1.771 6g的鲁米诺,用0.01mol/L的碳酸钠溶液溶解,并用0.01mol/L的碳酸钠溶液定容于100mL棕色容量瓶,配制成0.1mol/L标准溶液,避光保存.
铁氰化钾(汕头西陇化工有限公司)溶液、NaOH溶液等按常规配制,使用时用逐级稀释至所需浓度;
实验中所用药品均为分析纯,蒸馏水为二次蒸馏水.
1.2 实验仪器
IFFM-D流动注射化学发光分析仪,IFFS-A型多功能化学发光检测器(西安瑞迈电子科技有限公司).
1.3 实验方法
流动注射化学发光分析系统流路如图1.铁氰化钾和鲁米诺分别从铁氰化钾和鲁米诺溶液流路流入并混匀.蒸馏水从蒸馏水或分析试液流路中流入,作为空白对照试验,记录其发光信号强度(I0).待空白信号稳定后,用一定浓度的盐酸肼屈嗪标准溶液替代蒸馏水从蒸馏水或分析试液流路中流入,记录发光信号强度为(Is).用 ΔI/I0(ΔI=Is-I0)表示两者的相对发光强度,并进行定量测定.

图1 流动注射化学分析仪流路图Fig.1 Schematic diagram of flow-injection chemiluminescence analysis
2 结果与讨论
2.1 化学发光反应动力学曲线
在室温下,采用静态注射化学发光分析法研究了该化学发光体系的静态动力学曲线,考察了盐酸肼屈嗪加入前后鲁米诺-铁氰化钾体系的化学发光反应的动力学曲线,如图2所示.将盐酸肼屈嗪(或蒸馏水,作空白对照)注入到鲁米诺和铁氰化钾的混合液后,4s后即产生化学发光,发光强度到达峰值时所需时间为5s,发光强度由峰值衰减至零时只需13s,由此可见此反应为快速化学发光反应,且盐酸肼屈嗪的加入,对鲁米诺-铁氰化钾化学发光体系有增敏作用,结合流动注射技术可对盐酸肼屈嗪进行测定.
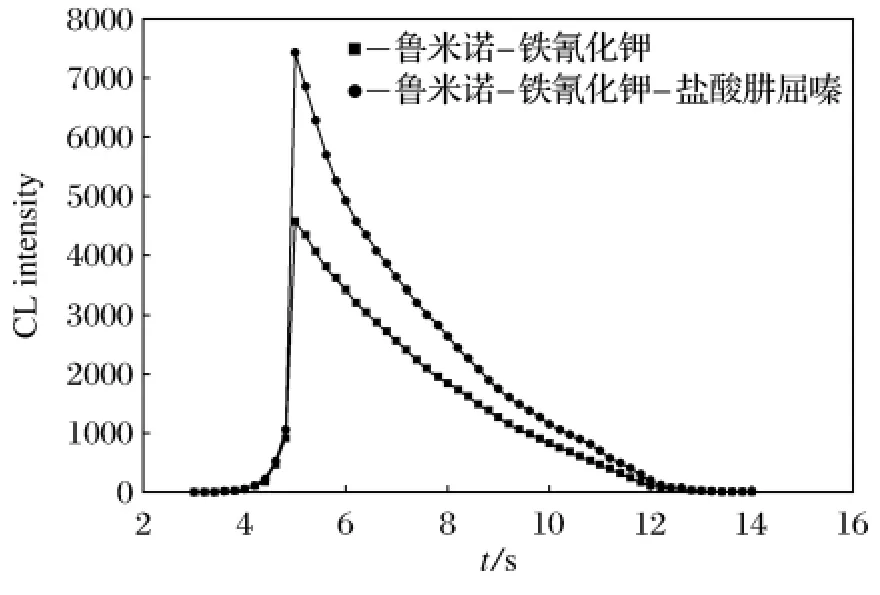
图2 鲁米诺-铁氰化钾-盐酸肼屈嗪化学发光动力学曲线Fig.2 Kinetic curves of Luminol-K3Fe(CN)6-Hydralazine Hydrochloride
2.2 反应条件的选择
2.2.1 鲁米诺浓度的影响
在该化学发光体系中,鲁米诺是化学发光试剂,其浓度是体系化学发光强度的重要影响因素,实验考察了鲁米诺浓度在1.0×10-7mol/L~1.0×10-4mol/L范围内对化学发光强度的影响.实验发现,化学发光增敏相对发光强度ΔI/I0,随着鲁米诺浓度的增大而增大,当鲁米诺溶液浓度在2.0×10-6mol/L时,反应有较高的发光强度和较低背景信号,此时ΔI/I0具有最大值.故选择鲁米诺的最佳浓度为2.0×10-6mol/L.
2.2.2 铁氰化钾浓度的影响
铁氰化钾是化学发光体系中的氧化剂,其浓度对体系的化学发光强度有重要的影响.实验考察了铁氰化钾浓度在1.0×10-5mol/L~1.0×10-2mol/L范围内对相对发光强度的影响.实验发现,随铁氰化钾浓度的增大,化学发光增敏相对发光强度ΔI/I0先增大后减小,当铁氰化钾浓度为8.0×10-4mol/L时,达到最大值,故选择铁氰化钾的最佳浓度为8.0×10-4mol/L.
2.2.3 反应介质pH值的影响
鲁米诺-铁氰化钾体系化学发光反应在碱性环境中有较好的发光信号,且体系的pH值对发光反应有重要的影响,碱性过低,信号较差,不利于低浓度的检测,碱性太强,则背景信号过高,信噪比反而下降.考察了pH值在8~14范围内对化学发光增敏相对发光强度ΔI/I0的影响.实验发现,随着pH值的增大,化学发光增敏相对发光强度ΔI/I0先增大后减小,当pH值在12时,相对发光强度有最大值.故选择pH值为12.
2.3 校准曲线、精密度和检出限
在选定的最佳条件下,按照实验方法对不同浓度的盐酸肼屈嗪溶液相对发光强度进行测定,绘制工作曲线.结果表明,样品浓度在2.0×10-8mol/L~1.0×10-6mol/L范围内体系的相对发光强度与其浓度呈良好的线性关系.为了提高测定的精密度和准确度,校准曲线按盐酸肼屈嗪溶液浓度的数量级分段绘制.校准曲线的基本参数列于表1.对浓度为6.0×10-7mol/L的盐酸肼屈嗪溶液进行平行测定11次,得相对标准偏差为1.6%,根据国际纯粹与应用化学联合会(IUPAC)建议,计算方法检出限为4×10-9mol/L.
2.4 干扰实验
为了评价所建立分析方法的选择性,实验测试了盐酸肼屈嗪溶液中可能存在的无机离子及有机物对本实验方法的干扰,以6.0×10-7mol/L的盐酸肼屈嗪标准溶液做干扰实验,实验结果表明:当相对误差小于±5%时,1 000倍的淀粉、蔗糖、Na+、K+、Cl-,500倍的 F-、CN-、NO-3、环糊精、100倍的葡萄糖、Ca2+、Mg2+、Br-、SCN-,10倍的乳糖、柠檬酸均不干扰测定.

表1 校准曲线回归方程Table 1 Regression equations of the calibration curves
2.5 样品分析
取盐酸肼屈嗪片剂20片(山东潍坊制药厂有限公司),准确称量求得每片的平均质量,研磨,分别取药品粉末量0.025g、0.05g、0.075g各三份,溶解于水,用干燥滤纸迅速滤去杂质,定容,稀释到测试范围内,同时作加标回收率,其结果见表2.从实验结果可知,加标回收测得的回收率在99.1%~100.8%之间,结果满意.
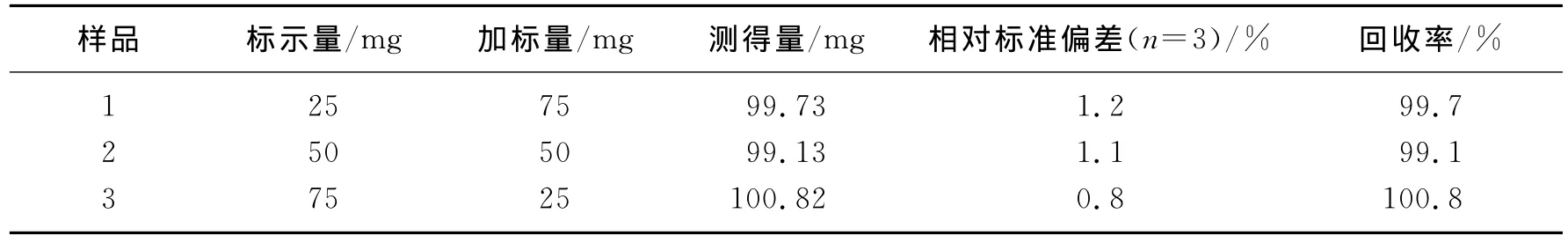
表2 盐酸肼屈嗪和回收率测定结果Table 2 Determination results ofhydralazine hydrochloride and recovery experiments
2.6 机理分析
在碱性介质中,铁氰化钾氧化鲁米诺产生的化学发光,主要是该氧化还原反应产生激发态的3-氨基邻苯二甲酸,当从激发态跃迁到基态时,释放的能量以光子的形式存在,因而产生发光现象[10].而当在加入少量的盐酸肼屈嗪时,相对化学发光强度具有明显的增敏作用,这是因为盐酸肼屈嗪分子中含有还原性强的胺基(—NH2)、亚胺基(=NH)等基团,在碱性条件下,能被铁氰化钾氧化,生成能量较高的不稳定中间产物自由基,生成的自由基在碱性介质中氧化鲁米诺产生化学发光[11].该反应机理如下:

中间产物自由基*;

3 结 论
在碱性条件下,盐酸肼屈嗪对鲁米诺-铁氰化钾化学反应发光体系具有增敏作用,据此,对影响化学发光的各种因素进行了研究,建立了鲁米诺-铁氰化钾体系流动注射化学发光测定盐酸肼屈嗪的新方法,并用于盐酸肼屈嗪片剂中盐酸肼屈嗪含量的测定,这为盐酸肼屈嗪的测定提供了一个简便、易行、灵敏度和精密度高且分析线性范围宽的新方法.
[1] 国家药典委员会.中华人民共和国药典(二部)[S].2010年版.北京:中国医药科技出版社,2010:625-626.(State Pharmacopoeia Commission.Codex of People’s Republic of China [S].2010version.Beijing:China medical science press,2010:625-626.)
[2] Liu Y Y,Li H,Luo H J,et al.LC-MS-MS Method for Quantification of Hydralazine in BALB/C Mouse Plasma and Brain:Application to Pharmacokinetic Study[J].Chromatographia,2011,73(11):1183-1188.
[3] 邱颖恒,周敏贤,李玉兰.反相高效液相色谱法测定盐酸肼屈嗪片的含量[J].中国药师,2008,11(11):1305-1307.(Qiu Yingheng,Zhou Minxian,Li Yulan.Determination of Hydralazine Hydrochloride Tablets by HPLC[J].China Pharmacist,2008,11(11):1305-1307.)
[4] Wang Y,Zhan L,Huang C Z.One-pot Preparation of Dextran-capped Gold Nanoparticles at Room Temperature Dihydralazine Sulfate in Uric Samples[J].Analytical Methods,2010,2(12):1982-1988.
[5] Shoukry A F,Issa Y M,Ibrahim H,et al.Atomic Emission Spectrometric Determination of Antazoline,Hydralazine and Amiloride Hydrochlorides,and Quinine Sulfate Based on Formation of Ion Associates with Manganese Thiocyanate[J].Analyst,1995,120(4):1211-1213.
[6] Danielson N D,Bartolo R G. Determination of Hydralazine in Tablets by Fluorescence[J].Analytical Letters,1983,16(5):343-354.
[7] 付海波,詹蕾,王健.硼酸催化茚三酮与盐酸肼屈嗪的反应及分析应用[J].西南师范大学学报:自然科学版,2012,37(5):43-48.(Fu Haibo,ZHAN Lei, WANG Jian.Boric Acid Catalyzed Ninhydrin-hydralazine Hydrochloride Reaction and Its Application to Analysis of Hydralazine Hydrochloride[J].Journal of Southwest China Normal University:Natural Science Edition,2012,37(5):43-48.
[8] Pulgarn J A,Lpez P F,Nuo P H.Time-resolved Chemiluminescent Analysis of Hydralazine in Pharmaceuticals [J]. Analytical and bioanalytical chemistry,2006,384(2):423-430.
[9] 陈建福.反相流动注射化学发光法测定盐酸林可霉素[J].嘉应学院学报:自然科学版,2012,30(2):39-41.(Chen Jianfu.Reverse Flow Injection ChemiluminescenceDetermination of Lincomycin Hydrochloride[J].Journal of Jiaying University:Natural Science,2012,30(2):39-41.
[10] 陈文娟,陈建福,陈健旋.鲁米诺—高碘酸钾化学发光法测定盐酸二甲双胍[J].济宁学院学报,2012,33(3):84-87.(Chen Wenjuan, Chen Jianfu, Chen Jianxuan.Determination of Metformin Hydrochloride by Chemiluminescence Method based on Luminol-potassium Periodate System[J].Journal of Jining University,2012,33(3):84-87.)
[11] Lu C,Song G Q,Lin J M.Reactive Oxygen Species and Their Chemiluminescence Detection methods[J].Trends in Analytical Chemistry,2006,25(10):985-995.

