菜园根际土壤解磷真菌的分离筛选及初步鉴定
肖春玲,宋勇生,王安萍,温艳梅,汪文丽
菜园根际土壤解磷真菌的分离筛选及初步鉴定
*肖春玲1,2,宋勇生1,2,王安萍1,2,温艳梅1,汪文丽1
(1.井冈山大学生命科学学院,江西,吉安343009;2. 江西省生物多样性与生态工程重点实验室,江西,吉安343009)
为提高土壤磷利用率及微生物修复污染环境提供参考依据,本研究采用平板涂布法,从不同蔬菜根际土壤中分离得到11株降解有机磷和无机磷的解磷真菌。根据透明圈直径和菌落直径比值的大小, 从中筛选到3株分解无机磷较强的菌株WP-2、WP-5、WP-7;并进一步通过液体摇瓶培养复筛,确定其中的WP-5菌株分解无机磷能力最强,其解磷能力达66.88 mg/L。经初步鉴定,WP-2菌株属于木霉属()、WP-5菌株属于青霉属()、WP-7菌株属于小克银汉霉属。
解磷真菌;分离鉴定;根际土壤;解磷能力
磷是植物生长发育不可缺少的三大营养元素之一,但土壤中95%~99%的磷为无效磷形式,植物很难直接吸收利用,严重影响着植物生长特别是农作物产量[1-2]。我国有74%的耕地土壤缺乏有效磷,磷成为这些耕地中限制植物生长发育的主要因素之一[3]。长期以来,人们通过施入磷肥来满足作物生长的需要,但磷肥的当季利用率仅为5%~25%,大部分磷与土壤中的Ca2+、Fe2+、Fe3+、Al3+结合形成难溶性磷酸盐, 造成了作物的低吸收和磷元素在土壤中的大量积累,降低了磷肥的利用率并带来严重的环境污染[4-5]。近年来,利用植物根际与磷循环相关的生物学系统来调节植物根际磷的有效性,特别是利用解磷微生物来活化土壤难溶性磷,已成为提高土壤磷的有效性研究热点[6]。土壤中具有解磷作用的微生物包括细菌、真菌和放线菌等,其中解磷真菌的溶磷能力较强,而且遗传性状相对稳定。解磷微生物有强烈的根际效应,在植物根际的数量要远远大于其周围土壤中的数量,从特定作物的根际土壤中筛选高效解磷菌, 可以获得与作物亲和性好、易于在根际定植的菌株,从而更有利于其解磷能力的发挥[7]。本研究以菜园根际土壤为材料,利用选择培养基筛选高效解磷真菌,探究不同碳源和氮源对解磷真菌溶磷的影响,以期为提高土壤磷利用率及微生物修复污染环境提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试根际土壤
从井冈山大学校园周边的菜地中, 采用5点取样法,采集白菜、油菜、大蒜、香菜、大豆和豌豆的小根及黏附其上的根际土壤,混合后分别装入无菌袋中备用。
1.1.2 培养基
无机磷培养基:葡萄糖10 g, (NH4)2SO40.5 g, MgSO4·7H2O 0.3 g,NaCl 0.3 g,KCl 0.3 g,FeSO4·7H2O 0.03 g,MnSO4·7H2O 0.03 g,Ca3(PO4)25 g, 水1000 mL,pH = 6.0~6.5。
有机磷培养基:葡萄糖10g, (NH4)2SO40.5 g, MgSO4·7H2O 0.3 g,NaCl 0.3 g,KCl 0.3 g,FeSO4·7H2O 0.03 g, MnSO4·7H2O 0.03 g, CaCO35 g,蛋黄液10 mL(蛋黄液为无菌生理盐水与鸡蛋黄1∶1配制), 水1000 mL,pH = 6.0~6.5
PDA培养基:马铃薯 200 g,葡萄糖 20 g,琼脂 20 g,水1000 mL。
1.2 试验方法
1.2.1 土壤悬液的制备
无菌条件下取不同蔬菜小根及黏附其上的根际土壤称量后,溶于装有90 mL无菌水的三角瓶中,28 ℃恒温振荡30 min,使微生物细胞充分分散,然后取出蔬菜小根,沥干水分,称其重量,计算三角瓶中土壤悬液的浓度,然后进行倍比稀释至10-6。
1.2.2 菌株分离
将梯度稀释后的土壤悬液各取 0.2 mL 涂布于分离培养基上,每个浓度重复 3 皿,28 ℃恒温培养 3~7 d,挑取生长旺盛、具有较大透明圈的单菌落转至PDA培养基斜面,培养成熟后放4 ℃冰箱保藏。
1.2.3 解磷菌的筛选
将分离的单菌株分别在PDA培养基上活化,然后采用透明圈法进行初筛。复筛时挑选初筛中透明圈直径与菌落直径的比值(D/d)较高的菌株分别在PDA培养基斜面上活化后转接1次,置28 ℃恒温培养箱中培养 6 d,再用无菌水制成108个/mL孢子悬浮液,按1%的接种量接入无机磷液体培养基中,以接等量的无菌水作对照,每株3 次重复,160 r/min,28 ℃摇床振荡培养6 d,每天取培养液离心后,用钼锑抗比色法测定上清液中可溶性磷的含量[8-9]。
1.2.4可溶性磷的测定方法
首先绘制磷标准曲线,准确吸取5 mg/L磷标准溶液0.00、2.00、4.00、6.00、8.00、10.00 mL分别于50 mL容量瓶中,然后各加入2mL钼锑抗显色剂,蒸馏水定容至20 mL,即得含磷量分别为0.00、0.50、1.00、1.50、2.00、2.50 mg/L的磷标准系列溶液。在室温20 ℃以上的条件下摇匀静置30 min后,在700 nm 波长处测其吸光度。以磷浓度(mg/L)为横坐标,以吸光度为纵坐标得磷标准曲线,所得标准曲线方程为:= 0.2861x+0.0068,相关系数R2= 0.9994,线性关系良好。然后将斜面保存的菌种活化后制取孢子悬液,按1%的接种量接入无机磷液体培养基中,以接等量的无菌水作对照,每株做3次重复,160 r/min,28℃摇床振荡培养. 每天取培养液离心后,用钼锑抗比色法测定上清液中可溶性磷的含量。
1.2.5 无机磷液体培养基的优化
将供试菌株活化后制成孢子悬液,按1%的接种量接于不同的无机磷液体培养基上,碳源分别为葡萄糖、蔗糖、乳糖和可溶性淀粉;氮源分别为硫酸铵、氯化铵、尿素和酵母浸膏,液体培养基其它成分和浓度保持不变,每株3次重复,160 r/min,28 ℃摇床振荡培养6 d,每天取培养液离心,用钼锑抗比色法测定上清液中可溶性磷含量。
1.2.6 解磷菌的鉴定
解磷菌的形态观察及分类鉴定参照李振高、魏景超和邢来君等[10-12]的方法进行。分别挑取待测菌株的孢子点植于PDA培养基平板上(每板3个点),28 ℃恒温培养3~10 d,每天观察菌落特征和个体形态的变化,根据菌株的形态特征进行检索和初步鉴定。
1.2.7 数据处理
所有实验数据均为3次重复的平均值,采用Excel2003作图。
2 结果与分析
2.1 菌株的分离与初筛
从白菜等6种蔬菜的根际土壤中共分离到11株解磷真菌,其中解无机磷菌株7株,解有机磷菌株4株。透明圈法测定结果(表1)显示,WP-2、WP-5和WP-7菌株分解无机磷的能力较强,其透明圈直径与菌落直径的比值(D/d)分别为1.92、2.41和1.96,其中WP-5的解磷能力最强。

表1 透明圈法测定解磷真菌的解磷能力
2.2 复筛结果分析

图1 培养液中溶磷量随时间的变化
三株解磷真菌培养液中溶磷量随时间的变化结果(图1)显示:三株解磷真菌均在摇瓶培养5 h后溶磷量达到高峰,其中WP-5菌株的解磷能力最强,摇瓶培养5 d后溶磷量高达66.88 mg/L;WP-2次之,摇瓶培养5 d后溶磷量达到59.75 mg/L;而WP-7初筛时D/d值大于WP-2,但复筛时解磷能力小于WP-2,摇瓶培养5 d后溶磷量最高仅为42.69 mg/L,这表明菌株在固体和液体培养基上的生长和代谢存在差异,解磷能力并非完全一致。
2.3 解磷真菌的初步鉴定
根据菌株的形态特征(表2)检索, 初步鉴定WP-2菌株属于木霉属(),WP-5菌株属于青霉属(),WP-7菌株属于小克银汉霉属。

表2 菌株的形态特征及初步鉴定结果
2.4 碳源对解磷能力的影响

图2 不同碳源对WP-5 解磷能力的影响
图2表明,提高解磷能力的最佳碳源是蔗糖。当碳源使用蔗糖时,摇瓶培养5 d后WP-5菌株的溶磷活性最高,溶磷量高达69.81 mg/L。其次为葡萄糖,摇瓶培养5 d后溶磷量也达到 66.57 mg/L。
2.5 氮源对解磷能力的影响
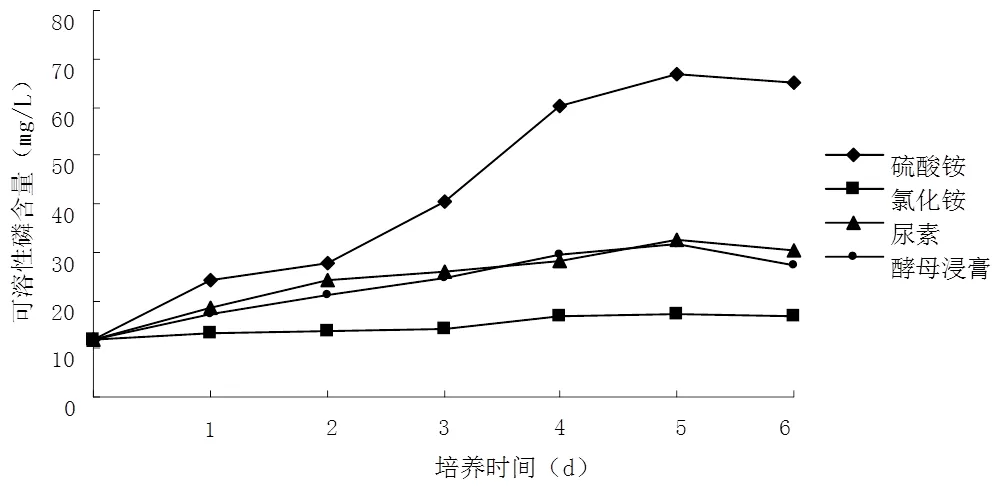
图3 不同氮源对WP-5解磷能力的影响
图3显示,氮源为硫酸铵时,摇瓶培养5 d后WP-5菌株的溶磷量最高,达到66.73 mg/L;其次是尿素和酵母浸膏,而用氯化铵作为氮源时,溶磷量明显下降。
3 讨论
本研究采用透明圈法进行初筛,在无机磷培养基平板上, 28℃培养6 d 后,WP-2、WP-5和WP-7菌株的透明圈直径与菌落直径的比值(D/d)均超过了1.90,但比较表1和图1可知,复筛时测定的可溶性磷含量和D/d 值二者之间并不存在线性关系,D/d 值为1.92的WP-2菌株,在摇瓶复筛中溶磷量最高达59.75 mg/L;而WP-7菌株的D/d值(1.96)大于WP-2,但摇瓶复筛中溶磷量最高仅为42.69 mg/L,解磷能力明显小于WP-2。这可能与解磷菌在固体和液体不同环境的培养过程中产生的酶、有机酸的数量和种类以及菌落在平板上堆积情况的差异等有关;同时也表明在解磷菌的筛选中,透明圈法只能定性地反映菌株的解磷能力,而要定量评价菌株的解磷能力,液体的摇瓶复筛是很重要的一个步骤[13-15]。
解磷微生物的解磷能力,主要受菌体自身特性的影响,也与培养基中碳源、氮源等培养条件有关[16-17]。本研究结果表明,不同的碳源和氮源对解磷真菌的解磷能力影响较大,以蔗糖为碳源时,WP-5菌株的解磷能力最强,说明蔗糖是其最佳碳源之一,但WP-5菌株对可溶性淀粉的利用最低。同时,WP-5菌株的溶磷能力受氮源影响也很明显,在以硫酸铵为氮源的培养基中,其解磷活性较高,而用氯化铵作为氮源时,溶磷量明显下降。
本研究中, 我们初步建立了根际土壤解磷真菌的筛选体系, 并对产生较大解磷圈的菌株WP-5在固体和液体条件下的解磷能力进行了测定,同时优化了无机磷液体培养基。结果显示, 该菌株有较强的解磷能力, 对于该菌株在不同土壤、不同作物、不同环境下的生长繁殖特点以及与根瘤菌、菌根菌、纤维素分解菌等组合解磷还有待于进一步的研究。
[1] 赵小蓉,林启美. 微生物解磷的研究进展[J]. 土壤肥料, 2001,5(3):7-11
[2] 刘月娟,汪金舫.β-甘油磷酸钠的加入对土壤有机磷组分和速效磷含量的影响[J]. 土壤,2007,39(3):469-473.
[3] 钟传青,黄为一. 不同种类解磷微生物的溶磷效果及其磷酸酶活性的变化[J].土壤学报,2005,42(2):286-294.
[4] Son H J,Park G T,Cha M S. Solubilization ofinsoluble inorganic phosphates by a novel salt-and pH-tolerant Pantoea agglomerans R-42 isolated from soybean rhizo-sphere[J].Microbiol Biotechnol., 2006,97:204-210.
[5] 范丙全,金继运,葛诚.32P 示踪法研究溶磷真菌对磷肥转化固定和有效性的影响[J]. 应用生态学报, 2004, 15(11):2142-2146.
[6] 冯宏,李永涛,张志红,等. 类芦根际溶磷真菌的筛选、鉴定及其溶磷能力分析[J].微生物学通报,2010,37(5): 677-681.
[7] 赵小蓉,林启美,等.玉米根际与非根际解磷细菌的分布[J].生态学杂志,2001,20(6):62-64.
[8] 赵小蓉,林启美. 细菌解磷能力方法的研究[J].微生物学通报, 2001,28(1):1-4.
[9] 陈绍明,郑福寿. 水生微生物学实验方法(上)[M]. 北京:海洋科学技术出版社,1985:186-189.
[10] 李振高,骆永明,腾应. 土壤与环境微生物研究法[M]. 北京:科学出版社, 2008:143-209
[11] 魏景超. 真菌鉴定手册[M]. 上海:上海科学技术出版社, 1979:121-238
[12] 邢来君,李明春. 普通真菌学[M]. 北京: 高等教育出版社,1993:274-430
[13] 朱培淼,杨兴明,徐阳春,等.高效解磷细菌的筛选及其对玉米苗期生长的促进作用[J].应用生态学报, 2007,18(1):107-112.
[14] 林启美,王华,赵小蓉,等. 细菌和真菌溶解磷矿粉能力的研究[J].微生物学通报,2001,28(2):26-30.
[15] 余贤美,王义,沈奇宾,等. 解磷细菌PSB3 的筛选及拮抗作用的研究[J].微生物学通报,2008,35(9): 1398-1403.
[16] 金术超,杜春梅,平文祥,等.解磷微生物的研究进展[J].微生物学杂志,2006,26(2):73-78.
[17] 杨 珏,阮晓红. 土壤磷素循环及其对土壤磷流失的影响[J]. 土壤与环境,2007,10(3):256-258.
ISOLATION AND SCREENING OF PHOSPHATE-SOLUBILIZING FUNGI FROM THE RHIZOSPHERIC SOIL AND ITS PRILIMINARY IDENTIFICATION
*XIAO Chun-ling1,2, SONG Yong-sheng1,2, WANG An-ping1,2, WEN Yan-mei1, WANG Wen-li1
(1.School of Life Sciences, Jinggangshan University, Ji’an, Jiangxi 343009, China; 2. Key Laboratory for Biodiversity Science and Ecological Engineering of Jiangxi Province, Ji’an, Jiangxi 343009, China)
In order to improve the utilization ratio of soil phosphorus and provide the reference for microbial remediation pollution environment, eleven strains of organic and inorganic phosphate-solubilizing fungi were isolated from different vegetables rhizospheric soil by spread plate method. Three fungi strains WP-2, WP-5 and WP-7 with higher inorganic phosphate-solubilizing ability were obtained according the ratio of hyaline circle diameter and colony diameter, and then the strain WP-5 with the highest inorganic phosphate-solubilizing ability was screened out by shake culture experiment, its ophosphate-degradation ability reached to 66.88mg/L.Three strains were selected and identified assp.,sp. andsp.
phosphate-solubilizing fungi; isolation and identification; rhizospheric soil; phosphate-solubilizing ability
S154.38+1
A
10.3969/j.issn.1674-8085.2012.04.011
1674-8085(2012)04-0048-04
2012-03-24;
2012-05-27
江西省教育厅重点实验室项目(GJJ10690);江西省生物学高水平学科资助项目
*肖春玲(1962-),女,江西吉安人,教授,主要从事微生物学教学和研究(E-mail: xiaochunling@jgsu.edu.cn);
宋勇生(1977-),男,江西吉水人,讲师,博士,主要从事环境生物学教学和研究(E-mail: yshson001@126.com);
王安萍(1971-),女,江西吉安人,实验师,硕士,主要从事微生物学实验教学和研究(E-mail: jskwangap@hotmail.com);
温艳梅(1989-),女,江西永丰人,井冈山大学生命科学学院本科生(E-mail: hanxin008@126.com);
汪文丽(1989-),女,江西上饶人,井冈山大学生命科学学院本科生(E-mail: wwl07@126.com).

