锦灯笼酸浆宿萼皂苷提取工艺的研究
孟庆然,耿红兰,任石涛 ,王晓闻
(山西农业大学 食品科学与工程学院,山西 太谷030801)
皂苷是一类非挥发性、表面活性化合物,在自然界中分布广泛,主要存在于植物中。因其水溶液具有起泡性,故称之为皂苷[1]。皂苷具有多种属性,包括甘苦性[2,3]、发泡性和乳化性、药理特性和药用性质[4]、溶血特性[5]、以及抗菌、杀虫、灭软体动物活性[5~7]等。皂苷在饮料和糕点及化妆品和医药产品中有着广泛应用[5,8]。虽然目前对酸浆草、宿萼及其果实的研究较多[9,10],然而有关锦灯笼宿萼皂苷提取工艺的研究尚未见报道。因此,本文以锦灯笼宿萼为实验材料探讨锦灯笼宿萼皂苷的最佳提取工艺。
1 材料与方法
1.1 材料
1.1.1 试验原料
锦灯笼酸浆宿萼粉末:原料采自山西省阳高县王官屯镇。将去除萼内浆果的原料于60℃条件下烘干,然后经粉碎、40目过筛即得锦灯笼酸浆宿萼粉末。
1.1.2 试验试剂
95%的乙醇,工业级;AR级的石油醚、正丁醇、乙醚、无水甲醇、无水乙醇、冰醋酸、香草醛、高氯酸。薯蓣皂苷标准品:天津马克生物技术有限公司。
1.1.3 主要仪器及设备
FZ102型微型植物粉碎机(天津市泰斯特仪器有限公司);R-1001 N旋转蒸发仪(郑州长城科工贸有限公司);SHB-Ⅲ循环水式真空泵(郑州长城科工贸有限公司);DLSB5/10低温冷却液循环泵(郑州长城科工贸有限公司);WB-2000水浴锅(郑州长城科工贸有限公司);XMTB数显温控仪(江苏金坛中大仪器厂);723可见分光光度计(上海菁华科技仪器有限公司);UV-LS-30紫外可见分光光度计(龙尼柯上海仪器有限公司);LD4-2 A低速离心机(北京雷勃尔离心机有限公司);SHY-2 A水浴恒温振荡器(江苏金坛市金城国胜试验仪器厂);BS210S电子天平(北京赛多利斯天平有限公司);101-3-BS-Ⅱ电热恒温鼓风干燥箱(上海跃进医疗器械厂)。
1.2 试验方法
1.2.1 皂苷含量的测定
采用香草醛一高氯酸法[11]:取一定体积的皂苷溶液,置于10 mL具塞试管中,60℃水浴挥干溶剂,然后加入0.20 mL 5%的香草醛一冰醋酸溶液和0.80 mL高氯酸,密塞摇匀,置于70℃水浴中振荡加热15 min,取出后立即用冰水冷却,加入5.00 mL冰乙酸混匀,静置20 min,以不加样品的平行样作为空白,在最大吸收波长处测量吸光度值。
1.2.2 标准溶液的制备
精确称取薯蓣皂苷标准品2.5 mg,用无水乙醇溶解,定容于25 mL容量瓶中,得到浓度为0.1 g·L-1薯蓣皂苷标准溶液。
1.2.3 最大吸收波长的确定
取1.2.2薯蓣皂苷标准液0.5mL,按照
1.2.1 的方法进行处理,用紫外一可见分光光度计对混匀静置后的液体进行全波长扫描,根据扫描吸收光谱确定其最大吸收峰的波长。
1.2.4 薯蓣皂苷标准曲线的绘制
准确移取薯蓣皂苷标准溶液 0.10、0.20、0.30、0.40、0.50、0.60、0.70 mL于10 mL具塞试管中,每组5个平行,按照1.2.1的方法进行处理,在1.2.3所测得的最大吸收波长处测量吸光度值。以吸光度(A)为纵坐标Y,薯蓣皂苷的质量(μg)为横坐标X做标准曲线,并建立回归方程。见图1。
1.2.5 样品液的制备及总皂苷含量的测定
参照刘雅丽等[12]的方法。精确称取2 g原料于圆底烧瓶中,用乙醇回流提取两次,合并滤液,3500 r·min-1条件下离心10 min,取上清减压蒸干;用10 mL蒸馏水溶解提取物,加等体积的石油醚和水饱和正丁醇各萃取3次;合并正丁醇相并减压蒸干,用5 mL甲醇溶解沉淀;加8倍体积乙醚洗涤,3000 r·min-1离心10 min,洗涤3次,即得粗皂苷。将粗皂苷定容于50 mL容量瓶中即得样品液。精确量取样品溶液1 mL,5个平行,按照1.2.1的方法测定吸光度值,根据回归方程计算总皂苷含量。
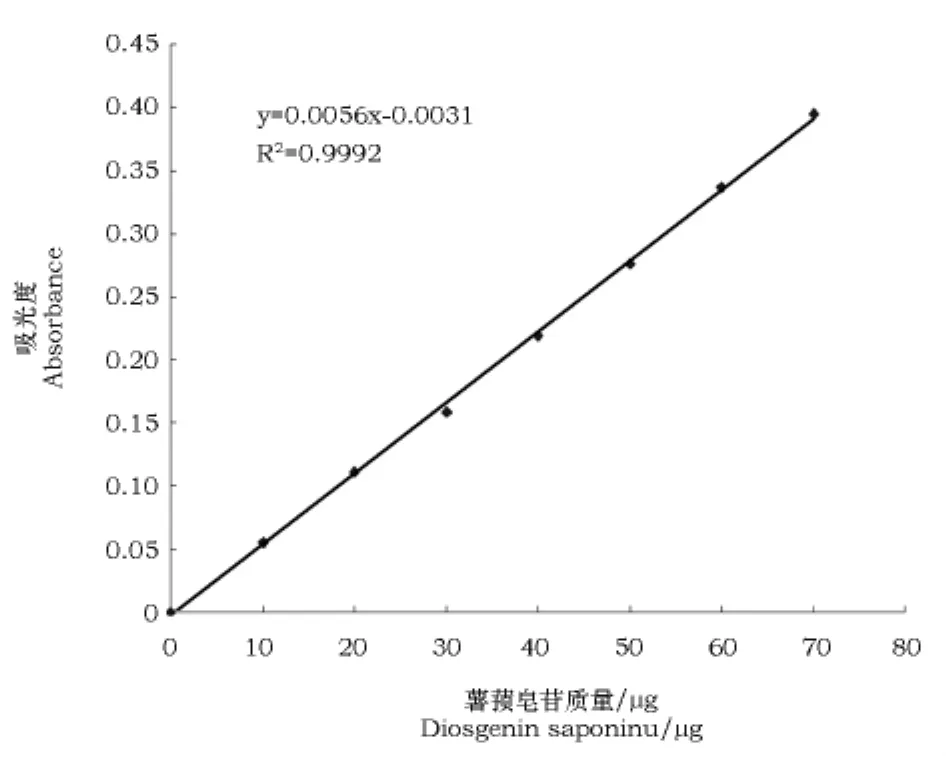
图1 薯蓣皂苷标准品标准曲线Fig.1 Standard curve of diosgenin saponins
1.2.6 最佳提取工艺的确定
1.2.6.1 乙醇浓度的确定
分别 用 40%、50%、60%、70%、80%、90% 的乙醇,其他条件固定,按照1.2.5的方法提取并测定粗皂苷含量,筛选最佳乙醇提取浓度。
1.2.6.2 提取温度的确定
分别在 30℃、40℃、50℃、60℃、70℃、80℃、90℃条件下,其他条件固定,按照1.2.5的方法提取并测定粗皂苷含量,筛选最佳提取温度。
1.2.6.3 提取时间的确定
将宿 萼 分 别 提 取 30、60、90、120、150、180 min,其他条件固定,按照1.2.5的方法提取并测定粗皂苷含量,筛选最佳提取时间。
1.2.6.4 料液比的确定
以1∶4、1∶6、1∶8、1∶10、1∶12的料液比进行提取,其他条件固定,按照1.2.5的方法提取并测定粗皂苷含量,筛选最佳提取料液比。
1.2.6.5 最佳提取条件的确定
根据上述单因素试验结果设计正交试验因素水平表,进行L9(34)正交试验,以确定锦灯笼酸浆宿萼总皂苷的最佳提取工艺。
1.2.7 样品溶液稳定性试验
精确量取一定体积的样品溶液,按照1.2.1的方法测定吸光度值,每隔5 min测定一次,观察样品溶液在60 min之内的稳定性。
2 结果与讨论
2.1 最大吸收波长的确定
可见光光谱扫描结果见图2。
薯蓣皂苷标准品加香草醛一高氯酸显色后在400~700 n m波长下进行扫描。由图2可见,薯蓣皂苷标准品在464 n m处有最大吸收峰,故本试验选用464 n m为测定波长。
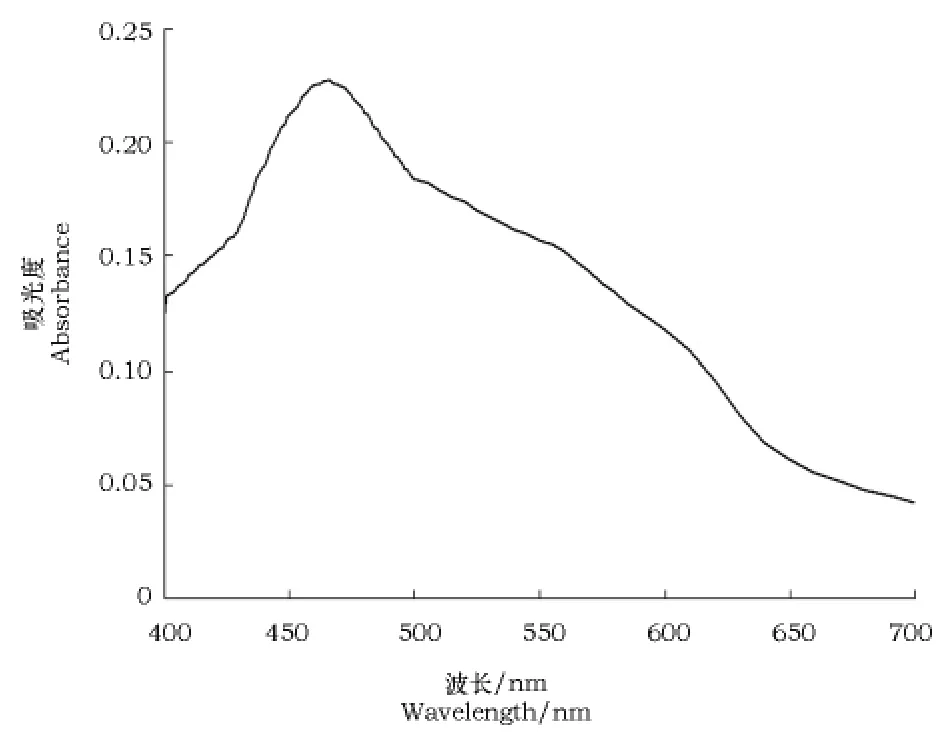
图2 薯蓣皂苷标准品全波长扫描图Fig.2 Wavelength scanning results of diosgenin saponins standard product
2.2 单因素试验结果
2.2.1 不同的乙醇浓度对锦灯笼酸浆宿萼总皂苷提取率的影响
由图3可见,相同的条件下,随着乙醇浓度的增大,总皂苷的得率先逐渐增加而后降低,80%的乙醇对锦灯笼酸浆宿萼总皂苷的提取效果最好。
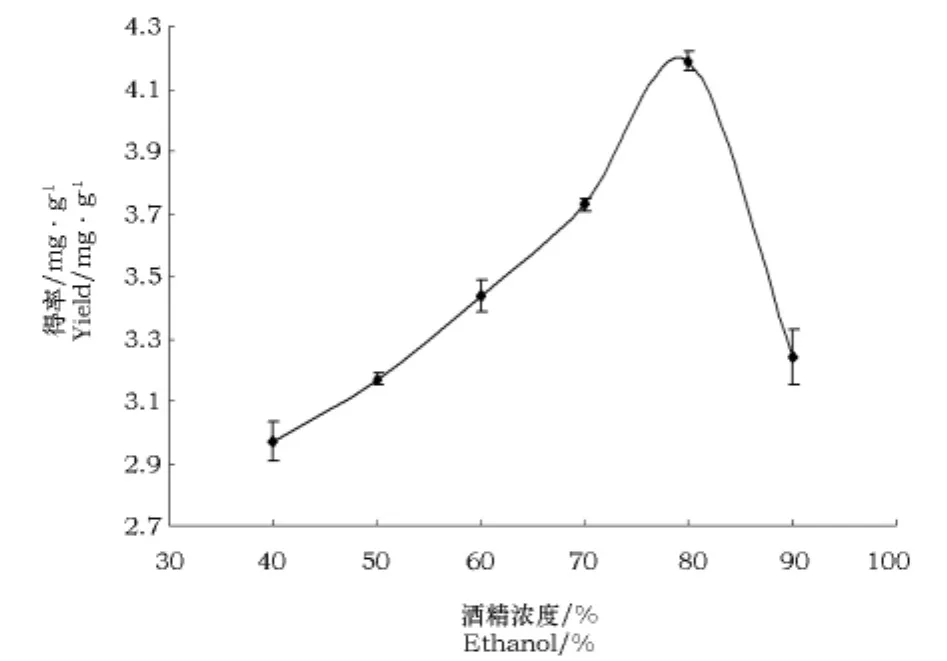
图3 乙醇浓度对锦灯笼酸浆宿萼总皂苷提取率的影响Fig.3 Effect of ethanol concentration on the extraction rate
2.2.2 不同的提取温度对锦灯笼酸浆宿萼总皂苷提取率的影响
由图4可见,相同的条件下,随着提取温度的升高,总皂苷的得率先逐渐增加而后降低并逐渐趋于稳定。60℃时锦灯笼酸浆宿萼总皂苷的提取率最高,故最佳提取温度在60℃左右。
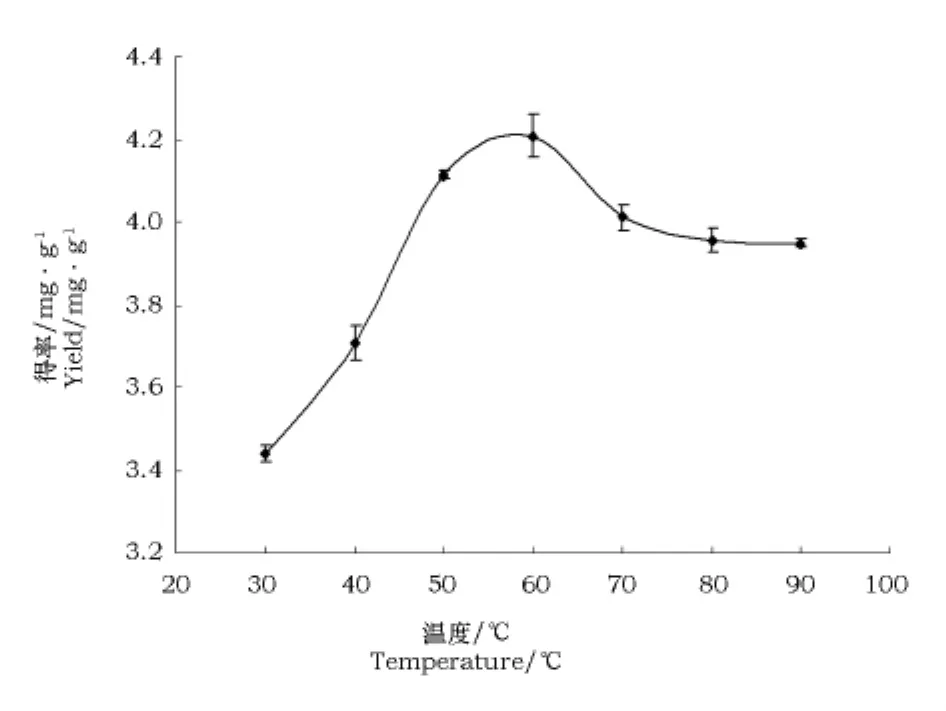
图4 提取温度对锦灯笼酸浆宿萼总皂苷提取率的影响Fig.4 Effect of temperature on the extraction rate
2.2.3 不同的提取时间对锦灯笼酸浆宿萼总皂苷提取率的影响
由图5可见,相同的条件下,在30~120 min内,随着时间的延长,总皂苷的得率先逐渐增加而后基本相同。因此,总皂苷的最佳提取时间在120 min左右。
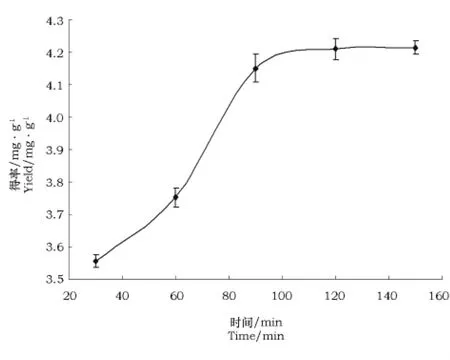
图5 提取时间对锦灯笼酸浆宿萼总皂苷提取率的影响Fig.5 Effect of time on the extraction rate
2.2.4 不同的料液比对锦灯笼酸浆宿萼总皂苷提取率的影响

图6 料液比对锦灯笼酸浆宿萼总皂苷提取率的影响Fig.6 Effect of liquid-solid ratio on the extraction rate
由图6可见,相同的条件下,随着料液比的增加,总皂苷的得率逐渐增加,但到一定的程度时,得率趋于稳定。料液比过大,会增加下一步浓缩的困难,消耗更多的时间和能量,因此,料液比选1∶8左右较为适宜。
2.3 正交试验结果
正交试验因素及水平设计见表1,正交试验结果及方差分析见表2、表3。
由表2可见,影响锦灯笼酸浆宿萼皂苷提取率的因素顺序依次为乙醇浓度、料液比、提取温度、时间。由此正交试验得出的最优提取工艺组合为A2B2C2D3,80%的乙醇,60℃,120 min,1∶9的料液比。此条件下总皂苷的得率为4.283 mg·g-1。

表1 因素水平表Table 1 Factors and levels in L 9(3 4)orthogonal experiment
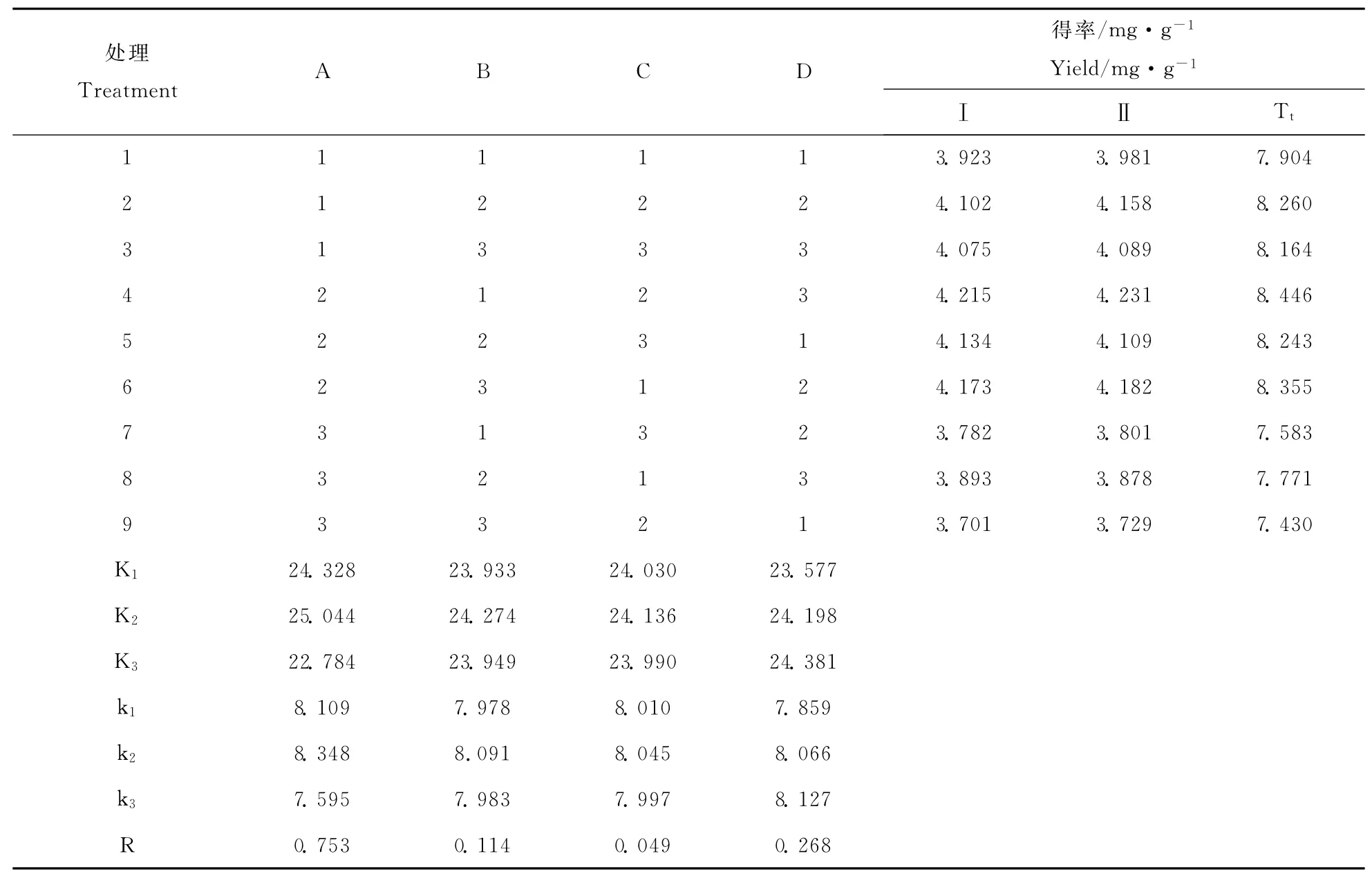
表2 正交试验结果Table 2 Results oforthogonal test

表3 方差分析表Table 3 Variance analysis table
由表3方差分析可以看出,乙醇浓度、温度和料液比对粗皂苷得率的影响差异极显著,而时间的影响差异不显著。从节约成本、缩短提取时间的角度考虑可以采用105 min的提取时间。
2.4 样品溶液稳定性试验
1 h内供试样品的稳定性见图7。
由计算可得,1小时内,A1组、A2组和A3组吸光度值的下降率分别为0.98%、0.89%和0.78%,3组吸光度值平均下降率为0.883%。吸光度下降率较小(SD=1%),在测试时间内基本稳定。
3 结论
锦灯笼酸浆宿萼皂苷回流提取的最优工艺条件为:乙醇浓度为80%、提取温度60℃,提取时间105 min,料液比1∶9。此条件下总皂苷得率较高,且性质稳定。
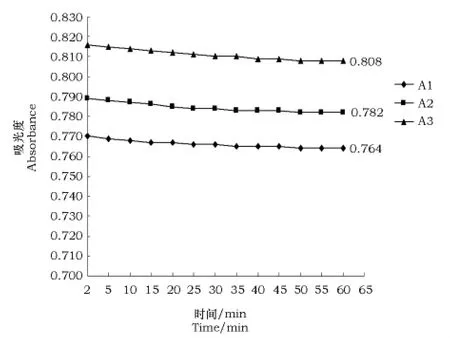
图7 供试样品稳定性曲线Fig.7 The stability curve of samples
[1]Oleszek W A.Chro matographic deter mination of plant saponins[J].Jour nal of Chromatography A,2002,967(1):147-162.
[2]Kitagawa I.Licorice root.A natural sweetener and an important ingredient in Chinese medicine[J].Pure Appl Chem,2002,74(7):1189-1198.
[3]Ti watt K,Piyanut T,Walee C,atal.Triter penesaponins from Chenopodium quinoa Willd[J].Phytochemistry,2008,69:1919-1926.
[4]中华本草编委会.中华本草[M].上海:上海科学技术出版社,1999:625-631.
[5]Spar g S G,Light M E,van Staden J.Biological activities and distribution of plant saponins[J].Et hnopharmacol,2004,94:219-243.
[6]Golawska S,Bogu mil L,Oleszek W.Effect of low and high-saponin lines of alfalfa on pea aphid[J].Journal of Insect Physiology,2006,52(7):737-743.
[7]Ricar do S M,Karine N,Kurt H.Novel moll uscicide against Po macea canaliculata based on quinoa(Chenopodium quinoa)saponins[J].Crop Protection,2008,27(3-5):310-319.
[8]Uematsu Y,Hirata K,Saito K.Spectr ophoto metric deter mination of saponin in Yucca extract used as f ood additive[J].AOAC Int,2000,83:1451-1454.
[9]王晓闻,张鲁,任石涛.酸浆宿萼抗氧化活性研究[J].中国食品学报,2010,10(4):136-140.
[10]王家东,王晓闻.酸浆营养成分的分析[J].山西农业大学学报:自然科学版,2005,25(4):376-379.
[11]顾小红,赵海雯,汤坚,等.癞葡萄总皂甙测定方法的研究[J].食品科学,2005,26(8):313-317.
[12]刘雅丽,韩书影,赵后,等.锦灯笼宿萼皂苷降血糖作用研究[J].东北师范大学学报:自然科学版,2010,42(2):105-109.

