大孔树脂分离纯化杜仲翅果中桃叶珊瑚甙的研究
马 龙,周先汉,许 晖
(1.蚌埠学院生物与食品工程系,安徽蚌埠 233030;2.合肥工业大学生物与食品工程学院,安徽合肥 230009)
大孔树脂分离纯化杜仲翅果中桃叶珊瑚甙的研究
马 龙1,周先汉2,许 晖1
(1.蚌埠学院生物与食品工程系,安徽蚌埠 233030;2.合肥工业大学生物与食品工程学院,安徽合肥 230009)
为获得较高纯度的桃叶珊瑚甙,采用大孔树脂吸附法对杜仲翅果中桃叶珊瑚甙粗提液进行纯化研究。比较5种大孔吸附树脂对桃叶珊瑚甙的静态吸附-解吸效果,从中筛选出适合桃叶珊瑚甙分离纯化的树脂,并对其动态吸附和解吸性能进行研究。结果表明:D4020树脂最适合桃叶珊瑚甙的纯化;当上样液浓度为3mg/mL、pH7、上样速率2mL/min、上样液体积40mL时,树脂达到动态吸附饱和;再用120mL 50%(v/v)乙醇溶液,以2mL/min的流速可以洗脱完全。经过D4020树脂的纯化,桃叶珊瑚甙精制品纯度达到62.54%。
大孔树脂,吸附,纯化,杜仲翅果,桃叶珊瑚甙
杜仲(Eucomm ia ulmoides Oilv.)多年生落叶乔木植物,被称为“神奇之树”,其神奇之处在于杜仲叶、花、果实同杜仲皮一样都含有人体必不可少的药用活性成分,具有十分独特的医疗保健功能[1]。桃叶珊瑚甙(aucubin)是杜仲中一种含量丰富的生物活性成分,分布于杜仲各部位,研究表明其在杜仲果实中含量最高[2]。桃叶珊瑚甙为环烯醚萜甙类化合物,具有护肝解毒、消炎、抗氧化、抗衰老、抗骨质疏松及营养神经元细胞等众多药理活性[3-4]。大孔吸附树脂是一类不溶于酸、碱及各种有机溶剂且有较好吸附性能的有机高聚物吸附剂,大孔树脂吸附分离技术是近些年发展起来的一种新型分离纯化技术,具有吸附容量大、吸附速度快、分离效果好、再生简便等优点,已被广泛应用于植物天然活性成分(如皂苷、黄酮、内酯、生物碱等)的分离和纯化[5]。本研究以大孔树脂吸附法对杜仲翅果中桃叶珊瑚甙粗提物的纯化进行探讨,旨在为杜仲翅果资源的深度开发利用提供参考。
1 材料与方法
1.1 材料与仪器
杜仲翅果 购自陕西省略阳县杜仲开发中心;桃叶珊瑚甙对照品 购自中国药品生物制品鉴定所;桃叶珊瑚甙标准品 购自SIGMA公司;Epstahl试剂(对二甲氨基苯甲醛0.25g,冰醋酸50g,35%磷酸5g,水20m L)、盐酸、氢氧化钠等 均为市售,分析纯;大孔树脂 南开大学化工厂,种类和技术参数见表1。
AR1140电子天平 梅特勒-托利多仪器(上海)有限公司;752紫外可见分光光度计 上海菁华科技仪器有限公司;20×280mm树脂柱 安徽天长市千秋玻璃仪器厂;BT1-100恒流泵 上海琪特分析仪器有限公司;CT/DW 60E冷冻干燥机 Heto-Holten公司;ACQUITY UPLC-LCT超高效液相色谱-飞行时间质谱联用仪 PremierTM XEWaters公司。

表1 大孔树脂的技术参数Table 1 Characteristic parameter of themacroporous adsorption resin
1.2 实验方法
1.2.1 大孔树脂预处理 依照厂家说明书及相关文献[6]进行处理。
1.2.2 上样液制备 称取10g杜仲翅果干粉(石油醚脱脂脱胶处理,60℃烘干至恒重)置于圆底烧瓶中,加入120m L 72%(v/v)乙醇溶液,在超声波萃取器中以300W功率提取21m in,抽滤,减压浓缩,加水转溶,以4000r/m in转速离心10m in去除杂质,上清液即为上样液。
1.2.3 静态吸附-解吸实验
1.2.3.1 静态吸附实验 称取经预处理并吸干表面水分的不同型号湿树脂2g置于磨口锥形瓶中,精密加入过量已知浓度的桃叶珊瑚甙提取液,摇匀,密封,于4℃冰箱中放置24h[7],进行吸附,吸取上清液,测定桃叶珊瑚甙浓度,计算出各型号树脂对桃叶珊瑚甙的最大吸附容量,计算公式如下:
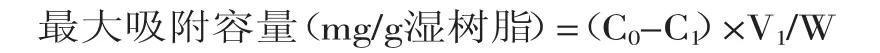
式中,C0为吸附前提取液中桃叶珊瑚甙浓度(mg/m L);C1吸附平衡时提取液中桃叶珊瑚甙浓度(mg/m L);V1为提取液体积(m L);W为湿树脂质量(g)。
1.2.3.2 静态解吸实验 分别将上述充分吸附了桃叶珊瑚甙的树脂进行过滤,再各加入70%(v/v)的乙醇溶液50m L,密封,于4℃冰箱中放置24h,进行解吸,吸取解吸液,测定桃叶珊瑚甙的浓度,计算出各型号树脂对桃叶珊瑚甙的解吸率,计算公式如下:
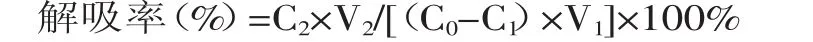
式中,C0为吸附前提取液中桃叶珊瑚甙浓度(mg/m L);C1吸附平衡时提取液中桃叶珊瑚甙浓度(mg/m L);C2解析后解析液中桃叶珊瑚甙浓度(mg/m L);V1为提取液体积(m L);V2为解吸液体积(m L)。
1.2.4 动态吸附-解吸实验
1.2.4.1 动态吸附实验 量取经预处理树脂20m L湿法装柱,吸取浓度4.57mg/m L的桃叶珊瑚甙粗提液上样,pH为5.3(原液pH),以2m L/m in的流速通过树脂柱,分部收集流出液(每管收集1BV),测定其中桃叶珊瑚甙浓度,绘制泄漏曲线,确定上样液用量。
湿法装柱,吸取5份40m L浓度4.57mg/m L的桃叶珊瑚甙粗提液,分别稀释至0.5、1、2、3、4mg/m L上样,pH为5.3(原液pH),流速2m L/min,用80m L蒸馏水水洗,混合液定容至250m L,测定桃叶珊瑚甙浓度,计算吸附率,考察不同上样液浓度对吸附效果的影响。
湿法装柱,吸取5份60m L浓度3mg/m L的桃叶珊瑚甙粗提液,pH为5.3(原液pH),分别以流速1、2、3、4、5m L/m in上样,用80m L蒸馏水水洗,混合液定容至250m L,测定桃叶珊瑚甙浓度,计算吸附率,考察不同上样速率对吸附效果的影响。
湿法装柱,吸取5份60m L浓度3mg/m L的桃叶珊瑚甙粗提液,分别调节pH至3、4、5、6、7、8上样,流速2m L/m in,用80m L蒸馏水水洗,混合液定容至250m L,测定桃叶珊瑚甙浓度,计算吸附率,考察不同上样液pH对吸附效果的影响。
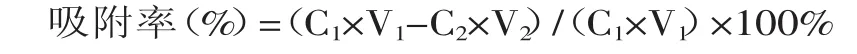
式中,C1-上样液中桃叶珊瑚甙浓度(mg/m L);C2-混合液中桃叶珊瑚甙浓度(mg/m L);V1-为上样液体积(m L);V2-为混合液体积(m L)。
1.2.4.2 动态解吸实验 取按最佳动态吸附条件吸附的树脂柱,用70%(v/v)的乙醇溶液以流速2m L/m in洗脱,分部收集洗脱液(每管收集1BV),测定其中桃叶珊瑚甙浓度,绘制洗脱曲线,确定洗脱剂液体用量。
取完成吸附的树脂柱,用浓度分别为40%、50%、60%、70%、80%(v/v)的乙醇溶液各120m L以流速2m L/m in洗脱,洗脱液定容至250m L,测定桃叶珊瑚甙浓度,计算洗脱率,考察不同洗脱剂浓度对解吸效果的影响。
取完成吸附的树脂柱,用50%(v/v)的乙醇溶液120m L分别以流速1、2、3、4、5m L/m in洗脱,洗脱液定容至250m L,测定桃叶珊瑚甙浓度,计算洗脱率,考察不同洗脱速率对解吸效果的影响。

式中,C1-上样液中桃叶珊瑚甙浓度(mg/m L);C2-混合液中桃叶珊瑚甙浓度(mg/m L);C3-洗脱液中桃叶珊瑚甙浓度(mg/m L);V1-为上样液体积(m L);V2-为混合液体积(m L);V3-为洗脱液体积(m L)。
1.2.5 桃叶珊瑚甙含量测定 参考文献[8]采用“对二甲氨基苯甲醛法”。
1.2.6 桃叶珊瑚甙定性分析 使用超高效液相色谱-飞行时间质谱联用仪以桃叶珊瑚甙标准品(SIGMA公司)定性。
1.2.6.1 色谱条件 色谱柱:ACQUITY UPLC BEH Shield RP18(100×2.1mm,1.7μm);检测器:质谱检测器;流动相:乙腈∶水(10mmol/L乙酸铵+0.1%氨水)= 10∶90;柱温:40℃;样品室温度:10℃;流速:0.3m L/m in;进样体积:1μL。
1.2.6.2 质谱条件 离子源:ESI;扫描方式:负离子V模式;扫描范围:m/z100~1000;毛细管电压:2500kV;锥孔电压:10V;毛细管温度:350℃;源温度:110℃;干燥气流速:600L/h;辅助气流速:40L/h。
1.2.7 精制品纯度计算 洗脱液旋蒸浓缩后冷冻干燥至恒重得桃叶珊瑚甙精制品,准确称取一定质量(m1)样品,用适量甲醇溶解定容后按1.2.5方法测定桃叶珊瑚甙含量(m2),计算样品纯度:
纯度(%)=m1/m2×100%
2 结果与讨论
2.1 大孔树脂对桃叶珊瑚甙的静态吸附和解吸效果
要取得较好的分离纯化效果,必须正确有效地选用树脂。从表2可以看出,相同条件下NKA-9、AB-8、DM 130、NKA、D4020等五种大孔树脂对桃叶珊瑚甙都有一定的吸附能力,其中NKA的最大吸附容量最大,但其解吸率较低,最终获得的桃叶珊瑚甙较少;D4020的最大吸附容量虽然不是最大的,但是其解吸率很高,最终获得的桃叶珊瑚甙最多。因此D4020对桃叶珊瑚甙具有良好的吸附与解吸能力,故确定D4020为桃叶珊瑚甙的分离纯化树脂。
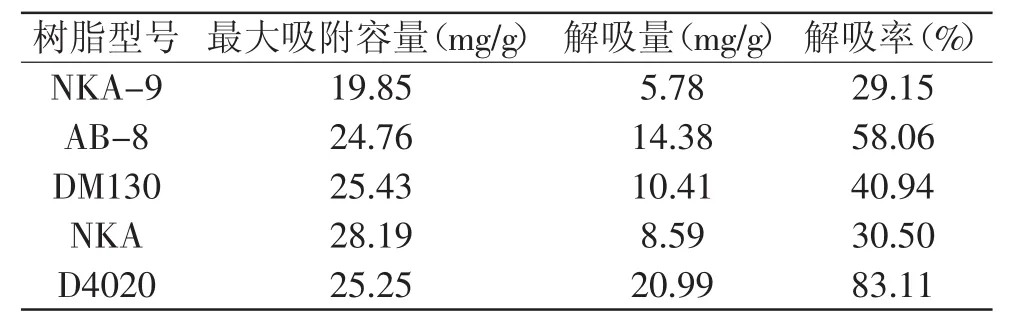
表2 树脂筛选实验的结果Table 2 Results of resin choice test
2.2 大孔树脂对桃叶珊瑚甙的动态吸附效果
2.2.1 泄漏曲线结果 由图1可知,随上样液用量的增加,流出液中桃叶珊瑚甙浓度逐渐增加,当上样液用量在2BV时,流出液中桃叶珊瑚甙浓度接近上样液浓度的1/10,即达到泄漏点,当上样液用量达到7BV时,流出液中桃叶珊瑚甙浓度已接近上样液浓度并不再增加,说明此时树脂对桃叶珊瑚甙的吸附已接近饱和。故浓度4.57mg/m L的上样液取2BV即40m L上样为宜。
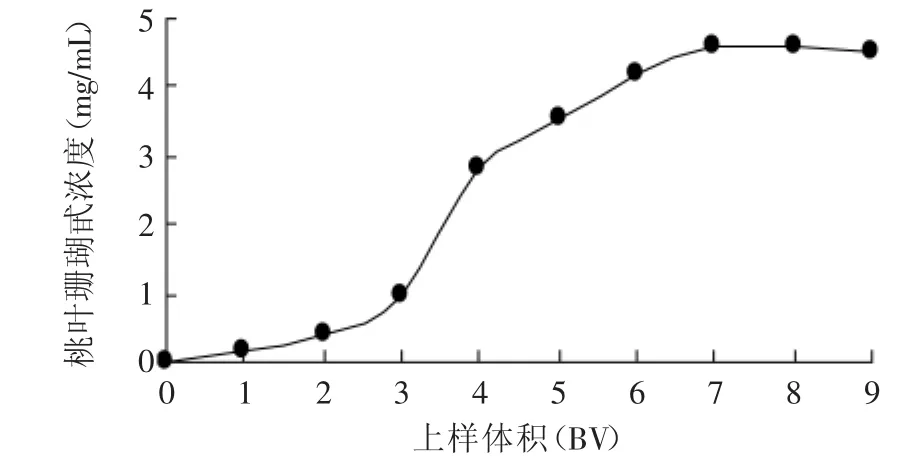
图1 吸附泄漏曲线Fig.1 The curve of adsorption leak
2.2.2 上样液浓度对吸附效果的影响 由图2可知,随着上样液浓度的提高,树脂吸附率逐渐升高,在达到3mg/m L后又略有下降。当浓度较高时,大孔树脂的吸附容量增加,但同时泄漏较多,造成了产品的浪费。故选择上样液浓度为3mg/m L,此浓度下上样液用量为60m L。
2.2.3 上样速率对吸附效果的影响 由图3可知,上样速率越低,树脂对桃叶珊瑚甙的吸附效果越好,吸附率越高,这是因为流速过快,部分产品与树脂的接触时间较短,来不及被树脂吸附便随上样液一同流出树脂柱。上样速率从2m L/min到1m L/min吸附率升高趋势不明显,虽然较低流速可以提高吸附率,但同时也会延长生产周期,故综合考虑吸附率和生产周期,选择上样速率为2m L/m in。
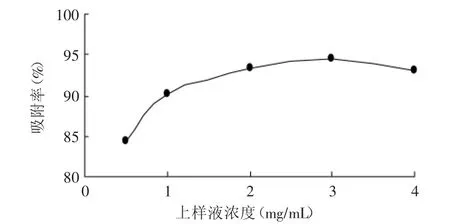
图2 上样液浓度对吸附率的影响Fig.2 Effectof sample concentration on adsorption percent
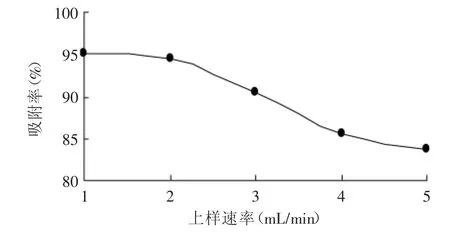
图3 上样速率对吸附率的影响Fig.3 Effectof velocity on adsorption percent
2.2.4 上样液pH对吸附效果影响 由图4可知,在中性环境中树脂对桃叶珊瑚甙的吸附率最大,酸性环境和碱性环境都使得树脂对桃叶珊瑚甙的吸附率急剧下降。这是由于桃叶珊瑚甙为一种糖苷,在酸性和碱性环境下均容易发生水解和结构的变化,其水解产物苷元具有缩醛结构,性质非常活泼,容易进一步分解或聚合,使其在溶液中的浓度降低,从而影响大孔吸附树脂的吸附[7]。故选择上样液pH为7。
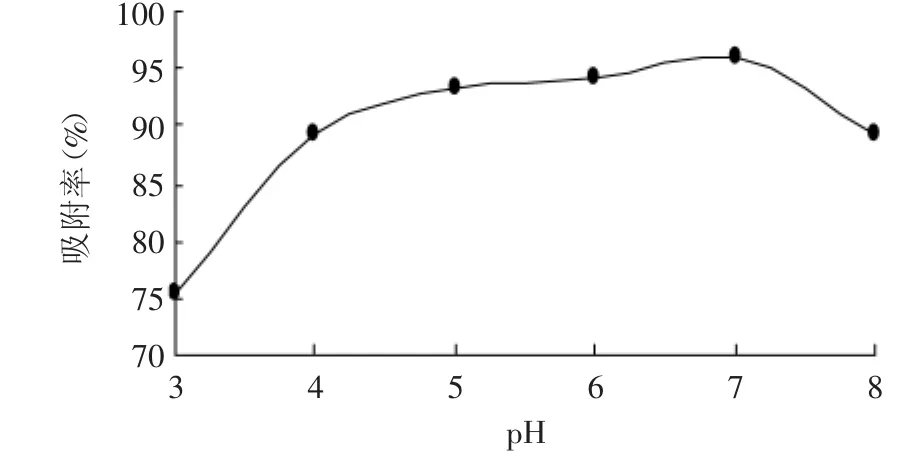
图4 pH对吸附率的影响Fig.4 Effectof pH on adsorption percent
2.3 大孔树脂对桃叶珊瑚甙的动态解吸效果
2.3.1 洗脱剂用量的确定 由图5可知,随着洗脱剂乙醇溶液用量的增加,桃叶珊瑚甙不断从树脂中洗脱下来。当洗脱剂的用量为6BV时,洗脱液中已基本不存在桃叶珊瑚甙。故从经济成本和操作时间考虑,选择6BV即120m L为洗脱剂用量。
2.3.2 洗脱剂浓度对洗脱效果的影响 由图6可知,洗脱剂浓度对树脂洗脱率的影响很大,根据“相似相溶”原理,不同浓度的乙醇溶液其极性不同,影响桃叶珊瑚甙与树脂之间的吸附作用使桃叶珊瑚甙从树脂上分离下来。根据图6所示,50%(v/v)的乙醇溶液的洗脱率最大,故选择洗脱剂乙醇的浓度为50%(v/v)。
2.3.3 洗脱速率对洗脱效果的影响 由图7可知,洗脱速率越慢,桃叶珊瑚甙的洗脱效果越好,洗脱率越高;洗脱速率快不利于桃叶珊瑚甙的洗脱,因为洗脱剂不能充分与被吸附的桃叶珊瑚甙发生作用而将其从树脂上洗脱出来。但是洗脱速率过低,将导致整个生产周期的延长,生产效率下降,综合考虑生产效率和产品产量,选择洗脱速率为2m L/m in。
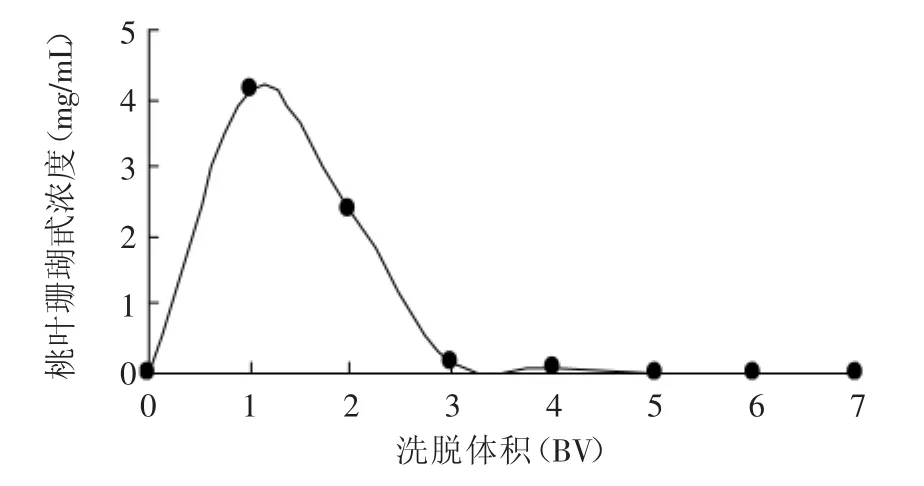
图5 洗脱曲线Fig.5 The curve of elution
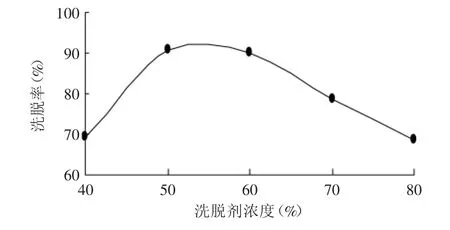
图6 洗脱剂浓度对洗脱率的影响Fig.6 Effectof eluent concentration on desorption percent
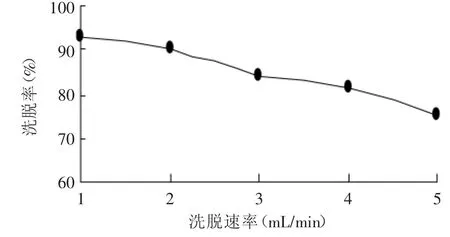
图7 洗脱速率对洗脱率的影响Fig.7 Effectofmoving velocity on desorption percent
2.4 定性分析结果
针对桃叶珊瑚甙的分子量将345.11的[M-H]-分子离子峰在质谱总离子流图中提取出来得到桃叶珊瑚甙精制品和桃叶珊瑚甙标准品的LC-MS谱图,见图8、图9。桃叶珊瑚甙精制品为D4020型大孔吸附树脂在上述最佳动态吸附-解吸条件下获得洗脱液减压浓缩并经冻干得到。保留时间tR=1.03m in的峰即为桃叶珊瑚甙。
2.5 纯度检测结果
桃叶珊瑚甙粗提液经D4020树脂纯化后,测得精制品纯度为62.54%,较纯化前的纯度19.71%有了较大的提高,说明D4020树脂对桃叶珊瑚甙的纯化效果较好,能大幅度提高提取物中的桃叶珊瑚甙含量。

图8 桃叶珊瑚甙精制品LC-MS谱图Fig.8 LC-MS chromatogram for refined sample

图9 桃叶珊瑚甙标准品LC-MS谱图Fig.9 LC-MS chromatogram for standard substance
3 结论
D4020树脂为最佳的分离纯化杜仲翅果桃叶珊瑚甙的树脂,其静态最大饱和吸附量为25.25mg/m L,静态解吸率为83.11%。D4020树脂分离纯化桃叶珊瑚甙的最佳工艺条件为:上样液浓度3mg/m L、上样液pH为7、上样速率2m L/min、洗脱剂选用50%(v/v)的乙醇溶液、用量120m L、洗脱速率2m L/m in。按照这一最佳工艺条件分离纯化,桃叶珊瑚甙精制品纯度由原来的19.71%提高到62.54%,取得了较好的效果。
[1]张康健,赵德义,董娟娥.风靡全球的杜仲健康新理念[M].西安:西北农林科技大学出版社,2005.
[2]LIHui,HU Jiangyu,OUYANGHui,etal.Extraction ofaucubin from seedsof Eucommia ulmoides Oliv.using supercritical carbon dioxide[J].JAOAC Int,2009,92(1):103-110.
[3]XUEHongyu,JIN Lei,JIN Liji,etal.Aucubin prevents loss of hippocampal neurons and regulates antioxidative activity in diabetic encephalopathy rats[J].Phytotherapy Research,2009,23(7):980-986.
[4]LIYang,ZHAO Ye,ZHANG Yongmin,et al.X-ray crystal structure of iridoid glucoside aucubin and its aglycone[J]. Carbohydrate Research,2009,344(16):2270-2273.
[5]李娜,鲁晓翔.大孔吸附树脂分离纯化红花总黄酮的研究[J].食品工业科技,2011,32(4):276-279.
[6]王育红,朱维军,潘治利,等.NKA-9大孔树脂对苹果多酚的动态吸附工艺优化[J].农业机械学报,2009,40(8):119-123.
[7]董娟娥,梁宗锁,张康健,等.大孔吸附树脂一次性分离杜仲叶中杜仲总苷和杜仲黄酮的研究[J].农业工程学报,2006,22(7):162-166.
[8]马龙,孙兰萍,许晖.杜仲翅果桃叶珊瑚甙抗氧化稳定性研究[J].食品科技,2011,36(3):203-205.
Study on separation and purification process of aucubin from Eucomm ia seeds by macroporous resins
MA Long1,ZHOU Xian-han2,XU Hui1
(1.Department of Biology and Food Engineering,Bengbu College,Bengbu 233030,China;2.Institute of Biology and Food Engineering,Hefei University of Technology,Hefei230009,China)
In order to obtain aucubin w ith high purity from Eucomm ia seeds,macroporous resin was used for purification.The adsorp tion and desorp tion rates of 5 types of macroporous resins towards aucubin were investigated.Among the mac roporous resins,D4020 resin was the most suitab le to purify aucubin.When 40m L of 3mg/m L and pH 7 sam p le was flowed through D4020 resin column at a speed of 2m L/m in,the adsorp tion reached dynam ic equilibrium.The adsorbed aucubin could be com p letely eluted w ith 120m L of 50%(v/v)ethanolat2m L/m in.The purity of aucubin could be 62.54%by refinement of the D4020 resin.
macroporous resin;adsorp tion;purification;Eucomm ia seeds;aucubin
TS201.1
B
1002-0306(2012)09-0249-04
2011-08-01
马龙(1979-),男,硕士,讲师,研究方向:农产品加工与贮藏工程。
安徽省高等学校省级食品科学与工程特色专业建设点资助项目(20101091);安徽省食品科学与工程教学团队项目(20101094)。

