顺铂诱导胃癌SGC-7901细胞凋亡作用及其对线粒体膜电位变化的研究
蔡先彬 胡辉 王钦加 荆绪斌
·论著·
顺铂诱导胃癌SGC-7901细胞凋亡作用及其对线粒体膜电位变化的研究
蔡先彬 胡辉 王钦加 荆绪斌
目的 研究线粒体膜电位在顺铂诱导胃癌细胞凋亡中的作用机制。方法 采用MTT比色法测定顺铂对胃癌SGC7901细胞的生长抑制曲线;将胃癌SGC7901细胞分成对照组及10 μg/ml顺铂组处理,用流式细胞仪(FCS)分别检测线粒体膜电位(Δψm)和分析细胞周期变化情况。结果 顺铂可明显抑制胃癌细胞增殖。在24 h后可见细胞大部分受阻于G1期,且出现了典型的凋亡峰;在10 h后线粒体膜电位明显降低。结论 顺铂诱导胃癌SGC-7901细胞凋亡的途径可能是通过使线粒体膜通透性的改变,膜电位的下降来而实现的。
线粒体膜电位;凋亡;胃癌;顺铂
顺铂是肿瘤化疗的常用药物。传统观点认为,顺铂能够引起细胞DNA交联,起肿瘤细胞毒性作用。近年随着分子生物学发展,有实验发现顺铂抗癌机制与肿瘤细胞凋亡存在密切关系[1,2]。研究发现顺铂可通过Fas死亡受体途径介导肿瘤细胞凋亡[3,4],而线粒体被认为是细胞凋亡的另一个重要途径。我们前期研究发现顺铂可诱导食管癌细胞凋亡,且是通过线粒体途径引发一系列凋亡程序来实现[5]。目前,顺铂作为胃癌临床常用化疗药物之一,其是否存在此类机制,相关的基础研究较少。为此,本研究通过体外实验来探讨在顺铂诱导胃癌SGC-7901细胞凋亡过程中线粒体变化情况,从而了解线粒体与胃癌细胞凋亡之间关系。这对于研究细胞凋亡的调控机制具有重要的理论意义,同时为临床肿瘤化疗用药提供实验依据。
1 材料和方法
1.1 主要药品和试剂 顺铂、噻唑蓝(MTT)、过氧化氢酶(CAT)、碘化丙啶(PI)和RNA酶购于Sigma公司;1640培养基购于Gibco公司;3,3'-Dihexyloracarbocyanine(DiOC6(3))分子探针购于美国Calbiochem公司。
1.2 细胞培养 人的胃癌细胞系SGC-7901被培养在含有10%的胎牛血清(FCS;Gibco)、100/ml青霉素(Gibco)和100 g/ml链霉素(Gibco)的RPMI1640的培养液中;培养条件为,37℃、5%CO2、饱和湿度孵箱中孵育。选用对数生长期细胞,加不同浓度的药物作用一定时间后进行实验。每次实验均分对照组(溶剂对照)和实验组,每个实验重复6次。
1.3 MTT比色法测定细胞生长抑制率 将细胞接种于96孔培养板中(100 μl每孔)24 h后弃上清,加入不同浓度的顺铂稀释液(0,1,5,10,15 μg/ml,100 μl每孔)。培养24 h后,加入MTT溶液(5 mg/ml,50 μl每孔)继续孵育4 h,终止培养。吸去上清液,加入150 μl DMSO,振荡溶解10 min。空白对照调零,选择490nm波长,在酶联免疫检测仪上测定各孔吸光度值(A值),按以下公式求生长抑制率。生长抑制率(%)= (1-实验组A值/对照组A值)×100%。计算IC50,作为用于检测线粒体膜电位及细胞周期时处理细胞的顺铂浓度。同时观察细胞用药前后生长情况并使用倒置相差显微镜拍照。
1.4 细胞周期分析及凋亡率的检测 将10 μg/ml顺铂处理24 h后的SGC-7901细胞,用胰蛋白酶消化,PBS洗2次,体积百分比为70%乙醇固定,4℃过夜。上机前收集离心细胞,PBS洗3次后用0.5 mg/ml RNase酶37℃作用1 h,50 μg/ml的PI染色30 min,上机检测。
1.5 Δψm的测定 DiOC6(3)是一种特异性膜电位标记的荧光染料,对膜具有通透性,其荧光信号主要集中于线粒体,其荧光强度的变化反映了Δψm的变化[6]。将10 μg/ml顺铂处理10 h后的SGC-7901细胞用胰蛋白酶消化,PBS洗涤2次,细胞重悬于500 μl PBS中,加入DiOC6(3)染液,避光染色30 min后用FACS检测细胞内线粒体荧光强度。
2 结果
2.1 顺铂抑制胃癌SGC-7901细胞生长,图1表明,对数生长期的细胞经顺铂处理后,导致细胞生长明显受到抑制,顺铂对胃癌SGC-7901细胞的抑制率呈浓度依赖关系。经过计算可求得线性回归方程y=4.732x+2.050,经计算IC50为10.13 μg/ml,约为10 μg/ml。
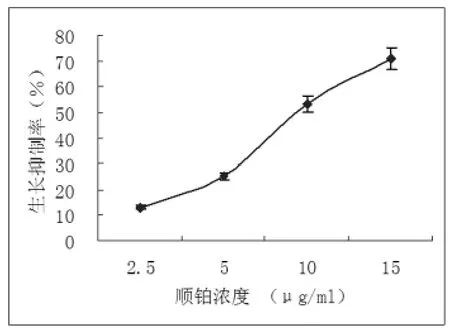
图1 顺铂的浓度-生长抑制曲线
图2表明体外培养胃癌SGC-7901细胞,倒置相差显微镜观察到细胞贴壁生长,状态良好。但在加入10 μg/ml浓度的顺铂处理后,细胞开始出现皱缩,伪足形成,细胞折光性差,模糊,随着剂量增加或时间延长甚至可见细胞呈“发芽”状改变,类似凋亡细胞形态改变,最终漂浮起来。但如果给予大剂量顺铂与细胞一起培养,我们可以看到大量细胞在短时间内缩小、脱落、漂浮,生产许多细胞碎片,可能形成细胞坏死。
2.2 FCS检测胃癌SGC-7901细胞凋亡率 表1显示顺铂作用于胃癌SGC-7901细胞后,其细胞周期时相发生显著变化,细胞大部分受阻于G1期,DNA合成下降,且出现了典型的凋亡峰。G1期:对照组为(51.36±2.59)%,顺铂组24 h后平均为(41.02±3.67)%;G2期:对照组为(33.53±1.79)%,顺铂组为(16.46±3.12)%;凋亡率:对照组为(2.31± 0.56)%,顺铂组为(30.26±2.21)%,两组比较差异有非常显著性。

图2 细胞生长48 h后已经生长至少融合约90%,生长良好,细胞紧密连接,可见细胞核在分裂增殖。
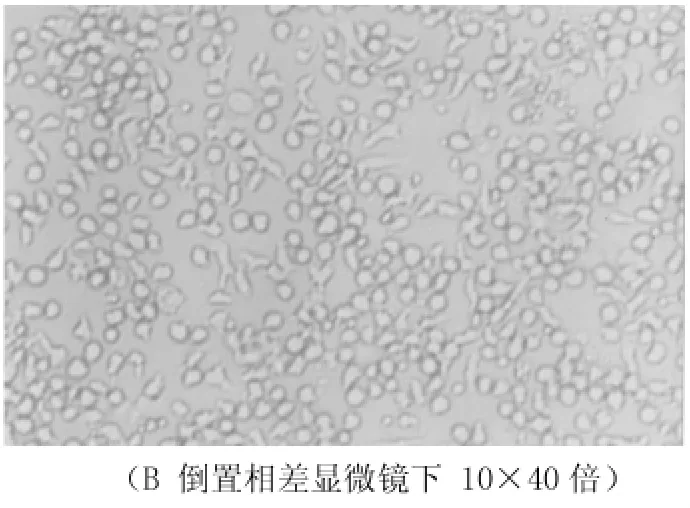
图3 DDP作用细胞24 h后形态学改变,细胞变圆,细胞连接松散,细胞核裂解。
表1 不同处理组对胃癌SGC-7901细胞周期和凋亡率的影响(±s,%)

表1 不同处理组对胃癌SGC-7901细胞周期和凋亡率的影响(±s,%)
注:与对照组比较*P<0.01
组别 例数 G0/G1 S G2/M 凋亡率对照组 6 51.36±2.59 12.11±3.31 33.53±1.79 2.31±0.56顺铂组 6 41.02±3.67 11.52±2.26 16.46±3.12* 30.26±2.21*
2.3 FCS检测胃癌SGC-7901细胞Δψm改变的结果 线粒体是凋亡信号传导通路中一个关键环节,用DiOC6(3)荧光探针标记的细胞经FCS检测,可按一定标尺分成两群细胞:荧光强度低(Δψmlow)的细胞和荧光强度高的细胞(Δψmhing)。顺铂处理过的胃癌SGC-7901细胞用FACS检测Δψm时,发现荧光强度高的细胞明显减少,由对照组的(94.51± 2.10)%下降至(59.54±3.25)%,即线粒体膜电位明显下降(图4),P<0.01。
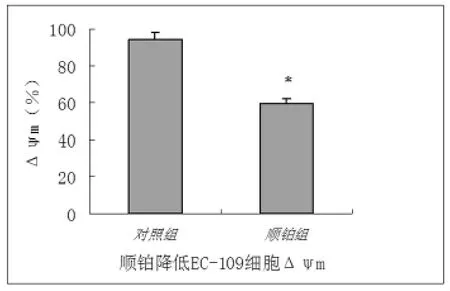
图4
3 讨论
细胞凋亡是真核细胞最基本的生命过程之一,本质上是一种编程性细胞死亡。研究表明[7],在肿瘤组织中普遍存在细胞凋亡,它与肿瘤发生、发展与退化密切相关,现已明确大多数抗肿瘤药物都能诱导敏感肿瘤细胞凋亡。本实验通过MTT比色分析法观察到,顺铂对胃癌SGC-7901细胞的增殖有很强的抑制作用。细胞凋亡的一个重要的生物化学特征就是DNA的片段化。这是由于内源性的核酸内切酶活化降解DNA,使细胞DNA含量及细胞周期时相分布发生改变。将SGC-7901细胞经过药物处理之后进行流式细胞仪检测,证实该药能够引起明显的细胞周期阻滞,G1期细胞显著增多,在正常的G0/G1峰之前出现特异的亚二倍体峰,其峰值为(30.26±2.21)%,明显高于肿瘤细胞的自发凋亡。
近年研究表明,线粒体在细胞凋亡过程中既是引发器,也是信号放大器,是细胞凋亡过程中的中心环节[8]。线粒体跨膜电位(Δψm)与线粒体通透性改变在细胞凋亡过程中起着重要作用,而Δψm下降是细胞凋亡级联反应中的较早事件,而一旦线粒体Δψm耗散,细胞就会进入不可逆的凋亡过程。在细胞凋亡过程中线粒体Δψm耗散主要是由于线粒体通透性转换孔(-040)调节。-040关闭能防止细胞凋亡;在-040开放时线粒体释放细胞凋亡诱导因子,造成线粒体膜电位和生物合成破坏,细胞的能量代谢受损,氧化呼吸链解偶联,基质渗透压升高,线粒体体积扩大,外膜破裂可溶性膜间蛋白,包括cytoC释放,激发胞质半胱氨酸蛋白酶的连锁反应,从而激活核酸内切酶蛋白酶,从而启动了凋亡[9]。因此能够引起线粒体诱导MPTP开放的物质,都有可能引起细胞凋亡。为了更进一步了解顺铂诱导胃癌SGC-7901细胞凋亡过程中线粒体变化情况,本研究利用流式细胞仪检测细胞线粒体跨膜电位。结果显示CDDP作用12 h后细胞内的Δψm明显下降。
因此我们认为,顺铂可能是通过使胃癌SGC-7901细胞线粒体膜上的MPTP开放,线粒体释放凋亡诱导因子造成的线粒体膜电位和生物合成的破坏,而促进凋亡。这阐明了顺铂在抗肿瘤过程中,参与了线粒体调控,破坏线粒体功能,达到抑制胃癌细胞生长,为肿瘤化疗治疗提供一定的理论依据。
[1] Gangduo W,Eddie R,Qingdi L,et al.Molecular basis of cellular response to cisplatin chemotherapy in non-small cell lung cancer. Oncology Reports,June,2004,12:955-965.
[2] Fuertes M A,Castilla J,Alonso C,et al.Cisplatin Biochemical Mechanism of Action:From Cytotoxicity to Induction of Cell Death Through Interconnections Between Apoptotic and Necrotic Pathways.Current Medicinal Chemistry,Feb,2003,10(3):257-266 (10).
[3] Huang CR,Jin ZX,Dong L,et al.Cisplatin augments FAS-mediated apoptosis through lipid rafts.Anticancer Res.Jun,2010,30 (6):2065-2071.
[4] Xu L,Qu XJ,Liu YP,et al.Cisplatin enhances TRAIL-induced apoptosis in gastric cancer cells through clustering death receptor 4 into lipid rafts.Zhonghua Zhong Liu Za Zhi.Jul,2011,33(7): 484-488.
[5] Jing XB,Cai XB,Hu H.Reactive oxygen species and mitochondrial membrane potential are modulated during CDDP-induced apoptosis in EC-109 cells.Biochem Cell Biol,2007,85(2):265-271.
[6] Chang HF,Huang WT,Chen HJ,et al.Apoptotic effects of γmangostin from the fruit hull of Garcinia mangostana on human malignant glioma cells.Molecules.Dec,2010,15(12):8953-8966.
[7] Wong RS.Apoptosis in cancer:from pathogenesis to treatment.J Exp Clin Cancer Res.Sep,2011,30(1):87.
[8] Pradelli LA,Bénéteau M,Ricci JE,et al.Mitochondrial control of caspase-dependent and-independent cell death.Cell Mol Life Sci. May,2010,67(10):1589-1597.
[9] Bensassi F,Gallerne C,Dein OS,et al.Mechanism of Alternariol monomethyl ether-induced mitochondrial apoptosis in human colon carcinoma cells.Toxicology.Dec,2011,290(2-3):231-241.
The study on mitochondrial transmembrane potential variation and apoptosis in gastric carcinoma SGC-7901 cell line induced by the cisplatin
CAI Xian-bin,HU Hui,WANG Qin-jia,et al.Department of Gastroen-terology,The First Affiliated Hospital,Shantou university,Medical College,Shantou 515041,China
ObjectiveTo study the role of mitochondrial transmembrane potential in the cisplatin-induced apoptosis of the gastric carcinoma SGC-7901 cell lines.MethodsMTT assay was used to evaluate the influence of cisplatin on proliferation of cells.The SGC-7901 cells were treated by 0,10 μg/ml cisplatin.Flow cytometry was used to test the hypodiploid and intracellular mitochondrial transmembrane potential(Δψm)in cells.ResultsThe cisplatin could suppress proliferation of SGC-7901 cell lines.Δψm decreased evidently after treated by cisplatin for 10 hours.Most SGC-7901 cells were held in G1 period and a Sub-G1 peak(apoptosis peak)could be observed after the addition of the cisplatin for 24 hours.ConclusionThe cisplatin may disable mitochondrial biological function and decreased Δψm,which led to apoptosis of gastric carcinoma cells.
Mitochondrial transmembrane potential;Apoptosis;Gastric carcinoma;Cisplatin
515041汕头大学医学院第一附属医院消化内科
蔡先彬 E-mail:cxbin1@qq.com

