鲢鱼蛋白酶法水解产物的功能性质
陈志军,李向红,刘永乐*,俞 健,王发祥,王建辉
(长沙理工大学化学与生物工程学院,湖南 长沙 410014)
鲢鱼蛋白酶法水解产物的功能性质
陈志军,李向红,刘永乐*,俞 健,王发祥,王建辉
(长沙理工大学化学与生物工程学院,湖南 长沙 410014)
采用复合蛋白酶对酸法提取的鲢鱼蛋白进行水解改性。以水解鲢鱼蛋白为原料,与未酶解的鲢鱼蛋白作对照,考察其溶解性、起泡性、乳化性、持水性油性及流变学特性。结果表明:经酶解后的鲢鱼蛋白在pH2~10的范围内溶解度均在90%以上,较未酶解蛋白有明显的改善;起泡性增加不明显,仅为1.85%,泡沫稳定性延长了60min;乳化性是未酶解蛋白的8倍,乳化稳定性增加;持水、持油性降低,黏度减小。该酶法水解对鲢鱼蛋白质的部分功能性质有一定的改善效果。
鲢鱼;蛋白质;复合蛋白酶;溶解性
鱼类蛋白质氨基酸组成及比值与人体所需的氨基酸成分接近,营养丰富,是优质动物蛋白的重要来源。许多研究表明,蛋白质酶解有助于改善其营养价值和功能特性,更有利于人体吸收[1-3]。水解改性后使蛋白质分子质量降到一个适当的范围,分子空间构象发生改变,可获得表面活性较为理想的水解蛋白[4]。但利用酶解技术进行蛋白高值化多集中在海产低值鱼,而我国淡水资源丰富,特别是最重要的四大淡水鱼之一——鲢鱼,产量最高,其蛋白质含量最高可达到26.6%,但鲢鱼肉质粗糙,口感欠佳,因此,鲢鱼是水解鱼肉蛋白的首选。
本实验以复合蛋白酶水解鲢鱼蛋白粉为原料,对其溶解性、乳化性、起泡性、持水持油性的功能性质进行较为系统的研究,并与未酶解的鲢鱼蛋白作对照,为水解鲢鱼蛋白在食品中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
鲢鱼蛋白 实验室自制[5]。
复合蛋白酶、三硝基苯磺酸(TNBS) 美国Sigma公司;标准牛血清白蛋白 上海泽龙生物工程有限公司;其他试剂均为分析纯。
1.2 仪器与设备
UV-2100型紫外分光光度计 上海舜宇恒平科学仪器有限公司;TA-XT2i质构分析仪 波通瑞华科学仪器(北京)有限公司;DS-1高速组织捣碎机 上海标本模型厂;FD-1真空冷冻干燥机 北京博医康实验仪器有限公司。
1.3 方法
1.3.1 常规成分的测定
蛋白质的测定:参照GB 5511—1985《粮食、油料检验 粗蛋白质测定法》中的凯氏定氮法,氮换算为蛋白质的系数为7.24[6];水分的测定:参照GB 5009.3—2010《食品中水分的测定》中的105℃恒重法;灰分的测定:参照GB 5505—1985《粮食、油料检验 灰分测定法》中的干法灰化法;脂肪的测定:参照GB/T 14772—2008《食品中粗脂肪的测定》中的索氏抽提法。
1.3.2 鲢鱼蛋白酶解物的制备
碱溶酸沉法提取的鲢鱼蛋白配制成质量浓度为3g/100mL的溶液,调节pH值至7.0,加复合蛋白酶2400U/g pro,55℃恒温酶解50min,用1mol/L的盐酸或1mol/L的氢氧化钠溶液调节pH值,然后于100℃水浴灭酶10min,5000r/min离心20min,取上清液浓缩,冷冻干燥备用[7-9]。
1.3.3 蛋白质的溶解性
通常用氮溶解指数(nitrogen solubility index,NSI)来评价。准确称取0.2g(精确到0.001g)蛋白样品与20mL去离子水混合,用1mol/L HCl或1mol/L NaOH溶液调节溶液pH值(2、4、6、8、10),回旋振荡1h后,再分别取0.5mL,采用Folin-酚法在500nm波长处测定其吸光度,并比较其大小[10-11]。
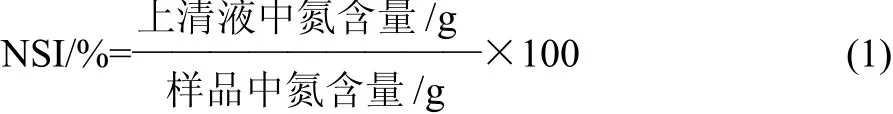
1.3.4 起泡性和泡沫稳定性
精确称取2.00g酶解前后样品溶于200mL的蒸馏水中,10000r/min分散1min,量取起始泡沫体积,记录均质停止后10、30、60、90min时的泡沫体积,用以衡量泡沫稳定性[12]。

1.3.5 乳化性和乳化稳定性
乳化性(emulsifying activity index,EAI)和乳化稳定性(emulsion stability index,ESI)测定,取30mL 0.2g/100mL酶解前后样品溶液,加入10mL大豆色拉油,10000r/min分散1min,立即用移液枪于容器底部取样50μL,用0.1% SDS溶液稀释100倍,混匀后在波长500nm处测定吸光度,以SDS溶液作空白[13]。室温放置10min后再次取样测定。

式中:n为稀释倍数;A为乳化液的吸光度;ρ为样品质量浓度/(g/mL);φ为乳化液中油相的比例,为0.25。

式中:A0为初始乳化液的吸光度;A10min为10min后乳化液的吸光度。
1.3.6 持水性、持油性
持水性(water holdingcapacity,WHC)以每克样品吸附水的体积表示。持油性(oil holding capacity,OHC)以每克样品吸附油的体积表示。
准确称取0.5g样品(精确到0.001)与20mL去离子水或者10mL大豆油于离心管中混匀,室温条件下静置30min,于8000r/min条件下离心30min,测定上清液体积,体积减少量即为样品吸水量或吸油量[14-15]。
1.3.7 流变学特性
黏度-剪切速率:固定应变1%,剪切速率为0~100s-1,测定整个过程样品黏度随频率的变化曲线。配制质量浓度为15g/100mL的鲢鱼蛋白溶液,在90℃水浴保温30min,以未酶解鲢鱼蛋白做对照。将配制好的样品加于流变仪底部平板上,选择直径40mm、0°的平板并设定狭缝距离为1mm,让板间完全充满样品,平板顶部涂上一薄层硅油以防止样品水分蒸发,测定温度恒定为(25±0.1)℃[16]。
2 结果与分析
2.1 原料鲢鱼蛋白的基本成分

表1 提取后鲢鱼蛋白的成分分析Table 1 Analysis of protein components extracted from silver carp
由表1可见,采用碱溶酸沉法制备的鲢鱼蛋白的蛋白含量(以干基计)达到了87.15%,其他杂质、水分及灰分含量依次降低,其中灰分及其他杂质主要是调节pH值时产生的盐分;在提取过程中部分脂肪由于不能溶解而被除去。
2.2 可溶性鱼蛋白功能性质测定
2.2.1 不同pH值条件下的溶解性
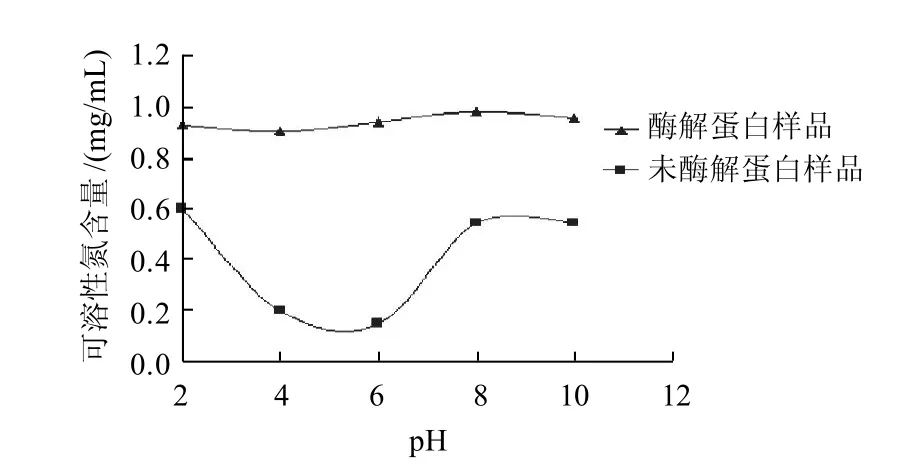
图1 鲢鱼蛋白酶解前后不同pH值条件下的溶解性Fig.1 The solubility of silver carp protein under different pH conditions before and after enzymatic hydrolysis
如图1所示,酶解后的鲢鱼蛋白在pH2~10的范围内溶解度均远远大于未酶解的鲢鱼蛋白,pH5左右时两种样品的溶解度都出现不同程度的降低,这与鱼肌肉蛋白的等电点在pH5左右有关,当pH值接近等电点时,蛋白质分子所带净电荷量最小,与水分子相互作用最弱,而蛋白质分子间相互靠近发生聚集,使其溶解性下降。但经酶解后鲢鱼蛋白在等电点附近溶解度的下降并不明显,溶解性对溶液pH值的依赖性降低。蛋白质在蛋白酶的作用下多肽链被切断,分子质量降低,暴露在外的极性基团如NH3+、COO-数目增加,疏水基团相对减少,亲水性提高,因而酶解后蛋白质的溶解性得到提高。
2.2.2 酶解前后起泡性和泡沫稳定性的比较
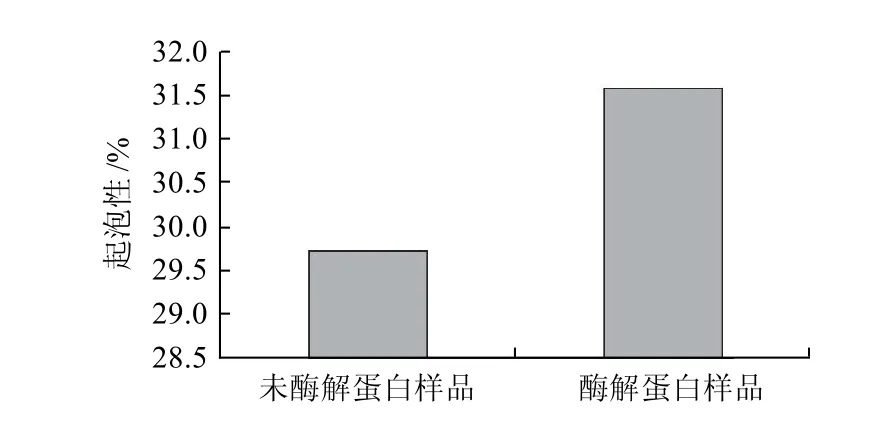
图2 鲢鱼蛋白酶解前后的起泡性Fig.2 Foaming ability of silver carp protein before and after enzymatic hydrolysis
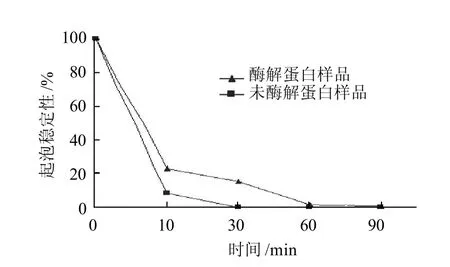
图3 鲢鱼蛋白酶解前后的起泡稳定性Fig.3 Foaming stability of silver carp protein before and after enzymatic hydrolysis
蛋白形成稳定的泡沫应该是溶于水,能够在液-气界面容易浓缩,蛋白质的结构是疏水、柔顺、无序的。由图2、3可知,酶解之后鲢鱼蛋白相比未酶解蛋白起泡性仅提高了1.85%,增加并不明显;酶解前后鲢鱼蛋白的泡沫量均在10min内大幅下降,在30min时未酶解蛋白的泡沫稳定性降为0,而经酶水解的蛋白在90min时才降到1%以下,可见酶解后蛋白的泡沫稳定性稍优于未酶解的蛋白。这是因为良好的溶解性是蛋白质溶液形成稳定泡沫的基础,酶解后蛋白质的溶解性提高,适度的水解有利于疏水基团的暴露有利于多肽链的交联增加,形成足够黏度和强度的黏层,使泡沫的稳定性增加。但若是蛋白水解度过大会使多肽过度交联,泡沫层的弹力减弱,导致泡沫塌陷,起泡性和泡沫稳定性都会下降。因此要得到起泡性良好且泡沫较为稳定的水解蛋白势必要适当控制水解度,使溶解性、疏水性及黏度达到一个平衡点。
2.2.3 酶解前后的乳化性及乳化稳定性

图4 鲢鱼蛋白酶解前后的乳化性Fig.4 EAI of silver carp protein before and after enzymatic hydrolysis
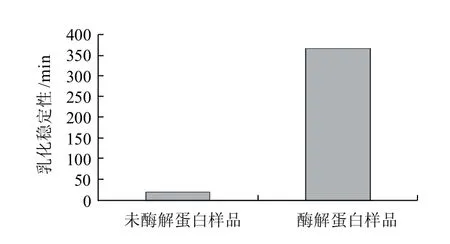
图5 鲢鱼蛋白酶解前后的乳化稳定性Fig.5 ESI of silver carp protein before and after enzymatic hydrolysis
一般来说,蛋白质的溶解度越高就越容易形成良好的乳状液。酶解后鲢鱼蛋白质有良好的亲水性,更适宜乳化成油/水(O/W)型乳状液。由图4、5可知,酶解前后鲢鱼蛋白质的EAI和ESI变化:酶解后鲢鱼蛋白的乳化性是未酶解蛋白的近8倍,乳状液的稳定时间也大幅延长。酶水解后蛋白的乳化活性高于未酶解蛋白是由于蛋白质的适度降解使其溶解度增大,更易于在油/水界面上扩散并定位,因而能乳化能力增强;同时,多肽链结构解离和伸展开来,使部分疏水基团暴露在分子表面,形成的乳液微粒直径小,排列更为有序,降低了界面张力,从而使形成的乳浊液系统较为稳定。
2.2.4 酶解前后的持水性和持油性

图6 鲢鱼蛋白质酶解前后持水性和持油性Fig.6 WHC and OHC of silver carp protein before and after enzymatic hydrolysis
由图6可知,鲢鱼蛋白未经酶水解时的持水性为1.5mL/g,而酶解后的鲢鱼蛋白完全溶于水中,无法计算持水性确切数值;鲢鱼蛋白经酶解后持油性从2.0mL/g降至1.2mL/g,下降了40%。蛋白质的持水持油性属于物理截持,鲢鱼蛋白因酶水解作用使得蛋白质的二级结构被破坏,多肽链切断成小分子的短肽,疏水基团减少,亲水基团增多,从而使酶解后的鱼肽蛋白的持水、持油性减小。
2.2.5 流变性的测定结果

图7 酶解前后不同剪切速率条件下的黏度大小Fig.7 Viscosity of silver protein before and after enzymatic hydrolysis under different shear rates
如图7所示,酶解前后鱼蛋白在不同剪切速率之下的黏度都非常小,但未酶解的蛋白样品黏度大于酶解后的样品黏度;随着剪切速率的不断增大,酶解前后鲢鱼蛋白的黏度先是急剧下降,当剪切速率达到40s-1后变化不再明显。酶水解后鲢鱼蛋白的黏度降低与肽链的长度减小有关,较长的肽链在水溶液中解开和伸展,水合程度高,表观黏度相对较大,而在酶的作用下多肽链被切断,肽链的交联和相互作用随之减小,鱼蛋白溶液的黏度相应下降。
3 结 论
本研究以实验室自制的鲢鱼蛋白为原料,采用复合蛋白酶进行水解,并对酶解前后蛋白质的一系列功能性质进行研究。结果表明,水解后的蛋白质因分子质量降低,疏水基团相对减少,亲水性提高,使其溶解度在广泛的pH值范围内(包括其等电点)较未酶解的蛋白均有较大的提高的;乳化性、乳化稳定性增加;酶解前后起泡性及泡沫稳定性的增加不明显,持水、持油性降低,黏度减小,这主要是由于水解过度过大使得肽链的交联和相互作用减小,因此要根据特定目标产物的用途选择适当的水解度,从而达到功能性质的最优化。
[1] 师晓栋, 何海伦, 王运涛, 等. 酶法进行海洋低值蛋白资源高值化利用初探[J]. 海洋科学, 2001, 25(3): 4-7.
[2] 陈季旺, 夏文水, 胡畔, 等. 鱼肽的酶法制备工艺及其特性的研究[J].食品科学, 2007, 28(6): 218-223.
[3] 郭浩楠, 杨荣华, 袁晓晴, 等. 鲢鱼蛋白的酶解及其酶解物功能性质的研究[J]. 中国食品学报, 2010, 10(4): 107-111.
[4] CHALAMAIAH M, NARSING RAO G, RAO D G, et al. Protein hydrolysates from meriga (Cirrhinus mrigala) egg and evaluation of their functional properties[J]. Food Chemistry, 2010, 120(3): 652-657.
[5] 江志炜, 沈蓓英, 潘秋琴. 蛋白质加工技术[M]. 北京: 化学工业出版社, 2002: 186-187.
[6] 鲁健章, 孙丽华, 周彦钢. 凯氏定氮法测定鱼蛋白质含量的干扰因素分析[J]. 食品科学, 2010, 31(19): 453-456.
[7] 施文正, 汪之和, 吴翼东, 等. 酶法制备鲢鱼蛋白[J]. 上海水产大学学报, 2004, 13(2): 151-156.
[8] 涂宗财, 汪菁琴, 李金林, 等. 影响淡水鱼液化成鱼蛋白的因素研究[J]. 食品工业科技, 2005, 26(6): 116-120.
[9] 陈彦, 王明蓉, 沈洁. 低值鱼蛋白的酸酶复合水解工艺研究[J]. 食品科学, 2006, 27(8): 200-204.
[10] PACHECO-AGUILAR R, MAZORRA-MANZANO M A, RAMIREZSUAREZ J C. Functional properties of fish protein hydrolysates from Pacific whiting (Merluccius productus) muscle produced by a commercial protease[J]. Food Chemistry, 2008, 109(4): 782-789.
[11] 武贤壮. 鲢鱼肉蛋白的酶解及产物特性研究[D]. 武汉: 华中农业大学, 2009.
[12] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins: evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry, 1978, 26(3): 716-723.
[13] 邓尚贵, 彭志英, 杨萍, 等. 青鳞鱼蛋白复合酶控制水解物功能特性的研究[J]. 湛江海洋大学学报, 2005, 25(3): 13-18.
[14] RAWDKUEN S, SAI-UT S, KHAMSORN S, et al. Biochemical and gelling properties of tilapia surimi and protein recovered using an acidalkaline process[J]. Food Chemistry, 2009, 112(1): 112-119.
[15] WASSWA J, TANG Jian, GU Xiaohong, et al. Influence of the extent of enzymatic hydrolysis on the functional properties of protein hydrolysate from grass carp (Ctenopharyngodon idella) skin[J]. Food Chemistry, 2007, 104(4): 1698-1704.
[16] 杨东, 王慥. 水解鱼蛋白及其功能特性的研究[J]. 食品科学, 1999, 20(11): 23-26.
Functional Properties of Enzymatically Modified Silver Carp Protein
CHEN Zhi-jun,LI Xiang-hong,LIU Yong-le*,YU Jian,WANG Fa-xiang,WANG Jian-hui
(School of Chemistry and Biological Engineering, Changsha University of Science and Technology, Changsha 410014, China)
Functional properties of protein hydrolysates from silver carp were studied through comparison with unhydrolyzed protein. The silver carp protein was hydrolyzed by complex protease. The results showed that after enzymatic hydrolysis, the solubility of silver carp protein was more than 90% in the pH range of pH 2-10, which was significantly higher than that of non-enzymatic hydrolyzed protein. The foaming did not exhibit obvious change, which was only 1.85%. The foam stability was extended by 60 min. The emulsifying capability was 8 fold as many as that of non-enzymatic hydrolyzed protein. Meanwhile, emulsion stability also increased. However, water-binding capacity and oil-binding capacity as well as the viscosity of hydrolysates reduced. The results indicated that enzymatic hydrolysis of protein in silver carp by complex protease could improve the functional properties, which will have practical application.
silver;protein;complex protease;solubility
TS254.1
A
1002-6630(2012)05-0062-04
2011-09-30
湖南省科技重大专项(2010FJ1007)
陈志军(1986—),女,硕士研究生,研究方向为食品科学。E-mail:chen_claire@163.com
*通信作者:刘永乐(1962—),男,教授,博士,研究方向为大宗农产品加工技术。E-mail:lyle19@163.com

