软枣猕猴桃多聚半乳糖醛酸酶提取条件的优化
刘 月,李书倩,张 博,刘长江,辛 广,,*
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.鞍山师范学院化学系,辽宁 鞍山 114007)
软枣猕猴桃多聚半乳糖醛酸酶提取条件的优化
刘 月1,2,李书倩1,2,张 博2,刘长江1,辛 广2,1,*
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.鞍山师范学院化学系,辽宁 鞍山 114007)
以软枣猕猴桃为实验材料,确定多聚半乳糖醛酸酶最优提取条件和最适活性分析条件。在提取过程中,以酶比活力为指标确定缓冲液的最适pH值、离子浓度、DTT添加量对PG提取效果的影响,通过正交试验确定最佳提取条件。结果表明:最优提取条件为pH5.5、0.05mol/L 乙酸缓冲液为提取液,加入0.1mol/L NaCl、1mmol/L DTT;最适活性分析条件为反应温度40℃、反应时间90min。
软枣猕猴桃;多聚半乳糖醛酸酶;提取;活性分析
软枣猕猴桃(Actinidia argutaSieb.et Zuec.),又名软枣子、猕猴梨、藤瓜,属于猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia)多年生落叶藤本植物[1]。软枣猕猴桃果实翠绿,清香爽口,柔软多汁,尤其富含VC,其含量高达450mg/100g,是苹果、梨的80~100倍。果实中还含有VB、氨基酸、类胡萝卜素及镁、铁、钾、钠等多种营养成分,具有滋补强身、生津润肺等作用,对高血压、心绞痛、高血脂等有一定疗效[2]。软枣猕猴桃具有营养丰富、医疗效能和观赏价值的同时具有不耐贮藏的致命弱点,极易软化,使其开发利用受到极大限制[1]。20世纪60年代初Hobson指出多聚半乳糖醛酸酶(polygalacturonase EC 3.2.1.15,PG)与番茄果实软化密切相关,后研究证明该酶是一种细胞壁蛋白[3-8],它可以催化果胶分子中α-(1,4)-聚半乳糖醛酸的裂解,伴随着植物发育的许多阶段,参与果胶的降解,与果实的软化、脱落和种子成熟及植物组织的抗病性有关[9-12]。杨德兴等[13]认为在果实后熟过程中,随着PG活性不断提高,原果胶逐步降解为可溶性果胶,细胞结构受损,果肉硬度下降,导致果实软化。因此研究软枣猕猴桃PG的性质,进一步了解其软化机理,抑制或减缓其果肉组织中PG活性的提高,可增强果实抵御外界不良因素的能力和耐藏性,延长其货架寿命。同时为软枣猕猴桃贮藏保鲜及加工技术的研究提供了理论依据。
1 材料与方法
1.1 材料与试剂
软枣猕猴桃采摘于2010.9.2鞍山千山,硬度2.44(kg/cm2),可溶性固形物含量9.72%;95%乙醇、无水乙酸钠、冰乙酸均为分析纯;多聚半乳糖醛酸、考马斯亮蓝G-250、牛血清蛋白、3,5-二硝基水杨酸(DNS)。
1.2 仪器与设备
CR22E冷冻离心机 日本Hitachi公司;UV-2450紫外可见分光光度计 日本岛津公司;BS124S 电子天平赛多利斯科学仪器(北京)有限公司;PHS-2C型数显pH计 上海智光仪器仪表有限公司;Eppendorf 移液器 德国普兰德公司。
1.3 方法
1.3.1 PG提取
称取10g软枣猕猴桃置于经预冷的研钵中,用液氮研磨成粉末,加入20mL经预冷的95%乙醇,研磨匀浆后,全部转入离心管中,低温放置10min,经4℃、12000r/min离心20min。倾去上清液,向沉淀物中再加入10mL经预冷的80%乙醇,振荡,低温放置10min,然后在相同条件下离心。再倾去上清液,向沉淀物中加入5mL经预冷的乙酸缓冲液(内含0.1mol/L NaCl、1.0mmol/L DTT),于4℃放置提取1h,再经过离心后收集上清液即为粗酶提液,4℃保存备用[14-16]。
1.3.2 PG活性测定
采用DNS比色法[16-18]测定PG活力。取2支25mL具塞刻度试管,编号0、1,每支试管中都分别加入1.0mL(50mmol/L、pH5.5)乙酸-乙酸钠缓冲液和0.2mL(10g/L) 多聚半乳糖醛酸溶液。再往1号试管中加入0.2mL酶提取液,0号试管作为空白对照,混匀后置于40℃水浴中保温1.5h。保温后,迅速加入1.5mL 3,5-二硝基水杨酸试剂(DNS),向0号试管中加入0.2mL酶提取液,摇匀,在沸水浴中加热5min。然后迅速冷却至室温,以蒸馏水稀释至25mL刻度处,混匀。在540nm波长处,用0号试管作为参比调零,测定1号试管中溶液的吸光度。重复3次。
1个酶活力单位定义:以每小时每克软枣猕猴桃在40℃催化多聚半乳糖醛酸水解生成1mg半乳糖醛酸的质量表示,即1U=1mg/(h·g)。
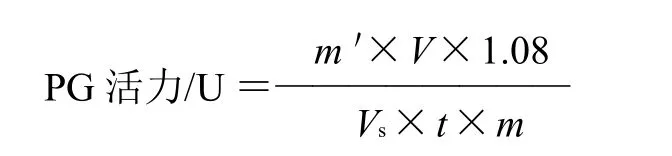
式中:m'为从标准曲线查得的葡萄糖质量/mg;V为样品提取液总体积/mL;Vs为测定时所取样品提取液体积/mL;t为酶促反应时间/h;m为样品质量/g;1.08为葡萄糖换算成半乳糖醛酸的系数(取值194/180)。
1.3.3 蛋白质含量测定
参照Bradford等[19]的方法,以牛血清白蛋白为标准。吸取1.0mL样品提取上清液(视蛋白质含量适当稀释),放入具塞试管中,加入5.0mL考马斯亮蓝G-250溶液,充分混合,放置5min后在波长595nm处比色,测定吸光度。重复3次。
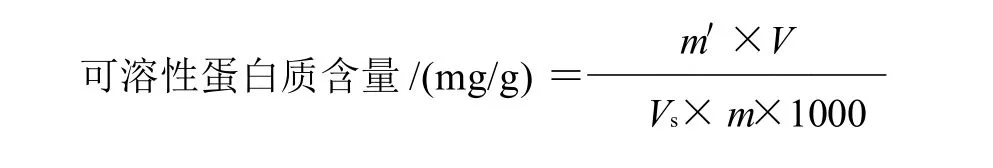
1.3.4 PG提取条件的优化
1.3.4.1 单因素试验
在其他条件一定时,提取缓冲液pH值采用 4.0、4.5、5.0、5.5、6.0乙酸缓冲液(0.05mol/L),提取缓冲液离子浓度采用 0、0.1、0.2、0.3、0.4、0.5mol/L NaCl溶液,向提取缓冲液中添加1mmol/L DTT、1mmol/L EDTA、20%甘油、1% Triton X-100,向提取缓冲液中分别添加0、0.5、1.0、1.5、2.0mol/L DDT,粗酶液反应温度采用30、40、50、60、70℃,粗酶液反应时间30、60、90、20、150、180min,分别进行单因素试验。
1.3.4.2 正交试验设计
根据单因素试验结果,选择提取液pH值、提取液离子浓度、DTT添加量进行三因素三水平L9(33)正交试验设计,得到最佳提取条件。
1.4 数据处理
数据分析采用SPSS软件进行统计分析。所得数据为3次平均值,进行正交试验方差分析。
2 结果与分析
2.1 单因素试验
2.1.1 缓冲液pH值对PG提取的影响
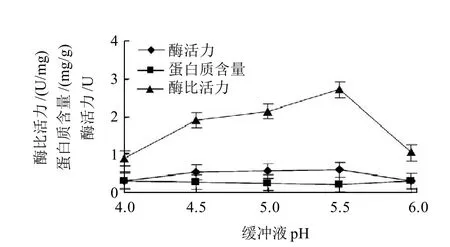
图1 缓冲液pH值对PG活力的影响Fig.1 Effect of pH on PG activity
用0.05mol/L乙酸缓冲作为提取缓冲液,选取4.0、4.5、5.0、5.5、6.0五个不同pH值,按照1.3.1节的方法提取粗酶液后,按照1.3.2节和1.3.3节方法测定不同提取液酶活力和蛋白质含量,研究不同pH值条件对酶
提取效果的影响。由图1可见,当缓冲液pH值由4.0逐步提高到5.5时,PG活力及比活力随pH的提高而逐渐增大,在pH5.5时提取酶液的酶活力及比活力呈现最高,当pH6.0时,PG比活力明显下降。本实验选用pH4.5、5.0、5.5进行正交试验。
2.1.2 缓冲液离子强度对PG提取的影响

图2 缓冲液离子浓度对PG活力的影响Fig.2 Effect of ion concentration in buffer pH on PG activity
在上述提取缓冲液的基础上,添加NaCl,使其浓度分别为0、0.1、0.2、0.3、0.4、0.5mol/L。由图2可以看出,在乙酸缓冲液中加入NaCl后,明显影响了粗酶液中PG的活力。当缓冲液离子浓度为0.1mol/L时,PG活力高于其他浓度,明显高与对照组(0mol/L)42.0%。之后随着缓冲液离子浓度的增加,PG活力逐步降低,浓度增加0.5mol/L时,PG活力最低,明显低于对照组41.4%,说明高离子浓度反而抑制了PG活力。本实验选用0.1、0.2、0.3mol/L NaCl进行正交试验,比较不同离子浓度对PG活力的影响。
2.1.3 不同添加物对PG提取的影响
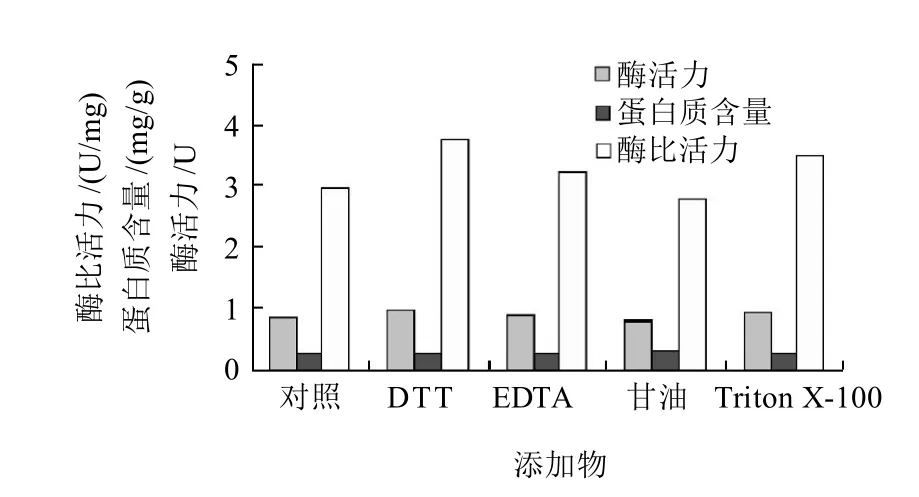
图3 不同添加物对PG活力的影响Fig.3 Effect of additive composition on PG activity
在上述提取缓冲液的基础上,添加1mmol/L DTT、1mmol/L EDTA、20%甘油、1% Triton X-100,研究不同添加物对酶提取效果的影响。由图3可知,在pH5.5乙酸缓冲液中分别添加DTT、EDTA、甘油、Triton X-100后,除甘油外的3种添加物均不同程度地提高了粗酶提取液中PG的活力,其中DTT的效果高于其他添加物。说明在提取缓冲液种加入DTT可以提高PG的提取活力。
2.1.4 DTT添加量对PG提取的影响
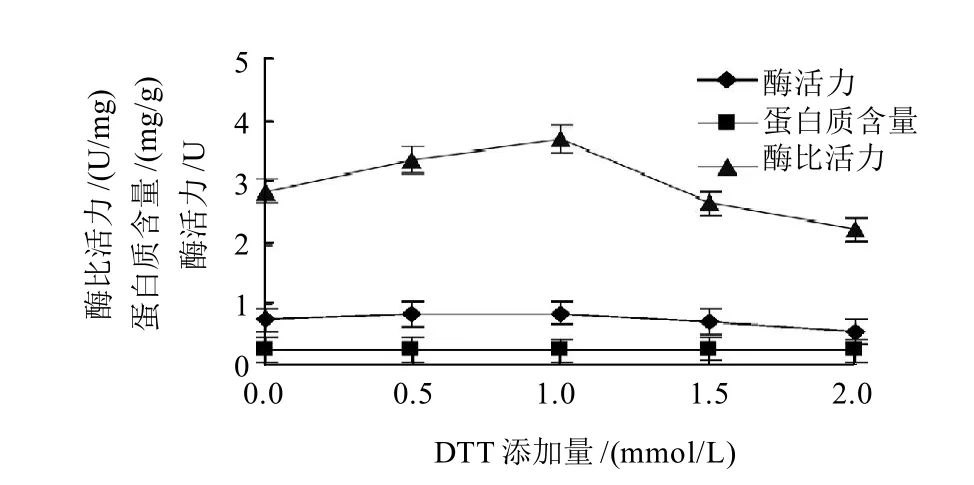
图4 DTT添加量对PG活力的影响Fig.4 Effect of DTT addition amount on PG activity
在2.1.2节提取缓冲液的基础上,添加DTT,使其浓度分别为0、0.5、1.0、1.5、2.0mmol/L,研究DTT浓度对酶提取效果的影响。DTT为常用还原剂,有抗氧化作用。它能保护酶分子上的还原性基团,维持还原性环境,稳定酶的活性。由图4可知,随着DTT浓度的增加,PG活力呈上升趋势,当DTT浓度达到1.0mmol/L时,PG活力达到最大值,之后随着浓度的增大,PG呈下降趋势。本实验选用0、0.5、1.0mmol/L DTT进行正交试验,比较不同DTT浓度对PG活力的影响。
2.1.5 温度对粗酶液PG活力的影响
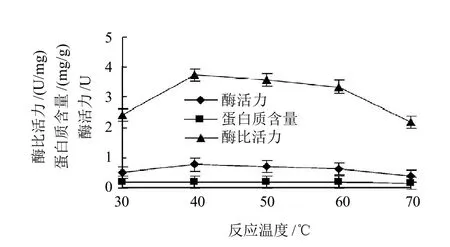
图5 反应温度对粗酶液PG活力的影响Fig.5 Effect of reaction temperature on PG activity
将粗酶液反应体系分别在30、40、50、60、70℃反应温度下保温90min。由图5可以看出,反应温度在40~60℃之间酶活性良好,当反应温度在40℃时,PG活力最高,随着温度的不断升高,PG活力逐渐下降。虽然高温度可加速酶促反应的进行,但同时加速酶变性而减少有活性酶的数量,降低催化作用。
2.1.6 反应时间对粗酶液PG活力的影响

图6 反应时间对粗酶液PG活力的影响Fig.6 Effect of reaction time on PG activity
将粗酶液反应体系置于40℃条件下,分别保温30、60、90、120、150、180min。由图6可知,随着反应时间的增加,PG活力也随之逐渐提高,当反应时间达到90min时,酶活力最高,其后随着反应时间的进一步的增加,PG活力下降,但下降幅度不大。
2.2 正交试验
根据单因素试验结果,确定PG提取条件正交的考察因素及水平,以酶比活力为指标,因素水平及结果见表1。

表1 PG提取条件正交试验设计及结果Table 1 Design and results of orthogonal tests for optimizing extraction conditions of PG
在单因素试验基础上做正交试验,优化提取条件。选取缓冲液pH(A)、缓冲液离子浓度(B)、DTT添加量(C)3个因素,以PG比活力为指标,优化出PG最优提取条件。综合分析表1可知,影响PG提取条件的因素显著(R值)次序为B>C>A,即缓冲液离子浓度对PG比活力影响最大。由此得出PG最优提取条件:以50mmol/L pH5.5乙酸-乙酸钠缓冲液为提取液,加入0.1mol/L NaCl、1.0mmol/L DTT提取效果为最佳。
3 结 论
通过单因素及正交试验,各因素对PG提取效果作用大小依次为:缓冲液离子浓度、DTT添加量、缓冲液pH值。PG最优提取条件:以50mmol/L pH5.5乙酸-乙酸钠缓冲液为提取液,加入0.1mol/L NaCl、1.0mmol/L DTT提取效果为最佳;PG最适活性分析条件为反应温度40℃、反应时间90min。
绝大多数微生物所产生的多聚半乳糖醛酸酶的最适反应pH值都在酸性范围,一般在pH3.5~5.5之间,并且在酸性环境中表现出较好的酶活稳定性,属于酸性果胶酶[20]。稀盐溶液中的离子可以减少蛋白质分子极性基团之间的静电引力,加强蛋白质与提取液之间的相互作用,具有保护蛋白质不易变性的优点[21]。盐浓度一般控制在0.02~0.5mol/L范围内,常用的盐溶液为NaCl溶液[22]。本实验结果为向提取缓冲液中加入0.1mol/L NaCl,可见低浓度盐溶液对酶稳定性好、溶解度大。
[1] 朴一龙, 赵兰花. 软枣猕猴桃研究进展[J]. 北方园艺, 2008(3)∶ 76-78.
[2] 赵淑兰. 软枣猕猴桃品种简介[J]. 特种经济动植物, 2002, 5(2)∶ 35-36.
[3] 段学武, 张昭其, 季作梁. PG酶与果实的成熟软化[J]. 果树学报,2001, 18(4)∶ 229-233.
[4] 程杰山, 沈火林, 孙秀波, 等. 果实成熟软化过程中主要相关酶作用的研究进展[J]. 北方园艺, 2008(1)∶ 49-52.
[5] 张海新, 及华. 果实成熟软化及相关酶学研究[J]. 食品科技, 2008,33(11)∶ 57-59.
[6] 薛炳烨, 束怀瑞. 多聚半乳糖醛酸酶(PG)与果实成熟软化研究进展[J]. 山东农业大学学报,2002, 33(2)∶ 252-256.
[7] 白延红, 马胜利, 秦静远, 等. 多聚半乳糖醛酸酶(PG)与果实成熟软化的影响[J]. 陕西农业科学, 2008(4)∶ 86-88.
[8] RONALD P, VRIES D, JAAP V, et al. Aspergillus enzymes involved in degradation of plant cell wall polysaccharides [J]. Microbiol Mol Biol R, 2001, 65(4)∶ 497-522.
[9] DAVID A. Modification of expansin protein abundance in tomato fruit alters softening and cell wall polymer metabolism during ripening[J].The Plant cell, 1999(11)∶ 2203- 2216 .
[10] KRISTEN A, ALAN B. Polygalacturonases∶ many genes in search of a function[J]. Plant Physiol, 1998, 117(2)∶ 337-343.
[11] PIETRO A, MADRID M, CARACUEL Z, et al. Fusarium oxysporum∶exploring the molecular arsenal of a vascular wilt fungus[J]. Molecular Plant Pathol, 2003, 4(1)∶ 315-325.
[12] SCOTT S, CHENG Y, CERVONE F, et al. Targeted mutants ofCochiobolus carbonumlacking the two major extracellular polygalacturonases[J]. Appl Environ Microb, 1998, 64(1)∶ 1497-1503.
[13] 杨德兴, 戴京晶, 庞向宇, 等. 猕猴桃衰老过程中PG、果胶质和细胞壁超微结构的变化[J]. 园艺学报, 1993, 20(4)∶ 341-345.
[14] 毛存贵, 王克夷. 多聚半乳糖醛酸的固定化及其基本性质研究[J]. 生物化学杂志, 1993, 9(4)∶ 390-393.
[15] 贾月, 宫爱君, 邱丽娜, 等. 果胶酶分离纯化及分析方法的研究进展[J]. 工业微生物, 2005, 35(1)∶ 55-58.
[16] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京∶ 中国轻工业出版社, 2007.
[17] 王天龙, 仇宏伟, 陈海华, 等. 3,5-二硝基水杨酸法测定果胶酶活力的条件研究[J].食品与机械, 2008, 24(3)∶ 96-104.
[18] 王小敏, 吴文龙, 闾连飞, 等. 分光光度计测定果胶酶活力的方法研究[J]. 食品工业科技, 2007, 28(5)∶ 227-229.
[19] BRADFORD R M. A rapid and sensivive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem, 1976, 72(1/2)∶ 248-254.
[20] PRADE R A, ZOHAN D, AYOUBI P, et al. Pectins, petinases and plant-microbe interactions[J]. Biotechnol Genetic Eng Rev, 1999, 63(16)∶ 361-391.
[21] 赵亚华, 高向阳. 生物化学实验技术教程[M]. 广州∶ 华南理工大学出版社, 2000∶ 2-5.
[22] 施巧琴. 酶工程[M]. 北京∶ 科学出版社, 2005∶ 142.
Optimization of Extraction Conditions for Polygalacturonase from Actinidia arguta
LIU Yue1,2,LI Shu-qian1,2,ZHANG Bo2,LIU Chang-jiang1,XIN Guang2,1*
(1. College of Food Science, Shenyang Agricultural University, Shenyang 110866, China;
2. Department of Chemistry, Anshan Normal University, Anshan 114007, China)
Actinidia argutawas used as the experimental material to explore the optimal extraction conditions and enzymatic activity analysis conditions of polygalacturonase (PG). The optimal extraction process parameters were explored by orthogonal tests through evaluating the effects of pH, ion concentration and DTT addition amount on extraction rate PG. The results indicated that the optimal extraction process condtions for PG were extraction pH of 5.5, acetate buffer concentration of 0.05 mol/L, NaCl concentration of 0.1 mol/L and DTT concentration of 1 mmol/L. The optimal enzymatic activity analysis conditions were reaction temperature of 40 ℃ and reaction time of 90 min.
Actinidia arguta;polygalacturonase (PG);extraction;enzymatic activity analysis
TS255.2
A
1002-6630(2012)10-0115-04
2011-05-17
国家公益性行业(农业)科研专项(200903013)
刘月(1986—),女,硕士研究生,主要从事食品生物技术研究。E-mail:lymoon2010@sina.com
*通信作者:辛广(1966—),男,教授,博士,主要从事生物技术研究。E-mail:xguang212@163.com

