海藻酸钠固定化碱性蛋白酶制备及酶学性质的研究
王胜男,江连洲,2,* ,李 杨,2,李丹丹,王中江,齐宝坤,刘 琪,王 梅
(1.东北农业大学食品学院,黑龙江哈尔滨 150030;2.国家大豆工程技术研究中心,黑龙江哈尔滨 150030)
海藻酸钠固定化碱性蛋白酶制备及酶学性质的研究
王胜男1,江连洲1,2,*,李 杨1,2,李丹丹1,王中江1,齐宝坤1,刘 琪1,王 梅1
(1.东北农业大学食品学院,黑龙江哈尔滨 150030;2.国家大豆工程技术研究中心,黑龙江哈尔滨 150030)
对采用海藻酸钠固定化碱性蛋白酶的方法和酶学性质进行了研究。在单因素实验基础上,采用响应面优化方法确定固定化的最优条件,得到的最佳条件为:海藻酸钠浓度3.1%,pH9.4,CaCl2浓度3.0%,游离酶添加量10000U/g,时间1.8h,固定化酶活力可达5518U/g。固定化酶的最适pH为10,最适温度为60℃,制得的固定化酶的热力学稳定性和操作稳定性较好。此外,固定化酶重复利用5个循环后酶活力仅降低40%。
海藻酸钠,碱性蛋白酶,固定化酶,酶学性质
目前,酶固定化技术已在食品工业、医药、化工等领域广泛应用,随着人们对天然高分子载体的不断挖掘和探究,对其进行改性,或利用超临界技术、纳米技术、膜技术等来固定化酶,同时,开发新型、高效固定化酶反应器,进一步提高转化和生产能力是固定化酶技术发展的趋势[1-4]。碱性蛋白酶是一类适宜在碱性条件下水解蛋白肽键的酶类,随着人们对碱性蛋白酶认识的不断深入,其被广泛应用在水解植物蛋白中,但是酶稳定性较差,在温度、pH和无机离子等外界因素的影响下,容易变性失活,酶与底物和产物混在一起,反应结束后,难以回收利用,而且难于实现连续化酶反应。酶反应后与产物混在一起,无疑给产物的进一步分离纯化带来一定的困难。固定化酶相比于游离酶稳定性有较大提高,对热、pH等的稳定性提高,对抑制剂的敏感性降低,易于分离,改善了后处理过程[5]。反应完成后经过简单的过滤或离心,产物即可与酶蛋白或细胞达到有效分离。固定化体系适合于连续化、自动化生产,酶催化过程有利于控制,固定化酶经回收可反复使用,提高了酶的利用效率,降低了生产成本[6-8]。本研究采用海藻酸钠作为固定化载体,海藻酸钙凝胶是容易获得,已经被证实可以用于多种反应和许多种酶,同时对固定化碱性蛋白酶制备适宜条件进行了系统研究,为碱性蛋白酶固定化研究提供了理论支持。
1 材料与方法
1.1 材料与仪器
Alcalase碱性内切蛋白酶(1.2×105U/mL) 德国Novo公司;海藻酸钠 食品级,上海化学试剂站分装厂;福林酚、酪蛋白 分析纯,Sigma公司;戊二醛、三氯乙酸、碳酸钠、氢氧化钠、四硼酸钠、无水乙醇 分析纯,天津迪博化工股份有限公司。
FA2004型电子分析天平 上海舜宇恒平科学仪器有限公司;WGL-45B型电热恒温鼓风干燥箱 天津泰斯特仪器有限公司;LDZ5-2型台式低速离心机 上海安亭科学仪器厂;pHS-3C型酸度计 上海雷磁仪器厂;UV759CRT型紫外可见分光光度计 上海佑科仪器公司;XMTD-4000型电热恒温水浴锅 北京市永光明医疗仪器厂;78-1磁力加热搅拌器 常州国华电器有限公司。
1.2 实验方法
1.2.1 海藻酸钠固定化碱性蛋白酶 称取一定质量的海藻酸钠,配制成不同质量分数的海藻酸钠溶液,并加热溶解。量取一定量的碱性蛋白酶,并用硼酸缓冲液稀释。将一定质量分数的海藻酸钠溶液按一定比例与碱性蛋白酶混合,充分搅拌均匀后,用蠕动泵将混合液以5cm高度滴入一定质量分数的CaCl2中形成凝胶珠,放入4℃冰箱中进一步硬化一段时间。得到颗粒均匀、形状规整的海藻酸钠微球。去离子水洗涤数次后,确定上清液中无酶。取出抽滤,同时测其酶活,剩余的于4℃冰箱保存备用。
1.2.2 单因素实验 海藻酸钠质量分数3%,pH9.5,CaCl2质量分数3%,游离酶添加量10000U/g,固定化时间2h。控制4因素不变,变化1个因素,海藻酸钠质量分数1.5%~4%,pH7~12硼酸缓冲液,CaCl2质量分数2%~4%,游离酶添加量4000~20000U/g,固定化时间1~3h来确定各因素对固定化效果的影响。
1.2.3 响应面实验设计 在单因素实验的基础上,确定各因素的最佳水平值范围,采用响应面中心组合实验设计,研究各固定化影响因素对固定化酶活力回收率的影响规律,并得到固定化碱性蛋白酶的最佳条件。以各固定化影响因素海藻酸钠浓度(x1)、pH(x2)、CaCl2浓度(x3)、游离酶添加量(x4)、时间(x5)为自变量,以固定化酶活力回收率响应值,其因素水平编码表见表1。
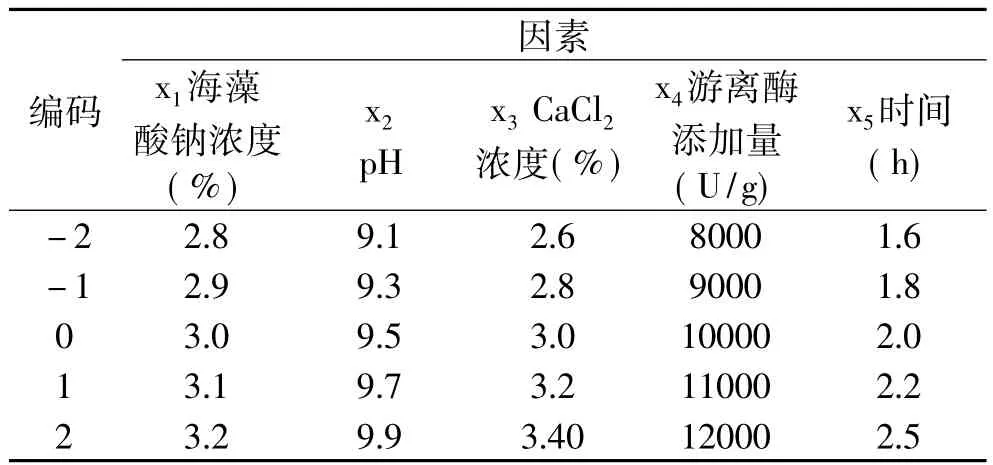
表1 实验因素水平编码表Table 1 Encode table of factors and levels
1.2.4 酶活力的测定 碱性蛋白酶酶活力测定采用标准SB/T13017-1999,即福林—酚法测定碱性蛋白酶酶活,固定化酶活力单位为U/g。
相对酶活力,以酶活力最大值为100%,其余数值与其对比,即相对酶活力,以百分数表示。

1.2.5 固定化酶和游离酶的酶学性质 用pH7~12硼酸-氢氧化钠缓冲液鉴定pH对游离酶和固定化酶活力的影响。使温度在30~80℃之间变化,测定温度对碱性蛋白酶酶活的影响。在40、60、80℃下,处理30min~3h测定游离酶和固定化酶的热力学稳定性。
1.2.6 固定化酶的操作稳定性 在60℃,搅拌速度150r/min,0.5%酪蛋白的条件下,连续循环操作使酶的活力下降,以测量固定化酶的操作稳定性。每循环30min用去离子水洗固定化粒子。
1.3 数据处理
所有实验数据均为“平均值±标准差”,n=3。采用SAS9.2统计分析软件对实验数据进行分析[6]。
2 结果与分析
2.1 酪氨酸标准曲线的绘制
按1.2.4福林—酚法,由测得数据绘制酪氨酸标准曲线,标准方程为 Y=0.0082X+0.0093,R2=0.9992。
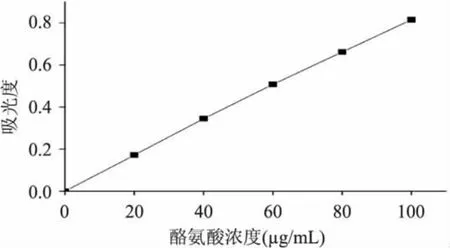
图1 酪氨酸标准曲线Fig.1 Standard curve of tyrosine
2.2 固定化条件的确定
2.2.1 海藻酸钠对固定化效果的影响 从图2可看出,海藻酸钠浓度是影响海藻酸钠成球的重要因素。当海藻酸钠浓度低于3%时,微球表面形成的固定化膜强度不够,容易分散、机械强度差,导致制备的海藻酸钠微球有明显的拖尾现象,且凝珠脆弱,易破壁,变化显著(p<0.05)。当海藻酸钠浓度达到3%时,固定化酶的酶活力回收率最高,制备的海藻酸钠微球呈圆形,机械性能较好。随着海藻酸钠浓度的进一步增加,溶液黏度增大,在相同挤压孔径下,挤压越来越难,形成的微球表面结构致密,固定化膜强度过高,导致酶活力回收率下降[9]。当海藻酸钠浓度达到3.5%后,浓度继续增大到4%,变化不显著(p>0.05)。因此,本实验选择最佳的海藻酸钠浓度为3%。
2.2.2 pH对固定化效果的影响 由图3可知,当pH低于9.5时,酶活力回收率较低,随着pH逐渐升高到9.5时,酶活力回收率最高,当pH继续增大时,酶活力回收率显著下降(p<0.05)。可见pH对固定化酶活力具有较大影响,可能由于酶表面特性基团的电离作用使得蛋白酶分子在不同pH时以不同的解离状态存在,影响了酶与载体的结合能力[10],从而影响酶的活力,产生了图3中所示的结果。

图2 海藻酸钠对碱性蛋白酶固定化效果的影响Fig.2 Effects of sodium alginate concentration on immobilization of alkaline protease
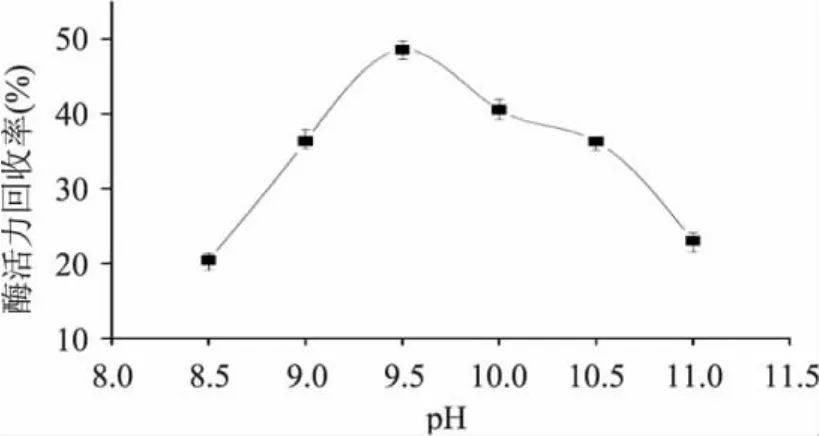
图3 pH对碱性蛋白酶固定化效果的影响Fig.3 Effects of pH value on immobilization of alkaline protease
2.2.3 CaCl2浓度对固定化效果的影响 CaCl2与海藻酸钠反应形成海藻酸钙凝胶是固定化酶的重要过程,CaCl2质量分数对形成凝胶的机械强度有重要影响。从图4中可以看出,当CaCl2质量分数低于3%时,凝胶的机械强度差,固定化酶活力回收率低,变化显著(p<0.05)。当CaCl2质量分数高于3%时,可能由于Ca离子布满凝胶表面[11],影响了酶的作用效果,随着CaCl2浓度的增大而显著降低(p<0.05)。当CaCl2质量分数为3%时,固定化酶活力回收率最大,因此CaCl2浓度选择3%。
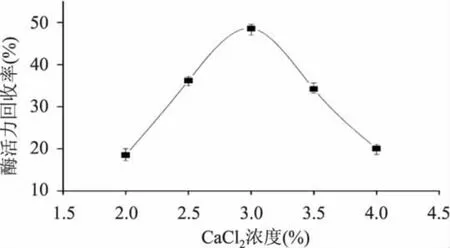
图4 CaCl2浓度对碱性蛋白酶固定化效果的影响Fig.4 Effects of CaCl2concentration on immobilization of alkaline protease
2.2.4 游离酶添加量对固定化效果的影响 图5中显示,加酶量在2000~10000U/g范围内,固定化酶酶活力随着加酶量的增加而增加,由于此时载体上的蛋白质结合点未达到饱和,而固定化率的趋势显著上升(p<0.05)。当加酶量继续增加,在10000~18000U/g范围内,固定化率随加酶量的增加而降低,原因在于酶量增加到一定程度时,载体上蛋白结合点达到饱和,酶分子继续增多,使酶分子相互聚集,造成酶活性中心结构发生变化[12],因此固定化酶活力也略有下降(p>0.05)。综合考虑固定化酶活力和酶活力回收率,确定给酶量为10000U/g。
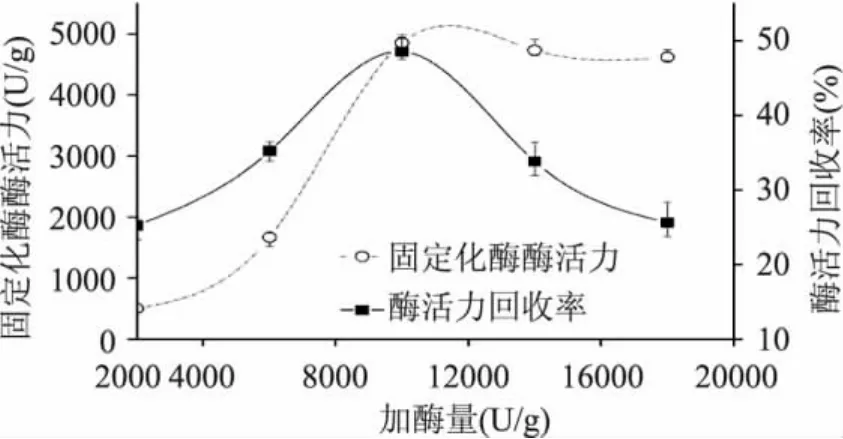
图5 游离酶添加量对碱性蛋白酶固定化效果的影响Fig.5 Effects of enzyme amount on immobilization of alkaline protease
2.2.5 时间对固定化效果的影响 海藻酸钠与CaCl2形成凝胶是Ca2+从海藻酸钠中置换Na+形成的,置换效果与时间有密切关系。从图6中可看出,固定化时间在1~2h范围内,固定化酶活力回收率随着时间的延长而显著增加(p<0.05),但时间超过2h后,固定化酶活力回收率逐渐降低,原因在于固定化时间过长,海藻酸钙结构过于致密,底物的扩散阻力增加[13],同时已固定化的酶也可由内向外扩散,造成酶的泄露。因此,确定最佳固定化时间2h。

图6 时间对碱性蛋白酶固定化效果的影响Fig.6 Effects of time on immobilization of alkaline protease
2.3 固定化条件的优化
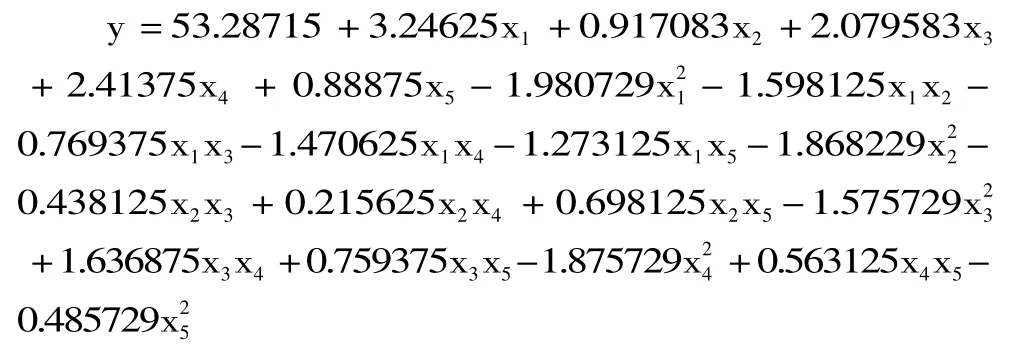
响应面实验方案及结果见表2。实验号1~26为析因实验,27~36为10个中心实验,用以估计实验误差。
通过统计分析软件SAS9.2进行数据分析,建立二次响应面回归模型为:
进一步对该回归模型进行显著性检验,响应曲面数据的方差分析结果见表3。由表3可知,方程因变量与自变量之间的线性关系明显,该模型回归显著(p<0.001),失拟项不显著,并且R2=96.18%=91.08%,说明该模型与实验拟合良好,自变量与响应值之间线性关系显著,实验误差小,可以用此模型来分析和预测结果。由此可以认为上面给出的二次回归方程模型是合适的。由F检验可以得到因子贡献率为:x1>x4>x3>x2>x5,即海藻酸钠浓度>游离酶添加量>CaCl2浓度>pH>时间。
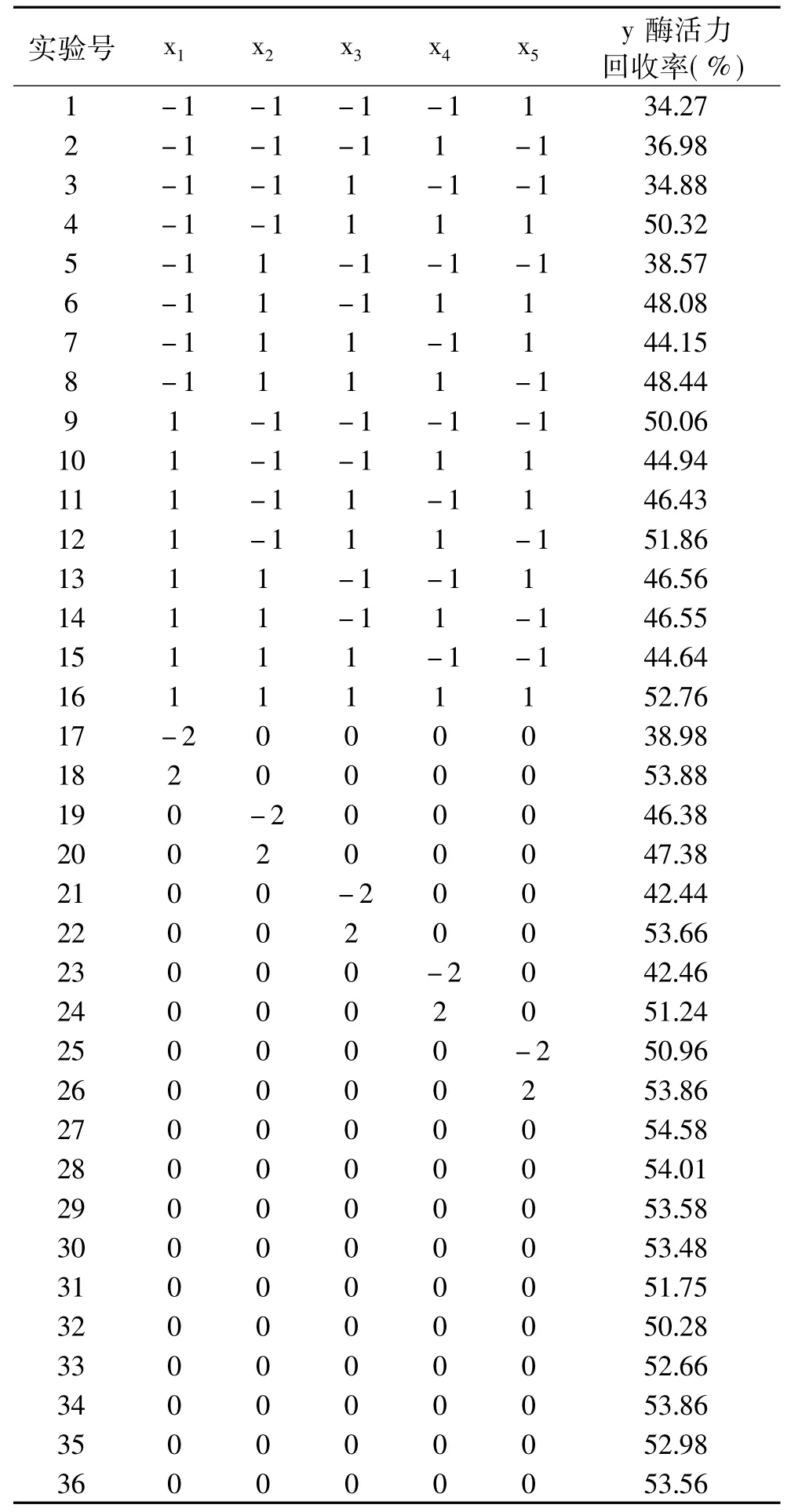
表2 响应面实验方案及结果Table 2 Design and result of response surface analysis
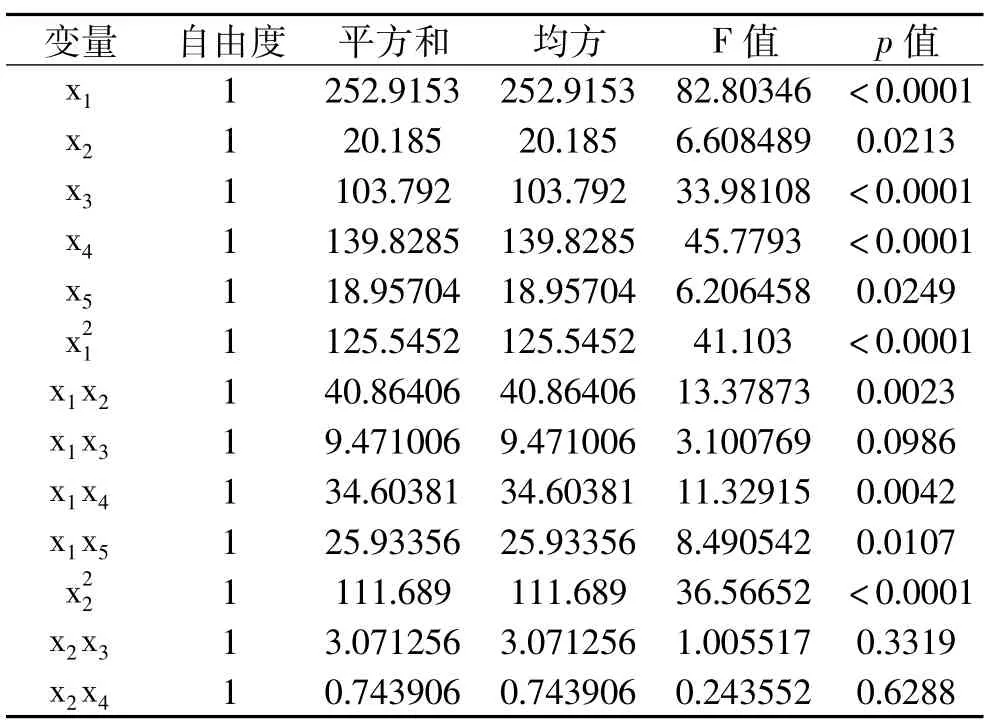
表3 回归与方差分析结果Table 3 Results of regression and variance analysis
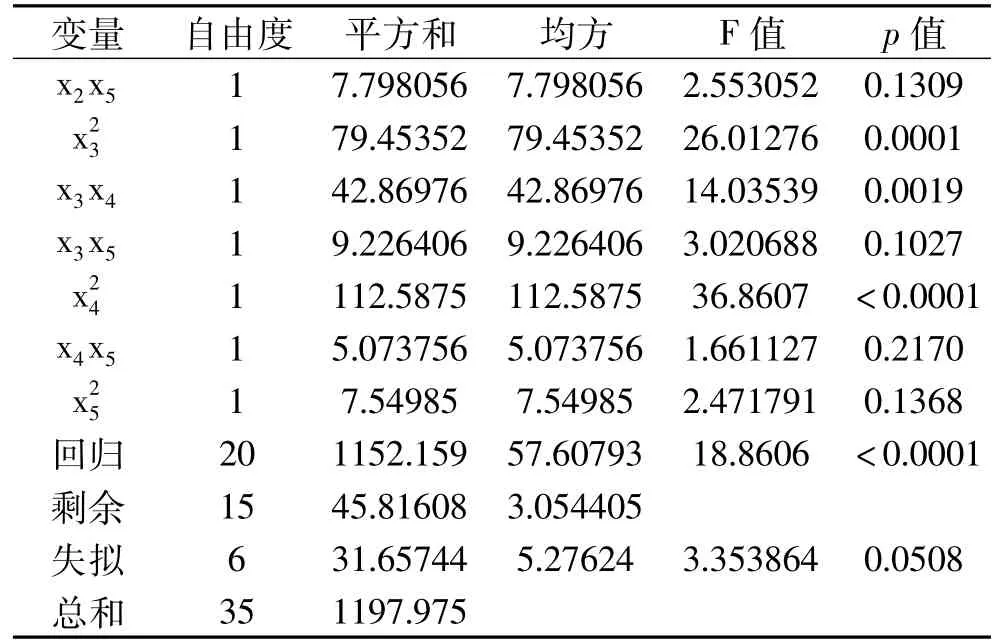
续表
应用响应面寻优分析方法对回归模型进行分析,寻找最优响应结果见表4,由表4可知当海藻酸钠浓度为3.1%,pH为9.4,CaCl2浓度为3.0%,游离酶添加量为10000U/g,时间为1.8h,响应面最优值为(54.95±1.08)%,同时测得最优条件下,固定化酶活力可达5518U/g。

表4 响应面分析法寻优结果Table 4 Results of response surface optimization
各两因素交互作用(显著项)对蛋白提取率影响的响应面图见图7。
2.4 验证实验
在响应面分析法求得的最佳条件下,即海藻酸钠浓度为3.13%,pH为9.40,CaCl2浓度为3.04%,游离酶添加量10000U/g,进行平行实验(3次),3次平行实验的平均值为55.01%。响应值的实验值与回归方程预测值吻合良好,说明该模型能够较好地预测实际固定化效果。
2.5 固定化碱性蛋白酶酶学性质
2.5.1 最适pH 在不同pH的硼酸-氢氧化钠缓冲液中测定游离酶和固定化酶活力,并计算相对酶活力,结果见图8。从图中可以看出,固定化酶的最适pH为10,较游离酶的最适pH9向碱性方向移动一个单位,同时在极限pH处,固定化酶的相对酶活力比游离酶高,原因可能是由于载体的存在影响了固定化酶的结构,载体对离子产生一定阻碍作用[14]。
2.5.2 最适温度 在不同温度下测定游离酶和固定化酶的酶活力,结果如图9所示。从图中可知,游离酶的最适温度为50℃,固定化酶为60℃,但由于过热使部分酶失活,高于60℃酶活显著降低(p<0.05),结果表明酶经固定化后最适温度有所提高,可能由于固定化过程中酶的结构发生了变化,同时载体对酶也有一定保护作用[15]。

图7 各两因素交互作用(显著项)对固定化效果影响的响应面图Fig.7 Response surface analysis of significant effective interaction items of different parameters on immobilization of alkaline protease
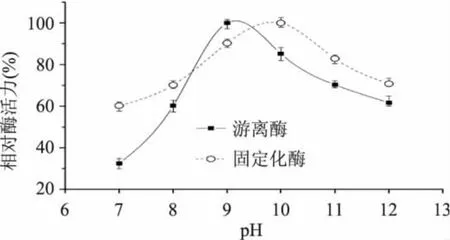
图8 不同pH时游离酶和固定化酶的相对酶活力Fig.8 Relative activity of free and immobilized alkaline protease under different pH value conditions

图9 不同温度时游离酶和固定化酶的相对酶活力Fig.9 Relative activity of free and immobilized alkaline protease under different temperatures
2.5.3 热力学稳定性 从图10中可以看出,固定化酶相比游离酶有着较强的热力学稳定性。固定化酶经40℃处理180min,酶活保持原来的80%,而游离酶酶活损失了近50%。60℃处理时,游离酶的稳定性也不及固定化酶。80℃处理时,游离酶处理90min时,基本丧失酶活,而固定化酶直至120min才丧失酶活。这种现象的产生,可能是由于载体提供了一种微环境,对酶起到了保护作用,同时固定化酶要比游离酶的结构稳定[16]。

图10 固定化酶与游离酶的热力学稳定性Fig.10 Thermal stability of immobilized alkaline protease and free
2.5.4 操作稳定性 测定循环使用固定化酶的酶活力,以测定固定化酶的操作稳定性。从图11中可以看出,随着循环次数的增加,相对酶活力降低。造成酶活力损失的原因可能是,载体受到磨损,酶从海藻酸钠载体上脱落,或是酶的作用位点随着水解酪蛋白的不断进行而逐渐暴露,容易遭到破坏。实验结果表示,固定化酶循环使用5次后,酶活力仍可保持原来的60%。
3 结论
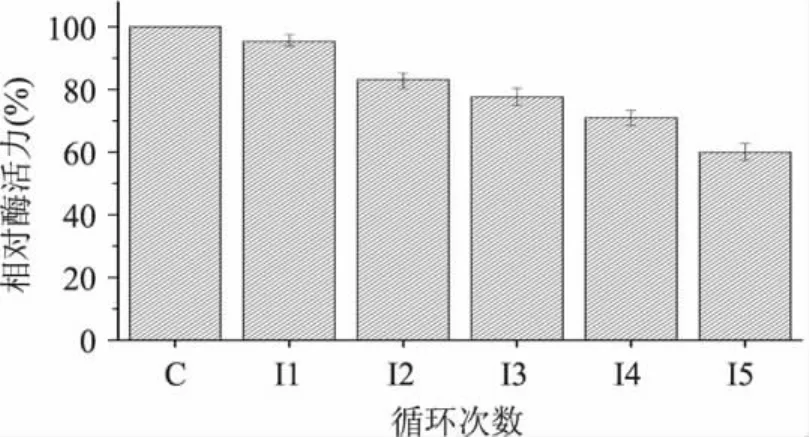
图11 固定化酶的操作稳定性Fig.11 Operation stability of immobilize alkali protease
本实验提供了一种在海藻酸钠上固定碱性蛋白酶的简单方法,海藻酸钠是一种低成本、无毒、易于获得的载体,固定化酶与游离酶同样可以为酶解反应提供最适条件。本实验得到了固定化的最佳条件,海藻酸钠浓度为3.1%,pH为9.40,CaCl2浓度为3%,游离酶添加量10000U/g,时间1.8h,固定化酶活力可达5518 U/g,同时测定了制得的固定化酶的最适温度和pH分别为60℃和10,同时固定化酶的热力学稳定性和操作稳定性较好。固定化酶循环利用5次,酶活仍可保持原来的60%。本实验为固定化酶在实际生产中应用提供了理论支持,在实际生产中的生产率有待进一步研究。
[1]Tanriseven A,Olcer Z.A novel method for the immobilization of glucoamylase onto polyglutaraldehyde- activated gelatin[J].Biochemical Engineering Journal,2008,39:430-434.
[2]Girelli A M,Mattei E.Application of immobilized enzyme reactor in on-line high performance liquid chromatography[J].Journal of Chromatography B,2005,819:3-16.
[3]Amin H A S,El-Menoufy H A,El-Mehalawy A A,et al.Biosynthesis of glycyrrhetinic acid 3-O-mono-β-d-glucuronide by free and immobilized Aspergillus terreusβ-d-glucuronidase[J].Journal of Molecular Catalysis B:Enzymatic,2011,69:54-59.
[4]袁定重,张秋禹,侯振宇,等.固定化酶载体材料的最新研究进展[J].材料导报,2006,20(1):69-72.
[5]杨勇,李彦锋,拜永孝,等 酶固定化技术用载体材料的研究进展[J].化学通报,2007(4):257-263.
[6]林敏刚.碱性蛋白酶在水解制取蛋白中的应用[J].中国油脂,2009,34(12),30-33.
[7]Hu F L,Deng C H,Zhang X M.Development of high performance liquid chromatography with immobilized enzyme onto magnetic nanospheres for screening enzyme inhibitor[J].Journal of Chromatography B,2008,71:67-71.
[8]Yang L,Chen C Y,Chen Y F.High temporal resolution monitoring of enzyme reaction and inhibition using optically gated vacancy capillary electrophoresis and immobilized enzyme[J].Analytica Chimica Acta,2010,683:136-142.
[9]Busto M D,García - Tramontín K E,Ortega N,et al.Preparation and properties of an immobilized pectinlyase for the treatment of fruit juices[J].Bioresource Technology,2006,97:1477-1483.
[10]Rocha C,Goncalves M P,Teixeira J A.Immobilization of trypsin on spent grains for whey protein hydrolysis[J].Process Biochemistry,2011,46:505-511.
[11]林松毅,宋龙凤,刘静波,等.壳聚糖微球固定碱性蛋白酶的研究[J].食品科学,2008,29(11):351-355.
[12]侯利霞,相朝清,王金水,等.响应面法优化固定化碱性蛋白酶工艺[J].河南工业大学学报,2010,31(1):53-58.
[13]Ma J F,Zhang L H,Liang Z.Immobilized enzyme reactors in proteomics[J].Trends in Analytical Chemistry,2011,30:691-702.
[14]Quiroga E,Illanes C O,Ochoa N A,et al.Performance improvement of araujiain, a cystein phytoprotease, by immobilization within calcium alginate beads[J].Process Biochemistry,2011,46:1029-1034.
[15]武军,陶红,梁歧.脱乙酰壳聚糖固定碱性蛋白酶的研究[J].食品科学,2005,26(9):184-186.
[16] Yen M C,Hsu W H,Lin S C.Synthesisof L-homophenylalanine with immobilized enzymes[J].Process Biochemistry,2010,45:667-674.
Preparation and enzymatic properties of alkaline protease immobilized with sodium alginate
WANG Sheng-nan1,JIANG Lian-zhou1,2,*,LI Yang1,2,LI Dan-dan1,WANG Zhong-jiang1,QI Bao-kun1,LIU Qi1,WANG Mei1
(1.College of Food Science,Northeast Agricultural University,Harbin 150030,China;2.The National Research Center of Soybean Engineering and Technology,Harbin 150030,China)
Preparation and enzymatic properties of alkaline protease immobilized with sodium alginate were studied.Based on single factor experiments,response surface optimization method was used to determine the optimal conditions for immobilization.The results showed that optimum conditions were:concentration of sodium alginate 3.1%,concentration of CaCl23.0%,pH 9.4,amount of free enzyme 10000U/g,time 1.8h,enzyme activity up to 5518U/g.The optimum pH was 10,optimum temperature was 60℃,the thermal stability and operational stability of the immobilized enzyme was better.Furthermore,the enzyme activity of immobilized enzyme was only reduced by 40%after used five cycles.
sodium alginate;alkaline protease;immobilized enzyme;enzymatic properties
Q814.2
A
1002-0306(2012)17-0166-06
2012-02-02 *通讯联系人
王胜男(1988-),女,在读硕士研究生,研究方向:粮食、油脂及植物蛋白工程。
黑龙江省攻关项目(GA09B401-6);农业部现代农业产业技术体系建设项目(nycytx-004)。

