冷藏带鱼贮藏期间主要微生物动态变化的PCR-DGGE分析
蓝蔚青,谢 晶
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海 201306)
冷藏带鱼贮藏期间主要微生物动态变化的PCR-DGGE分析
蓝蔚青,谢 晶*
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海 201306)
本文研究了冷藏带鱼贮藏期间的主要微生物种群演替规律,为延长水产品货架期提供参考。采用SDS化学裂解法,从冷藏带鱼中提取总细菌基因组DNA,并进行16S rRNA的V3可变区PCR扩增,再通过DGGE得到动态指纹图谱。结果表明,贮藏初期冷藏带鱼样品中的微生物群落丰富,嗜冷杆菌(Psychrobacter sp.)为前期的主要优势菌。随着贮藏时间的延长,仅有少数种类细菌存活并最终成为主导菌群。荧光假单胞菌(Pseudomonas fluorescens)在贮藏过程中比例逐渐增大,希瓦氏菌(Shewanella sp.)与弧菌(Vibrio sp.)比例也有明显增加,在贮藏后期发展成为优势腐败菌。
带鱼,变性梯度凝胶电泳,微生物,动态变化
Key words:Trichiurus haumela;denaturing gradientgelelectrophoresis(DGGE);microorganisms;dynamic changes
带鱼(Trichiurus haumela)又名裙带鱼、牙带鱼、刀鱼、白带鱼等,为鲈形目带鱼科带鱼属,属暖温性近底层鱼类,是我国四大经济鱼类之一,广泛分布于印度洋和西太平洋的温暖海区,因其身体侧扁,呈带状,尾细长如鞭而得名[1]。由于带鱼捕获后即刻死亡,且产品的加工特性和人们消费习惯的不同,其在运输、加工与贮藏过程中易受细菌与酶的作用而腐败变质,也易发生脂肪氧化酸败[2]。在常规的冷藏条件下,带鱼货架期通常为2~3d,极大程度地限制了水产品的流通运输,使其贮运销售远不能满足人们对产品货架期与品质的要求[3]。近几十年间,国外专家学者先后对新鲜、冷藏过程和腐败鱼类的细菌开展过部分研究工作[4-5],国内也有少部分相关报道。然而长期以来,人们研究微生物多样性只局限于一部分能够分离培养的微生物种类上[6-7],而对其中大量的未培养微生物不能深入研究,研究结果极具片面性,也不能全面反映微生物群落的真实状态。变性梯度凝胶电泳 (DenaturingGradientGel Electrophoresis,DGGE)是目前在国内外应用最广泛的分析微生物群落多样性和监视种群动态的分子指纹技术,它不依赖于培养过程,大大缩短样品的分析时间,而且还能显示环境样品中不可培养微生物的遗传信息。1993年Muzyers等首次将变性梯度凝胶电泳技术应用于分子微生态学研究领域,并证实了这种技术在揭示自然界微生物区系的遗传多样性和种群差异方面具有独特的优越性,可很好反映微生物的多样性[8-10]。该法避免了经典微生物技术在微生物多样性变化研究中的局限性,能更可靠、直接全面地认识微生物组成与有效分析复杂微生物的群落结构,可快速获得环境样品中各种微生物的菌落指纹和特征性核苷酸序列,以确定微生物的多样性及其分类地位,揭示和丰富生态环境的微生物资源[11-12]。Maria B H 等[13-14]采用 PCR- DGGE 技术分别对气调包装的大比目鱼与大西洋真鳕鱼贮藏期间的主要微生物动态变化进行研究,发现假单胞菌(Pseudomonas spp.)为大比目鱼的优势腐败菌,腐败希瓦氏菌(Shewanella putrefaciens)与假单胞菌(Pseudomonas spp.)为大西洋真鳕鱼中的主要优势菌。蔡秋杏等[15]研究了液熏罗非鱼片加工过程中的微生物群落,得出假单胞菌属(Pseudomonas)与弧菌属(Vibrio)细菌都具有使产品腐败的潜能。本文应用PCR-DGGE指纹技术,研究了冷藏带鱼贮藏期间主要优势菌的演替变化规律,为延长水产品货架期提供参考。
1 材料与方法
1.1 材料与仪器
带鱼(Trichiurus haumela) 上海市浦东新区芦潮港码头水产市场,条重0.25~0.50kg,冰藏条件下当日运送至实验室进行实验。EDTA 生工生物工程(上海)有限公司;KCl 天津永大化学试剂开发中心;Na2HPO4上海凌峰化学试剂有限公司;KH2PO4上海高信化玻仪器有限公司;SDS、TAE电泳缓冲液(50×TAE)、Acry-lamide丙烯酰胺、TEMED、引物:V3-1,V3-2,V3-3 生工生物工程(上海)有限公司;NaCl 上海市疾病预防控制中心;TaqDNA酶 日本 TaKaRa BIO株式会社;dNTP Mixture、10×PCR Buffer 日本TaKaRa BIO株式会社;Tris Formamide去离子甲酰胺 北京鼎国生物技术有限公司;Bis-acrylamide(BIO BASIC.INC)、过硫酸铵国药集团化学试剂有限公司;6×Loading Buffer、100bp DNA Ladder、琼脂糖、溴化已锭染色液(EB)、Solarbio SYB Green I核酸染料等。
Gilson微量移液器、凝胶图像成像系统 德国Eppendorf公司;Mini高速离心机 德国Eppendorf公司;D-code system变性梯度凝胶电泳仪 美国BIO-RAD公司;CR21G himac高速冷冻立式离心机
日本 HITACHI;SS-325高压蒸汽灭菌锅 日本SANYO;MDF-U53Y超低温冰箱 日本SANYO;隔水式电热恒温培养箱 上海跃进医疗器械厂;DHG-9053型电热鼓风干燥箱 上海一恒科学仪器有限公司;压力蒸汽灭菌器 上海华线医用核子仪器有限公司;H-1微型混合器 上海康禾光电仪器有限公司;超净工作台 上海博迅实业有限公司;JY2001电子天平 上海精密科学仪器有限公司;pH计 上海精科科学仪器有限公司;DYY-6C型电泳仪 北京市六一仪器厂;TC—24/H(b)型基因扩增仪 杭州博日科技有限公司;QL-81旋涡振荡器 海门市其林贝尔仪器制造有限公司;BCD-205T TCL冰箱TCL集团股份有限公司等。
1.2 实验方法
1.2.1 原料处理 将带鱼洗净,经“三去”处理(去头、去尾、去内脏),无菌操作切成6~7cm长的鱼段,随机分组,放入PE保鲜袋,在(4±1)℃的冰箱中贮藏。
1.2.2 菌落计数 采用有氧平板菌落计数法,分别将第1、3、5、8d 冷藏带鱼的样品按 GBT4789.2-2008法[16]进行处理。每组样品3个重复,选3个合适的稀释度,每个稀释度5组平行,取各稀释菌液0.1mL涂布于TSA培养基上,37℃培养48h后计数。
1.2.3 样品细菌总DNA的提取 无菌条件下取样品10.0g(3次重复),剪碎后放于90.0mL灭菌生理盐水中,转移到均质袋中均质2min,摇床振摇1h,将液体转移至灭菌后的离心管中,4℃,4000r/min离心10min,取上清液于离心管中,4℃,10000r/min离心20min,将沉淀转移至1.5mL离心管。采用SDS化学裂解法提取总基因组DNA[17],并对样品处理阶段作适当改良。
1.2.4 细菌16S rRNA的V3可变区PCR扩增 以提取的细菌总DNA为模板,细菌16S rRNA的V3可变区PCR引物如下:
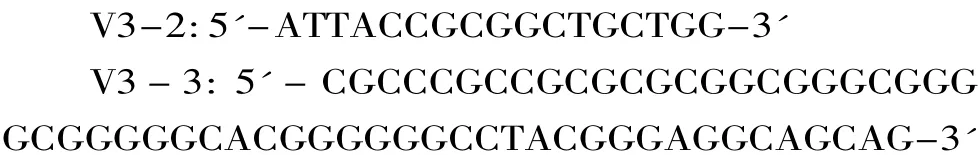
PCR采用25.0μL体系,反应条件为2.5μL 10×PCR buffer;2.0μL dNTP(含 Mg2+);0.3μL TaqDNA酶;1.0μL V3-2;1.0μL V3-3;2.0μL DNA 模板;16.2μL ddH2O。PCR反应步骤为:a.95℃预变性3min;b.95℃变性1min;c.55℃退火1min;d.72℃延伸30s;e.72℃延伸10min;f.10℃保存;重复步骤 b、c、d、e25次。使用1.5%琼脂糖凝胶电泳检验PCR扩增产物,产物约为200bp,获得V3可变区的PCR产物用于DGGE电泳分析,PCR产物置于-20℃下保存备用。
1.2.5 变性梯度凝胶电泳(DGGE) 对细菌16S rRNA的V3区段的扩增产物进行DGGE分析。参照Muyzer[18-21]的方法变性梯度范围为 30% ~60% ,其配制方法见表1,DNA扩增产物上样量为10μL。采用Dcode DGGE系统(Bio Rad)进行电泳,电泳缓冲液为1×TAE缓冲液。
1.2.6 染色 电泳完毕后,用SYB green I(1×TAE,1∶10000)染色30min,弃去浸泡液,再在 ddH2O 中浸泡冲洗5min,通过UVP成像系统进行紫外照相。
1.2.7 DNA回收、纯化和测序[22]使用图像分析软件Image Lab 3.0.1进行条带一致性分析,将DGGE胶片放置于紫外灯下,切下不同位置的条带,分装入1.5mL的离心管中,在50μL的Elution buffer中静置过夜。次日,将离心管在4℃,12000r/min下离心1min,所得的上清液作为模板进行PCR扩增。细菌16S rRNA的V3可变区PCR引物为:

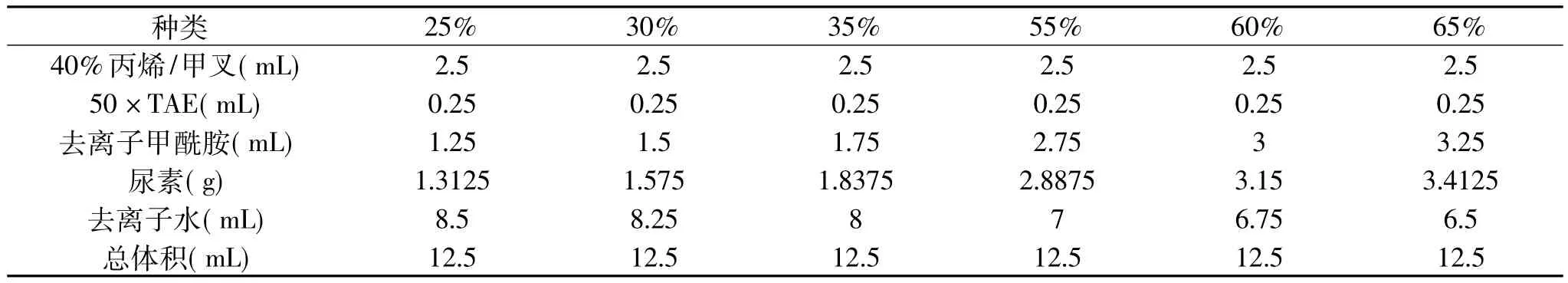
表1 不同浓度梯度变性胶的配制Table 1 Deformation of the different gradient preparation
PCR采用25.0μL体系,反应条件为2.5μL 10×PCR buffer;2.0μL dNTP(含 Mg2+);0.3μL TaqDNA酶;1.0μL V3-2;1.0μL V3-3;2.0μL DNA 模板;16.2μL ddH2O。PCR反应步骤为:a.95℃预变性3min;b.95℃变性1min;c.55℃退火1min;d.72℃延伸30s;e.72℃延伸10min;f.10℃保存;重复步骤 b、c、d、e25次。使用1.5%琼脂糖凝胶电泳检验PCR扩增产物,产物片段大小约为200bp。将其送至上海生工公司进行测序,登录 NCBI(http://www.ncbi.nlm.nih,gov/blast/),将所得序列与数据库中的已知序列进行比对。
2 结果与分析
2.1 冷藏带鱼贮藏期间细菌总数的变化
参照鲜带鱼国标[23]规定,细菌总数≤4lgCFU/g为一级鲜度,4lgCFU/g<细菌总数≤6lgCFU/g为二级鲜度。由表2可见,在冷藏的第3、5d,冷藏带鱼的细菌总数先后超过了一级与二级鲜度,细菌总数分别达到4.23lgCFU/g与6.58lgCFU/g,在冷藏的第8d,其细菌总数高达8.75lgCFU/g,样品已完全腐败。从细菌总数的数值变化程度和趋势来看,符合带鱼在冷藏条件下的腐败规律,所选的时间点具有代表性。

表2 冷藏带鱼贮藏期间的细菌总数变化Table 2 Changes of total viable counts in Trichiurus haumela during cold storage
2.2 细菌16S rRNA的V3可变区PCR扩增结果
以上述提取的微生物总基因组DNA为模板,用16S rRNA的V3可变区引物(带GC夹子)进行PCR扩增,经1.5%琼脂糖凝胶电泳检测,4个样品均获得200bp左右大小的特异性扩增片断,从图1中来看,样品均有较亮的扩增条带,说明本实验选用的PCR扩增条件合适,可用于后期的DGGE电泳分析。
2.3 冷藏带鱼贮藏期间细菌的DGGE图谱分析与割胶测序
采用Dcode DGGE系统(Bio Rad)进行电泳,电泳缓冲液为1×TAE缓冲液,120V电泳4h左右。DGGE图谱如图2所示,3次重复每个取样点的DGGE图谱均无明显差异。
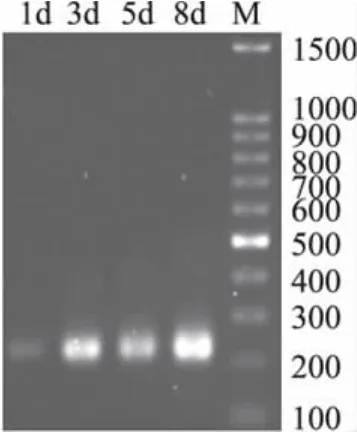
图1 样品中细菌16S rDNA的V3可变区PCR扩增产物电泳图Fig.1 Representative electrophoresis photo of PCR amplification products of V3 regions of sample DNA

图2 冷藏带鱼贮藏期间的细菌DGGE图谱Fig.2 DGGE fingerprinting of PCR productsof Trichiurus haumela stored at 4℃
由图2分析得出:样品在贮藏的第1、3d,微生物条带多,但强度相对较低。其中,条带1在贮藏前期强度明显,条带8随着贮藏时间的延长,强度逐渐增加。第5d时,条带1强度明显减弱,条带8始终保持显著亮度。条带9与条带10在货架期结束时保持较清晰的亮度。4℃条件下,对保藏在离心管中的主要割胶条带进行可变区V3扩增,经PCR扩增后,经1.5%琼脂糖凝胶电泳检测。由于条带12、13与14在割胶回收后没有得到纯的DNA,经PCR扩增后不足以测序用,故后期未获得这些条带的相应序列。
2.4 冷藏带鱼贮藏过程中优势菌的分析
通过对其余割胶回收条带的PCR扩增产物送至上海生工测序,登录NCBI,用BLAST软件将所得序列在Genbank中与参考序列进行相似度比较,分析结果如表3。
DGGE图谱上不同的条带代表不同的微生物种类。由表 3可知,条带 2、5、11分别为假单胞菌(Pseudomonassp.)、嗜水气单胞菌(Aeromonas hydrophila)与杀鱼假交替单胞菌(Pseudoalteromonas piscicida),其相似性在92%~94%,其余细菌相似性均在97%以上。条带6、7经过核苷酸序列比对可知,其为南极细菌属(Moritella)微生物,条带3为假条带号 GenBank登录号 亲缘关系最相似菌株 (%)交替单胞菌属(Pseudoalteromona)微生物。结合图2与表3比较,结果表明:带鱼样品在冷藏过程中,其微生物具有显著的差异性和明显的动态演替规律。

表3 DGGE条带分离的主要细菌16S rRNA部分序列相似性比较Table 3 Comparison of partial 16S rRNA sequencing fragments of dominating microbe similarity from DGGE bands
样品在贮藏第 1d时,主要有嗜冷杆菌(Psychrobactersp.)、嗜水气单胞菌(Aeromonas hydrophila)、荧光假单胞菌(Pseudomonas fluorescens)与弧菌(Vibrio sp.)等不同属种的细菌。第3d时,主要有嗜冷杆菌(Psychrobacter sp.)、南极细菌(Moritella sp.)与荧光假单胞菌(Pseudomonas fluorescens),其中嗜水气单胞菌(Aeromonas hydrophila)受到抑制,条带强度明显减弱。到第5d时,主要有荧光假单胞菌(Pseudomonas fluorescens)与弧菌(Vibrio sp.),嗜冷杆菌(Psychrobacter sp.)已基本抑制。到贮藏的第8d,带鱼样品完全腐败时,条带8、9与10浓度最高,表明3种细菌所占比例相对最大。可见,荧光假单胞菌(Pseudomonas fluorescens)在贮藏期间比例逐渐增大,而希瓦氏菌(Shewanella sp.)与弧菌(Vibrio sp.)虽在初期不占主导,但随着贮藏时间的延长,也逐渐发展成为主要腐败菌,这与Gram[24]等关于特定腐败菌(SSO)的理论相符。另外,在贮藏末期,还检测到条带11的微弱存在,主要是杀鱼假交替单胞菌(Pseudoalteromonas piscicida)。
假交替单胞菌(Pseudoalteromonas sp.)与南极细菌(Moritella sp.)用传统微生物方法培养难度大或不能培养,这就进一步证明了DGGE技术在研究微生物群落和种群多样性方面的优越性。假交替单胞菌(Pseudoalteromonas sp.)主要分布于海洋环境中,其适应机制与存活策略具有多样性和有效性[25]。Torben等采用实时定量PCR技术检测了海洋样品中假交替单胞菌的分布与丰度,结果表明假交替单胞菌在海洋环境中分布的广泛性。南极细菌(Moritella sp.)属菌株嗜盐,生存在寒冷的海洋环境中,兼性厌氧为耐压菌和兼性嗜压深海菌[26]。由于PCR扩增产物片段大小仅为200bp,因此多数细菌仅能比对鉴定到属,Shewan等[27]认为以食品保藏为目的的菌相分析将细菌种类分类到属已经足够,通过DGGE指纹技术则能清楚了解冷藏带鱼贮藏过程中主要优势菌的种类与分布状况。
3 结论
受到产品加工特性的限制,带鱼冷藏期间的腐败问题一直困扰着广大水产品生产加工企业。本研究采用PCR-DGGE指纹技术,对冷藏带鱼贮藏期间主要优势菌的分布状况进行了动态监测,并对其微生物群落结构进行分析。从中发现,嗜冷杆菌(Psychrobacter sp.)为带鱼贮藏初期的优势菌,荧光假单胞菌(Pseudomonas fluorescens)在贮藏期间比例逐渐增大。希瓦氏菌(Shewanella sp.)与弧菌(Vibrio sp.)的比例明显增加,在贮藏后期也发展成为优势腐败菌。在有氧冷藏的水产品中,腐败菌主要为嗜冷性非发酵革兰氏阴性杆菌。大多数产品中,假单胞菌、腐败希瓦氏菌占绝对优势[28]。其中,假单胞菌是一类严格好氧且适应能力极强的致腐菌,在有氧条件下,假单胞菌能迅速分解蛋白质,生长速率也显著优于其他类细菌,是水产品的特定腐败微生物[29-30]。腐败希瓦氏菌大量存在于水和土壤中,水产品中携带较多,此前也将希瓦氏菌属归类到假单胞菌属,被称为腐败交替假单胞菌。弧菌属细菌多数存在于水生环境,尤其是海洋环境,为水产品中常见的一类菌。PCR-DGGE技术在食品微生物领域中具有较好的应用前景,它能快速监测食品成熟阶段微生物的情况,评价产品中的微生物群落,并可根据环境变化分析食品中菌群的动力学规律,能大大提高微生物多样性分析的准确性和真实性[31]。虽然其本身存在着一些不足,但由于该技术重复性高,且快速简单等优点,能完全弥补传统分离鉴定方法的不足,现已发展成为微生物学领域的重要研究手段。
[1]沈月新.水产食品学[M].北京:中国农业出版社,2001:23-24.
[2]丁仲田 .带鱼的氧化与黄变[J].肉品卫生,1996,12:14-17.
[3]Surendran P K,Joseph J,Shenoy A V,et al.Studies on spoilage of commercially important tropical fishes under iced storage[J].Fisheries Research,1989(7):1-9.
[4]Gram L,Huss H H.Microbiological spoilage of fish and fish products[J].International Journal of Food Microbiology,1996,33:121-137.
[5]Gillespie N C,Macrae I C.The bacterial flora of some Queensland fish and its ability to cause spoilage[J].Journal of Applied Bacteriology,1975,39:91-100.
[6]AmannR I,LudwigW,SchleferK H.Phylogenetic identification and in situ detection of individual microbial cells without cultivation[J].Microbial Reviews,1995,59:143-169.
[7]Pace N R.A molecular view of microbial diversity and the biosphere[J].Science,1997,276:734-740.
[8]Muyzer G,De Waal E C,Uitterlinden A G.Profiling of complex microbialpopulations by denaturing gradientgel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J].Applied of Environment Microbiology,1993,59:695-700.
[9]Gurtler V,Garrie H D,Mayall B C.Denaturing gradient gel electrophoretic multilocussequence typing ofStaphylococcus aureus isolates[J].Electrophoresis,2002,23:3310-3320.
[10]Theelen B,Silvestri M,Gueho E,et al.Identification and typing of Malassezia yeasts using amplified fragment length polymorphisms(AFLP),random amplified polymorphic DNA(RAPD)and denaturing gradient gel electrophoresis(DGGE)[J].FEMS Yeast Research,2001(1):79-86.
[11]马俊孝,季明杰,孔健.PCR-DGGE技术在微生物物种多样性研究中的局限性及其解决措施[J].食品科学,2008,29(5):493-497.
[12]高菲,孙慧玲,许强,等.刺参消化道内含物细菌群落组成的PCR-DGGE 分析[J].中国水产科学,2010,17(4):671-680.
[13]Maria B H,Morten S,Bjorn T L,et al.Characteriasation of the dominantbacterialpopulation in modified atmosphere packaged farmed halibut(Hippoglossus hippoglossus)based on 16S rDNA-DGGE[J].Food Microbiology,2007,24:362-371.
[14]Maria B H,Bjorn T L,Morten S,et al.Characterisation of the bacterial flora of modified atmosphere packaged farmed Atlantic cod(Gadus morhua)by PCR-DGGE of conserved 16S rRNA gene regions[J].International Journal of Food Microbiology,2007,117:68-75.
[15]蔡秋杏,李来好,陈胜军,等.液熏罗非鱼片加工过程中微生物群落的 PCR-DGGE 分析[J].食品科学,2009,30(23):35-40.
[16]GBT 4789.2-2008,食品卫生微生物学检验——菌落总数测定[S].
[17]萨姆布鲁克,拉塞尔.分子克隆实验指南[M].第三版,北京:科学出版社,2002.
[18]Muyzer G.DGGE/TGGE a method for identifying genes from natural ecosystems[J].Current of Opinion Microbiology,1999,2:317-322.
[19]Muyzer G,Smalla K.Application of denaturing gradient gel electrophoresis(DGGE) and temperature gradient gel electrophoresis(TGGE)in microbial ecology[J].Antonie Van Leeuwenhoek,1998,73:127-141.
[20]Blixt Y,Borch E.Comparison of shelf life of vacuum-packed pork and beef[J].Meat Science,2002,60:371-378.
[21] NübelU,Engelen B,Felske A,etal.Sequence heterogeneities of genes encoding 16S rRNAs in Paenibacillus polymyxa detected by temperature gradient gel elelectrophoresis[J].Journal of Bacteriology,1996,178:5636-5643.
[22]何丽明,李志勇,吴杰,等.基于PCR-DGGE指纹的南海海绵共附生细菌优势种群的揭示与系统发育分析[J].微生物学报,2006,3(46):487-491.
[23]中华人民共和国农牧渔业部.SC128-84.中华人民共和国农牧渔业部部标准——鲜带鱼[S].1984.11.
[24]Gram L,Dalgaard P.Fish spoilage bacteria-problems and solutions[J].Current Opinion in Biotechnology,2002,13:262-266.
[25]席宇,朱大恒,刘红涛,等.假交替单胞菌及其胞外生物活性物质研究进展[J].微生物学通报,2005,32(3):108-112.
[26]杨秀霞.南极细菌Moritella sp.低温脂肪酶基因的克隆与表达[D].青岛:中国海洋大学,2004.06.
[27]Shewan J M.The microbiology of fish and fishery products-a progress report[J].Applied Microbiology,1971,34:299-315.
[28]许钟,肖琳琳,杨宪时.罗非鱼特定腐败菌生长动力学模型和货架期预测[J].水产学报,2005,29(4):540-546.
[29]刘寿春,周康,钟赛意,等.淡水养殖罗非鱼中病原菌与腐败菌的分离与鉴定初探[J].食品科学,2008,29(5):327-331.
[30]许钟,杨宪时,郭全友,等.波动温度下罗非鱼特定腐败菌生长动力学模型与货架期预测[J].微生物学报,2005,45(5):798-801.
[31]高蕙文,吕欣,董明盛.PCR-DGGE指纹技术在食品微生物研究中的应用[J].食品科学,2005,26(8):465-468.
PCR-DGGE analysis on the dynamic changes of microorganisms in cutlassfish(Trichiurus haumela)under the cold storage
LAN Wei-qing,XIE Jing*
(College of Food Science and Technology,Shanghai Ocean University,Shanghai Engineering Research Center of Aquatic Product Processing & Preservation,Shanghai 201306,China)
In this paper,the main microbe dynamic changes of cutlassfish(Trichiurus haumela)were studied under the cold storage(4±1)℃ so as to provide the experimental references for extending its shelf-life.The total bacterium DNA of Trichiurus haumela were extracted by SDS(Sodium Dodecyl Sulfate)pyrolysis method and the PCR amplification of V3 variable region of 16S rRNA were taken in order to get the dynamic changing fingerprint spectra by DGGE technology.It was claimed that there were abundant microbial population on the products in the initial stage and Psychrobacter sp.was the main bacterium firstly.The proportion of Pseudomonas fluorescens was increased from the initial periods.With the extension of storage time,the proportion of Shewanella sp.and Vibrio sp.also increased gradually and they took the place of Psychrobacter sp.to be the dominant bacteria finally.
TS254.1
A
1002-0306(2012)15-0118-05
2012-02-13 *通讯联系人
蓝蔚青(1977-),男,博士,助理研究员,研究方向:食品冷冻冷藏学。
“十二五”国家支撑计划项目(2012BAD38B09);上海市科委工程中心建设(11DZ2280300);上海海洋大学博士启动基金(A-2400-11-0202);上海市教育委员会重点学科建设项目(J50704)。

