不同对虾中多酚氧化酶的提取比较及在虾体的分布研究
吴亮亮,杨会成,廖妙飞,钟明杰,郝云彬,郑 斌,*
(1.浙江海洋学院食品医药学院,浙江舟山 316000;2.浙江省海洋开发研究院,浙江舟山 316100)
不同对虾中多酚氧化酶的提取比较及在虾体的分布研究
吴亮亮1,杨会成2,廖妙飞2,钟明杰2,郝云彬2,郑 斌2,*
(1.浙江海洋学院食品医药学院,浙江舟山 316000;2.浙江省海洋开发研究院,浙江舟山 316100)
用丙酮法和匀浆浸提法分别对南美白对虾和中华管鞭虾进行多酚氧化酶的提取,结果表明,在同样的提取条件下,中华管鞭虾的酶活大于南美白对虾,匀浆浸提法提取的酶活比丙酮法高1.5倍;同时对中华管鞭虾的提取条件料液比、缓冲液pH、浸提时间、水浴温度做了研究,通过正交实验得到当料液比1∶4,缓冲液pH8,浸提时间3h,水浴温度45℃条件下提取的酶具有最大的活性;进一步研究中华管鞭虾的多酚氧化酶在虾体中的分布情况,得出虾头部位多酚氧化酶含量较高,虾尾和虾身含量较低。
对虾,多酚氧化酶,酶活力,酶分布
酚氧化酶(Phenoloxidase,PO),又称多酚氧化酶(Polyphenoloxidase,PPO)或酪氨酸酶(Tyrosinase)[1]。它分布很广,在微生物、植物、动物和人体中都有存在。研究发现,该酶是生物体合成黑色素的关键酶[2]。而虾褐变的主要原因是多酚氧化酶在有氧条件下催化体内的L-多巴和酪氨酸转化为多巴色素和其他发色基团,进一步氧化形成黑色素物质,因此对PPO的研究日益引起国内外学者的关注。我国是虾类养殖和捕捞大国,仅2010年对虾养殖产量就已达116万t,约占世界对虾产量的43.7%,仍有增长的趋势。2008年我国出口到美国的对虾数量已占据第四位,但由于虾类黑变严重以及违法添加剂的过量使用,引起虾体品质下降,有害残留物超标,导致其价格在亚洲的对虾输出国中垫底,仅为4766美元/t,比美国的进口对虾平均价格低31%,出口日本的对虾价格也比市场平均价格低27%。因此,虾类的黑变抑制和鲜度维持,直接关系到我国的出口创汇以及人们的食用安全。国内外大量研究表明,虾类的黑变与自身所携带的多酚氧化酶密切相关,因此,研究海水虾类PPO分布规律以及黑变机理,对于延长海水甲壳类货架期,实现优质优价具有重要意义。本文以南美白对虾和中华管鞭虾为原料,研究其PPO的提取方法和最佳提取条件,以及PPO在中华管鞭虾体的分布情况,为进一步研究虾类的褐变原理以及褐变的有效抑制提供依据。
1 材料与方法
1.1 材料与仪器
新鲜的南美白对虾、中华管鞭虾 购自舟山北门菜场,大小均匀,带回实验室存于-18℃冰箱中;L-3-(3,4-二羟基苯基)-2-甲基丙氨酸(L-DOPA) 上海安谱科学仪器公司;三(羟甲基)氨基甲烷、丙酮(分析纯) 国药集团化学试剂有限公司。
UV-2102C型紫外可见分光光度计 上海仪器有限公司;电热恒温水浴锅 上海分析仪器厂;CR21G冷冻离心机 日本日立。
1.2 实验方法
1.2.1 提取方法的选择 丙酮法[3-4]:称取半解冻后的虾(带头)20g,加入80mL预冷至-18℃的丙酮(W/V= 1∶4),用高速组织匀浆机打碎,真空抽滤(0.5MPa),然后用冰丙酮反复冲洗残渣,冷冻干燥得丙酮粉。取5g丙酮粉加入500mL pH8.0的预冷Tris-HCl缓冲液,磁力搅拌20min,然后在转速12000r/min,温度4℃条件下,冷冻离心10min,所得上清液即为粗酶液。样品加入2.5mL的L-3-(3,4-二羟基苯基)-2-甲基丙氨酸(L-DOPA),45℃水浴10min,在490nm处比色测定吸光值。
匀浆浸提法[4]:称取半解冻后的虾(带头)20g,与80mL pH8.0的Tris-HCl(W/V=1∶4)混合后,4℃下破碎成肉糜,静置3h,然后于4℃,12000r/min条件下,冷冻离心10min,后取其上清液,作为粗酶液。样品加入2.5mL的L-DOPA,45℃水浴10min,在490nm处比色测定吸光值。
1.2.2 提取条件的筛选 按照上述1.2.1中最佳提取方法,选择料液比、pH、浸提时间、水浴温度4个因素作为优化提取条件的效应因子,并逐一研究。
1.2.2.1 料液比对提取酶活的影响 固定其他条件,分别加入pH8.0的预冷Tris-HCl缓冲液20、40、60、80、100mL,最后比色测定吸光值。
1.2.2.2 缓冲液pH对提取酶活的影响 固定其他条件,分别加入pH为6.0、7.0、8.0、9.0、10.0的预冷Tris-HCl缓冲液80mL,最后比色测定吸光值。
1.2.2.3 浸提时间对提取酶活的影响 固定其他条件,分别静置浸提2、3、4、5、6h,最后比色测定吸光值。
1.2.2.4 水浴温度对提取的影响 固定其他条件,分别在25、35、45、55、65℃水浴,最后比色测定吸光值。
1.2.3 正交实验 采取4因素3水平正交实验设计,研究料液比、缓冲液pH、浸提时间、水浴温度4个变量对中华管鞭虾的PPO提取效果的影响,并依次设定A、B、C、D,按正交表L9(34)安排实验,各因素正交水平如表1。
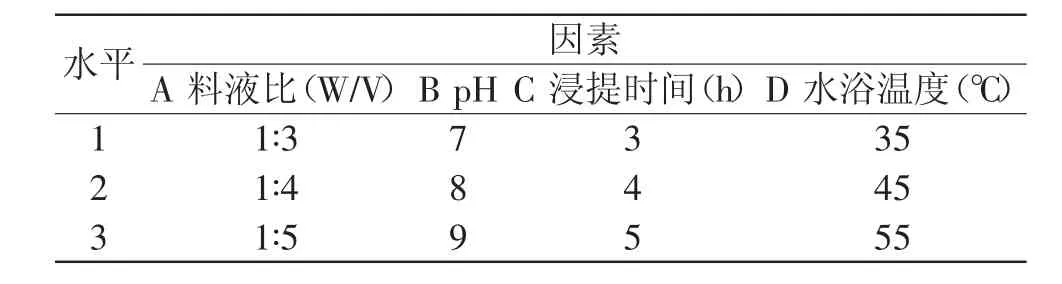
表1 正交实验因素水平表Table 1 Factor list of orthogonal experiment
1.2.4 PPO在中华管鞭虾体分布研究 分别取中华管鞭虾的虾头、虾身、虾尾各20g左右,按照1.2.1中匀浆浸提法,比色测定不同部位的酶的酶活[5]。
蛋白质浓度的测定[6-7]:称取10mg牛血清白蛋白,溶于蒸馏水中并定容至100mL,制成100μg/mL的标准蛋白质溶液。称取100mg考马斯亮蓝G-250,溶于50mL 95%乙醇中,加入85%(m/v)的磷酸100mL,最后用蒸馏水定容到1000mL,制成考马斯亮蓝G-250试剂。
绘制标准曲线,同时准确吸取1.0mL样品溶液于一支干燥洁净的试管中,加入考马斯亮蓝G-250试剂5mL,摇匀,室温静置2min,以标准曲线1号管为对照,用分光光度计在595nm处比色,记录吸光值,计算结果。
1.2.5 酶活 每分钟吸光值增加0.001定义为1个酶活力单位(A490×103/min)[8]。
2 结果与讨论
2.1 PPO提取方法的选择
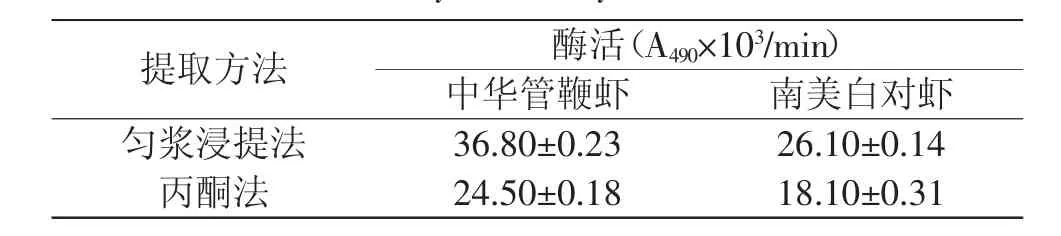
表2 两种提取方法酶活的对比Table 2 Contrast of enzyme activity on two extraction methods
通过表2可以看出,采用匀浆浸提法提取的两种虾中PPO的酶活都比丙酮法提取的结果高,其中匀浆浸提中华管鞭虾和南美白对虾得到的PPO的酶活分别是丙酮法的1.5倍和1.4倍。并且无论采用哪种方法提取PPO,中华管鞭虾的酶的酶活均高于南美白对虾。因此后续实验均采用中华管鞭虾做PPO的提取对象。
2.2 匀浆浸提法最佳提取条件的选择
2.2.1 料液比对提取PPO活性的影响 由图1可以看出,酶的活性随着缓冲液体积的增大而增大,在缓冲液体积为80mL,即料液比1∶4时达到最大值,原因可能是缓冲液体积较少时,不能够与样品充分接触,提取的酶较少;当缓冲液超过80mL时,缓冲液过多,稀释了酶液,从而导致酶的浓度降低。
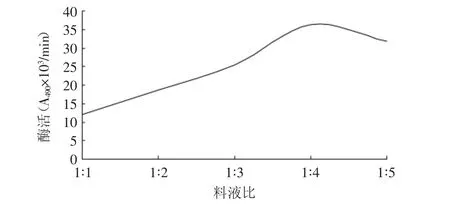
图1 料液比对提取PPO的影响Fig.1 The effect of different ratio of sample weight to the solvent volume on extraction
2.2.2 缓冲液pH对提取PPO活性的影响 从图2中可以看出,当缓冲液pH为8时,提取的PPO的酶活最大,此时酶活为36.9A490×103/min;当缓冲液pH高于8或者低于8时,提取的PPO酶活都会降低。原因可能是PPO催化底物反应需要适宜的pH,高于或低于此pH都会影响PPO的活性。
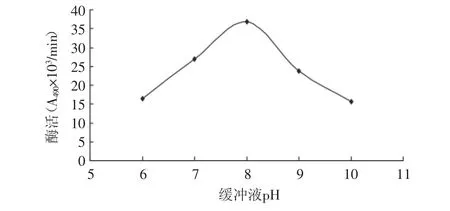
图2 缓冲液pH对提取的影响Fig.2 The effect of different pH on extraction
2.2.3 浸提时间对提取PPO活性的影响 由图3可以看出,总趋势是酶的活性随着浸提时间的延长而逐渐增大,在2~4h区间内,随着浸提时间的延长,酶的活性增大较快,这段时间可能是匀浆后的原料虾中的PPO浓度比缓冲液中的高,所以能不断地溶于缓冲液中,从而使浸提效率不断升高;浸提4h之后,酶的活性略有下降,一方面可能是缓冲液提取的PPO速率达到一个平衡,另一方面可能是由于环境等其他原因导致PPO分子结构被破坏,从而使整体的酶的活性略有降低。
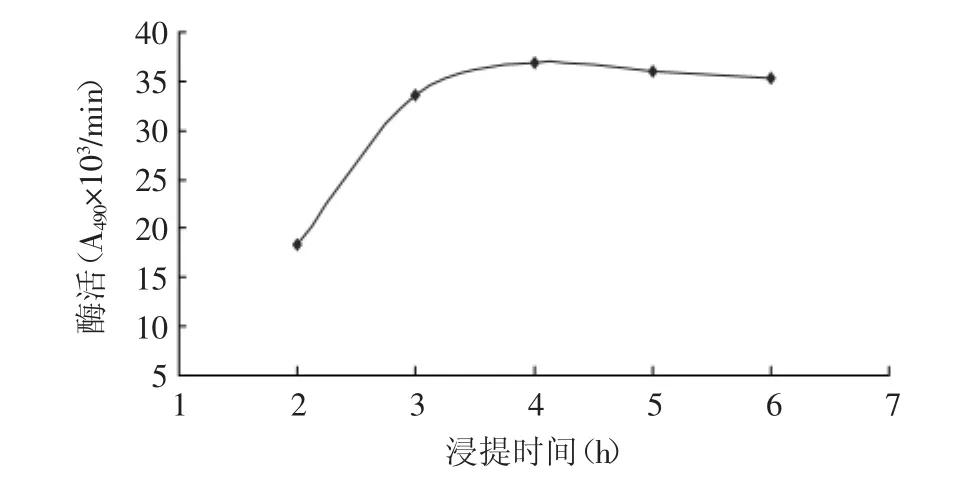
图3 浸提时间对提取的影响Fig.3 The effect of different extraction time on extraction
2.2.4 温度对提取PPO活性的影响 从图4可以看出,随着温度的升高,酶活先升高后降低,在45℃酶活达到最大34.5A490×103/min,当温度高于45℃时,酶的活性很快降低。当温度在25~45℃范围内,温度较低,酶的活性不高;在达到45℃时,接近于酶的最适温度,发挥最大活性;当超过45℃时,酶活会降低;当温度达到65℃,酶由于高温导致失活,活性迅速降低。

图4 温度对提取的影响Fig.4 The effect of different temperatures on extraction
2.3 正交实验结果
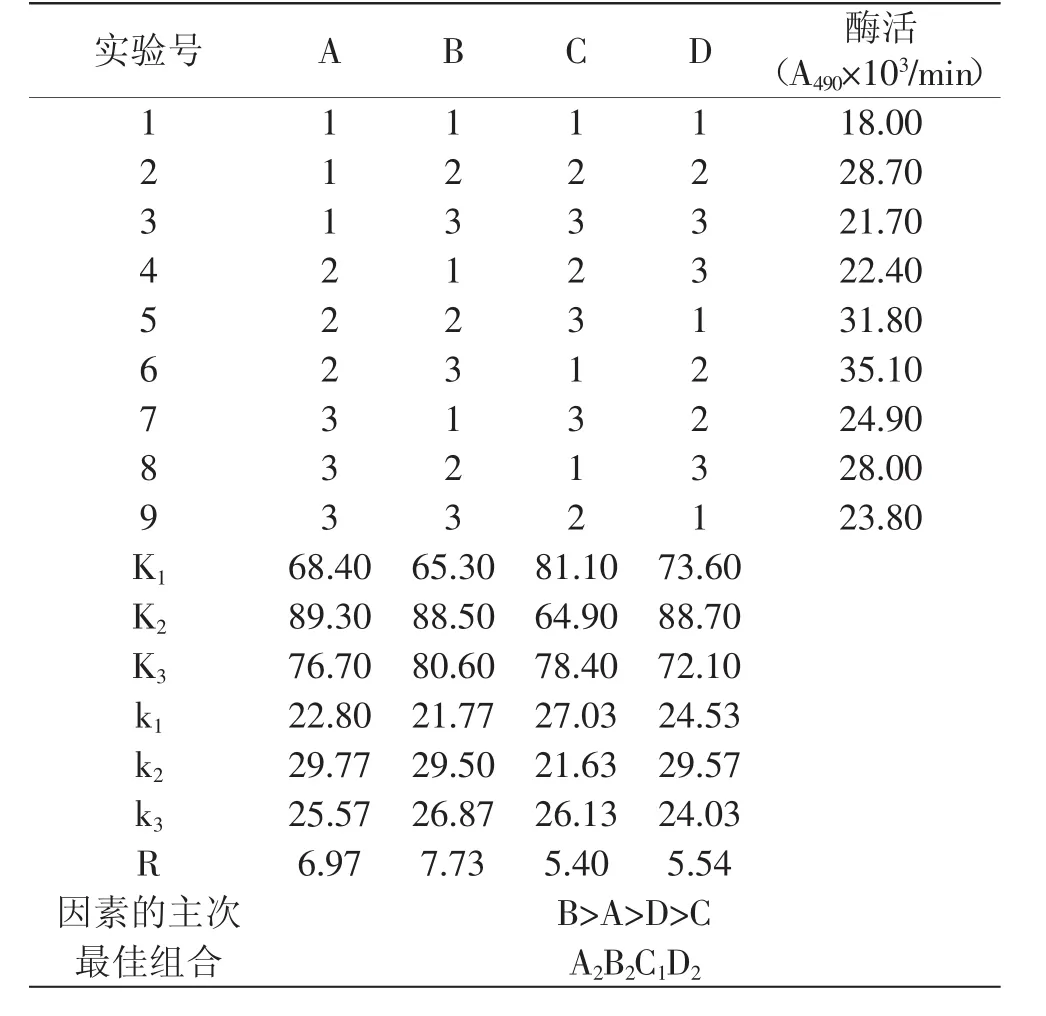
表3PPO提取正交实验结果Table 3 Result of the orthogonal test
由表3可知,4个因素对PPO提取的影响顺序是B> A>D>C,由K值和极差值R可知,在料液比1∶4、缓冲液pH8.0、浸提3h、水浴温度45℃条件下,提取的酶活最大,重复三次平行实验验定此条件下的酶活为35.80、38.20、37.70A490×103/min,平均值为37.23A490×103/min。这与单因素实验稍有不同的是浸提时间,由于浸提时间极差值最小,对PPO的提取影响较小,而且浸提时间过长导致酶暴露于细胞外时间过长,活性有所降低,所以考虑实验的各种因素,浸提时间可定为3h。
2.4 PPO在中华管鞭虾中的分布
2.4.1 考马斯亮蓝法测蛋白质标准曲线

图5 蛋白质标准曲线Fig.5 Protein standard curve
2.4.2 PPO在中华管鞭虾体分布实验结果 从表4可以看出,从虾头提取的PPO的酶活最大,酶的比活力也最大,可以初步得出PPO在虾头的含量最大,虾身和虾尾提取的PPO的酶活要低一些,且虾尾的PPO的酶活和比活力都高于虾身。而实际生产中,虾死亡后最开始黑变的部位是头部,接着肌肉变软,各种微生物入侵虾体,在多种酶和微生物的作用下虾体开始腐败,随后尾部逐渐出现黑色斑点,壳肉逐渐脱离,最后是虾身变黑[9-10]。这与实验所得出的PPO在整虾的分布基本相符合,可以初步判断PPO主要集中在头尾,虾身部分比较少,活性较低。因此,今后对PPO的研究实验将更多地集中在虾头部分。
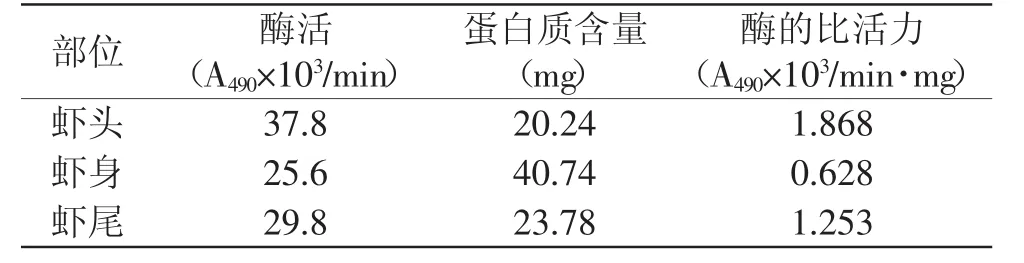
表4 PPO在中华管鞭虾体分布结果Table 4 The distribution of PPO in solenocera crassicornis
3 结论
3.1 通过对南美白对虾和中华管鞭虾PPO的提取方法的研究,可以看出用匀浆浸提法提取的酶活较高,丙酮提取法对PPO的分子结构有一定的破坏作用。
3.2 中华管鞭虾匀浆浸提法最佳条件为:料液比1∶4,缓冲液pH8.0,浸提时间3h,水浴温度45℃,此条件下PPO的酶活最大为37.23A490×103/min。
3.3 中华管鞭虾PPO主要分布于虾头,提取的酶活和比活力最大,其次是虾尾,虾身酶活和比活力最低。对虾类黑变主效应因子多酚氧化酶提取及分布规律的研究,将为后续保鲜剂的开发以及实际生产过程中的防护起到积极作用。
[1]MW Johansson,K Soderhall.Cellular immunity in crustaceans and the pro PO system[J].Parasitology Today,1989(5):171-176.
[2]Soderhall K,Cerenius L.Role of the prophenoloxidaseactivating system in invertebrate immunity[J].Current Opinion in Immunology,1998(10):23-28.
[3]余华,周洪波,何龙海,等.茄子多酚氧化酶的酶学特性研究[J].食品科学,2003(12):44-46.
[4]陈丽娇,郑明峰,李怡宾.南美白对虾多酚氧化酶的生化特性[J].福建农林大学学报:自然科学版,2004,3(9):377-380.
[5]赵娇,赵福昌.对虾中酚酶活性部位及稳定性分析[J].职业与健康,2000,12(12):37-38.
[6]Alexander R R,Grififiths J M.Basic bochernical methods[J]. J Blod Chem,1985:14-16,48-49.
[7]Lowry O H,Rosebrough N J,Fovrr A L,et al.Protein measurement with the Folin phenol reagent[J].J Blod Chem,1951:265-275.
[8]樊延俊,汪小锋.中国对虾酚氧化酶的分离纯化及其部分生物化学性质[J].生物化学与生物物理学报,2002,34(5):589-594.
[9]陈佳荣,王以农.若干水产品变化鲜度的研究[J].福建水产,1993(4):39-44.
[10]须山三千三,鸿巢章二.水产食品学[M].上海:上海科学技术出版社,1992:69-70.
Study on extraction of polyphenoloxidase and enzyme distribution on different shrimps
WU Liang-liang1,YANG Hui-cheng2,LIAO Miao-fei2,ZHONG Ming-jie2,HAO Yun-bin2,ZHENG Bin2,*
(1.School of Food and Pharmacy&Medical School,Zhejiang Ocean University,Zhoushan 316000,China;2.Zhejiang Marine Development Research Institute,Zhoushan 316100,China)
Extraction of polyphenoloxidase from penaeus vannamei and solenocera crassicornis were studied using two methods,acetone method and homogenate method.It was found that the activity of polyphenoloxidase in solenocera crassicornis was higher than that in penaeus vannamei under the same extraction condition.The enzyme activity extracted by homogenate method was 1.5 times higher than acetone method.Orthogonal test result showed that the optimal extraction conditions were as follows:Solid to solvent ratio 1∶4,pH8.0,extraction time 3h,extraction temperature 45℃.And the distributed rule of polyphenoloxidase in solenocera crassicornis was studied.The results indicated that polyphenoloxidase activity was higher in the part of prawn’s head than that in the part of body and trail.
shrimp;polyphenoloxidase;enzyme activity;enzyme distribution
TS254.1
A
1002-0306(2012)07-0055-04
2011-05-02 *通讯联系人
吴亮亮(1986-),男,硕士研究生,研究方向:水产品加工与应用。
国家国际科技合作专项(2010DFB33030);浙江省重点科技创新团队项目(2011R09031);浙江省优先主题重点农业项目(2009C12008);“十二五”国家科技支撑计划项目子课题(2012BAD29B06)。

