高碘酸钠氧化法固定化磷脂酶A1的研究
于殿宇,马 莺,刘 晶,张佳宁,李 琳
(1.哈尔滨工业大学食品科学与工程学院,黑龙江哈尔滨 150090;2.东北农业大学食品学院,黑龙江哈尔滨 150030)
高碘酸钠氧化法固定化磷脂酶A1的研究
于殿宇1,2,马 莺1,*,刘 晶2,张佳宁2,李 琳1
(1.哈尔滨工业大学食品科学与工程学院,黑龙江哈尔滨 150090;2.东北农业大学食品学院,黑龙江哈尔滨 150030)
研究了高碘酸钠氧化法在纤维素滤纸膜载体上固定化磷脂酶A1的最佳条件。结果表明,以固定化酶活力为指标,当高碘酸钠浓度为0.15mol/L,活化80min,与浓度为0.05g/mL酶的磷酸盐缓冲溶液(pH为5.8)于戊二醛浓度0.4%、温度4℃交联4h,获得的固定化磷脂酶A1酶活最高为4.8U/cm2。固定化酶膜的酶学性质为:最适温度35℃;最适pH为9.0。与游离酶相比,pH向碱性偏移1.0;经7次重复使用后,固定化酶膜活力为原酶活的65%以上。SEM结果显示,经高碘酸钠氧化后的纤维素滤纸膜能较好地固定磷脂酶A1。
磷脂酶A1,高碘酸钠氧化法,固定化,纤维素滤纸膜,酶活
磷脂酶A1是一类可以水解磷脂Sn-1位酯键获得2-酰基-溶血磷脂和脂肪酸的酶,广泛存在于动植物和微生物中[1]。游离磷脂酶A1价格昂贵,不易回收,催化水解时条件苛刻。磷脂酶A1不仅具有脂肪酶活性,而且还同时具有磷脂酶活性,但是在一定的反应体系中,会优先表现出一种特定的酶活,价格低廉的磷脂酶A1在工业上具有巨大的应用价值[2]。最早将酶法脱胶用于大工业生产的是德国Lurgi公司,称为“EnzyMax process”,国内也进行了相关的研究,当时采用的是一种猪胰脏来源的磷脂酶A2,由于该酶必须以Ca2+为激活剂,且来源有限,价格昂贵,而且在脱胶效果上尚存在一些不足,该方法一直未进行大规模推广。随后Novozymes公司推出了一种适合油脂脱胶的微生物来源的磷脂酶A1Lecitase Novo,该酶具有A1位专一性,无需Ca2+、成本低、来源广、生产控制简单,非常适合进行大工业推广[2]。由于直接利用自然酶进行工业化生产一般是不可行的,自然酶混溶在反应体系中不仅不易分离回收,而且酶的制取一般较困难,且成本高昂,难以反复或连续使用,为了解决上述问题,固定化酶技术越来越受到人们的关注[3]。固定化酶技术是通过物理和/或化学作用将水溶性的游离酶分子束缚在一定的区间内(通常在非水溶性载体上),用简单的分离方法(如离心沉降)即可回收并反复使用,这样改良的酶即称为固定化酶。固定化酶的制备、结构与性质及固定化酶反应器的研制、生产,是固定化酶体系的主要内容[4-6]。固定化酶技术现在已经成为酶工程领域中最为活跃的研究方向之一,因此对固定化酶的研究也就越来越多[7-9]。常用的固定化方法主要有四种,即包埋法、交联法、吸附法和共价法[10]。目前,国内外关于磷脂酶A1的固定化研究很少,且相关的应用研究主要集中在酶法脱胶方面[11-12]。酶可以通过吸附法固定在膜上,但吸附法固定的酶不牢固,易流失。化学交联法是通过共价键达到载体与酶结合的目的,因而固定的酶比较牢固。由于表面含有大量的羟基,容易改性而与酶共价结合,因此,纤维素是固定化酶的良好载体,被广泛地应用于固定化酶和作为色谱支持物来分离和纯化敏感的生物活性物质[13]。本试验采用传统固定化酶方法交联法固定化磷脂酶A1。由于纤维素滤纸膜的纤维状较为松散,不利于酶的固定,而且纤维表面没有大量的醛基吸附固定酶分子,因此,本实验先用高碘酸钠将纤维素滤纸膜氧化后,再进行酶的固定化。由于高碘酸钠具有一定的氧化作用,可将纤维素滤纸膜表面的羟基氧化成醛基,因此,采用高碘酸钠氧化活化后的纤维素滤纸膜作为固定化磷脂酶A1的载体,以确定最佳的高碘酸钠氧化浓度及活化时间、酶液添加浓度及戊二醛使用浓度和交联反应的时间等固定化因素;最后,在反应的过程中确定了最佳的固定化磷脂酶A1条件,并由SEM扫描进一步验证了固定化酶膜有较好的稳定性。
1 材料与方法
1.1 材料与仪器
Lipase Ultral磷脂酶A1诺维信公司;粉末磷脂 天津博帅工贸有限公司;高碘酸钠、氢硼化钠 分析纯,广东东莞市大岭山公司;磷酸氢二钠 天津市光复精细化工研究所;柠檬酸 天津市东丽区天大化学试剂厂;聚乙烯醇 国药集团化学试剂有限公司;其余试剂 均为分析纯。
磁力搅拌器85-2型 江苏中大仪器厂;LG10-2.4A型高速离心机 北京市医用离心机厂;电子天平 梅特勒-托利多仪器(上海)有限公司。
1.2 实验方法
1.2.1 高碘酸钠氧化法[14-15]取一张膜悬浮于10mL不同浓度的高碘酸钠溶液中,室温下置于摇床中摇动一定时间,取出立即用去离子水洗至中性,吸干水分,与酶的磷酸盐缓冲溶液于28℃进行交联反应。交联反应后取出,悬浮于10mL 1%氢硼化钠溶液中,于4℃反应30min,然后用2mol的KCl(氯化钾)溶液和水分别洗涤三次,取出测定酶活。
1.2.2 游离磷脂酶酶活测定[16]测定固定化酶酶活时将已固定化酶的滤纸剪碎,平均分成两份,其中一份做空白,余下部分与游离酶测定方法一致。
2 结果与分析
2.1 高碘酸钠氧化法固定化磷脂酶的影响因素
2.1.1 高碘酸钠的浓度和活化时间的确定 考察了在不同浓度的高碘酸钠氧化作用下活化时间对固定化酶活力的影响,如图1所示。
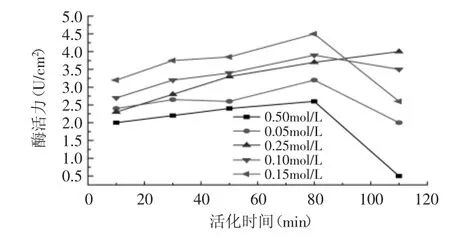
图1 不同高碘酸钠浓度下活化时间对酶活力的影响Fig.1 Effect of activated under the different NaIO4 concentrations on activity of immobilized PLA1
由图1可知,当NaIO4(高碘酸钠)浓度为0.15mol/L,活化时间为80min时,所获得的固定化酶的酶活最高,而随着活化时间的延长,固定化酶的活力减弱。氧化程度通常由膜表面上的羟基被氧化成醛基的量来表示。由于纤维素滤纸膜表面有大量的羟基,易于高碘酸钠氧化羟基成醛基,利于下一步的交联反应,因此选择高碘酸钠浓度为0.15mol/L,活化时间为80min时最佳。
2.1.2 磷脂酶A1浓度的确定 将氧化活化后的纤维素滤纸膜悬浮于不同酶浓度的磷酸盐缓冲液中,于4℃进行交联反应,考察了不同酶液浓度对固定化酶活力的影响,如图2所示。
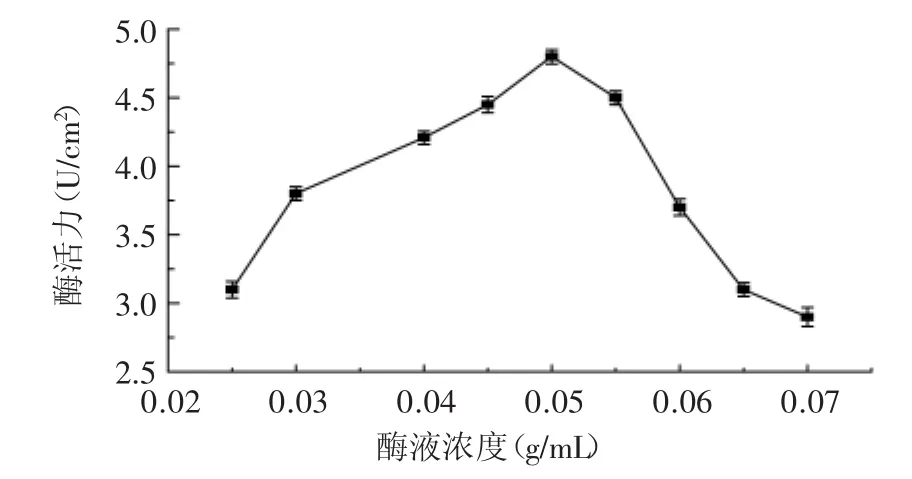
图2 酶液浓度对酶活力的影响Fig.2 Effect of free enzyme concentrations on activity of immobilized PLA1
由图2可知,随着磷脂酶液浓度的增加,酶活力逐渐增加,当酶液浓度为0.05g/mL时,酶活力最高,再继续增大酶液浓度反而使酶活力降低,所以选择酶液浓度为0.05g/mL为最佳。
2.1.3 戊二醛浓度的确定 选择不同浓度的戊二醛作为交联剂,考察了不同交联剂浓度对固定化酶活力的影响,如图3所示。
由图3可知,随着戊二醛浓度增加,固定化酶活力先增加,后降低。这是因为戊二醛浓度增加时,戊二醛和磷脂酶发生交联反应,酶流失减少,所以活力也随之增加;但进一步增加戊二醛浓度将导致酶活力下降,这是因为酶分子活性基团被戊二醛过多的修饰,导致酶活力降低,所以戊二醛的最佳浓度为0.4%。
2.1.4 交联时间的确定 以不同交联时间来对酶进行固定化,考察了不同固定化时间对固定化酶活力的影响,如图4所示。
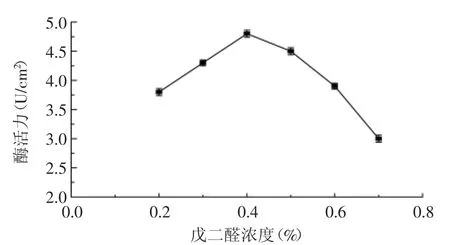
图3 戊二醛浓度对酶活力的影响Fig.3 Effect of glutaraldehude concentration on activity of immobilized PLA1
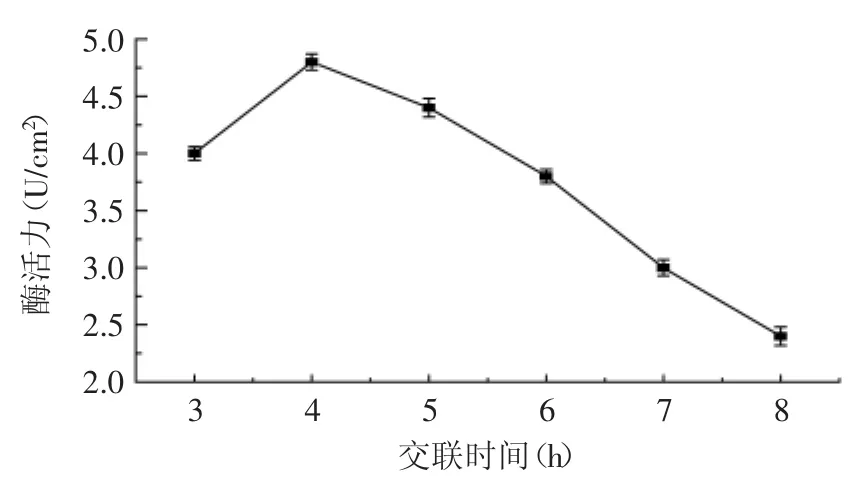
图4 交联时间对酶活力的影响Fig.4 Effect of the time of cross-linking on activity of immobilized PLA1
由图4可知,随着交联时间的延长,固定化酶的活力呈升高趋势,在4h时达到峰值;此后延长交联时间,固定化酶的酶活力反而降低,这是由于酶的失活所致。因此,确定理想的交联时间为4h。
2.2 固定化酶的酶学性质
2.2.1 固定化酶的最适温度 纤维素滤纸膜在高碘酸钠浓度为0.15mol/L,活化80min,与浓度为0.05g/mL的酶的磷酸盐缓冲溶液(pH为5.8)于戊二醛浓度0.4%,温度4℃下,交联4h时,固定化磷脂酶效果最好。在该条件下固定化磷脂酶,分别在不同温度条件下测定酶活,如图5所示。由图5可知,固定化酶与游离酶的最适反应温度均为35℃,与游离酶相比固定化酶膜的最适反应温度没有明显变化,并且它在50℃时所表现的酶活力仍然比较稳定,说明固定化酶最适温度范围变宽。因此,固定化酶酶活变化较游离酶小,固定化酶比游离酶稳定,不易失活。
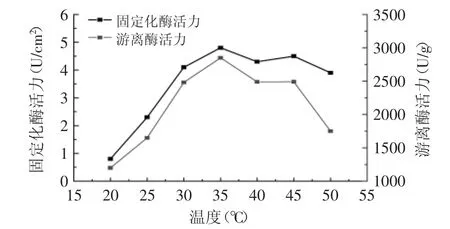
图5 温度对酶活力的影响Fig.5 Effect of temperature on activity of PLA1
2.2.2 固定化酶的最适pH 选择不同的反应pH,按固定化酶最佳的固定化条件进行固定化磷脂酶A1,
在最佳条件下测定固定化磷脂酶活力并与游离磷脂酶进行比较,如图6所示。
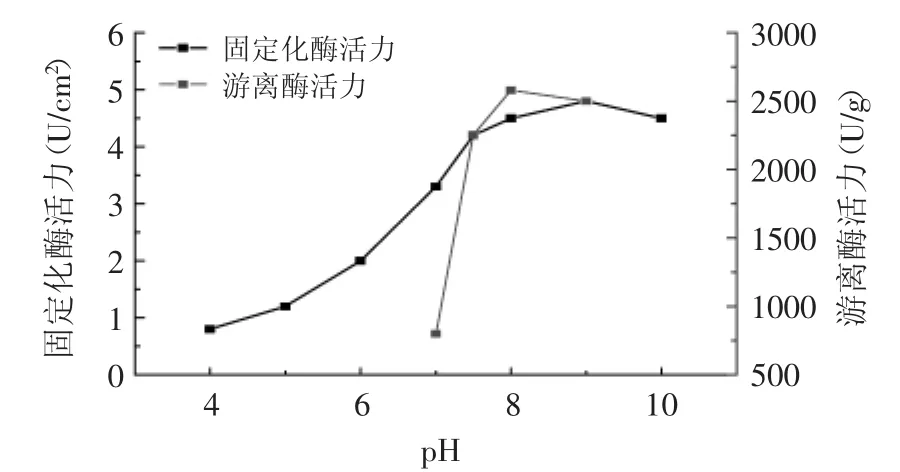
图6 pH对酶活力的影响Fig.6 Effect of pH on relative activity of immobilized lipase and free lipase
由图6可知,游离磷脂酶的最适pH为8.0,固定化磷脂酶的最适pH为9.0,向碱性偏移1.0。固定化酶的最适pH为9.0,显示固定化酶比游离酶较耐碱,且固定化后的磷脂酶的pH变化范围不大。
2.2.3 固定化酶的操作稳定性 以5%粉末磷脂为底物,进行酶解反应,分别在相同条件下连续进行7批次操作,测定其酶活力,以第一批次酶活力作为100%计算相对活力,结果如图7所示。
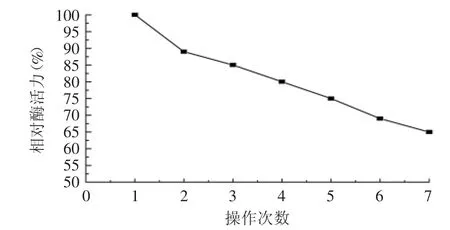
图7 重复使用次数对固定化酶相对酶活力的影响Fig.7 Effect of repeated use frequency on relative activity of immobilized lipase
由图7可知,固定化酶具有良好的操作稳定性,在连续使用7个批次后其相对活力仍保持65%以上。
2.3 SEM图的研究
采用本试验优化出的固定化条件将磷脂酶A1固定在纤维素滤纸膜上,用SEM对固定化后的磷脂酶A1进行扫描,如图8所示。
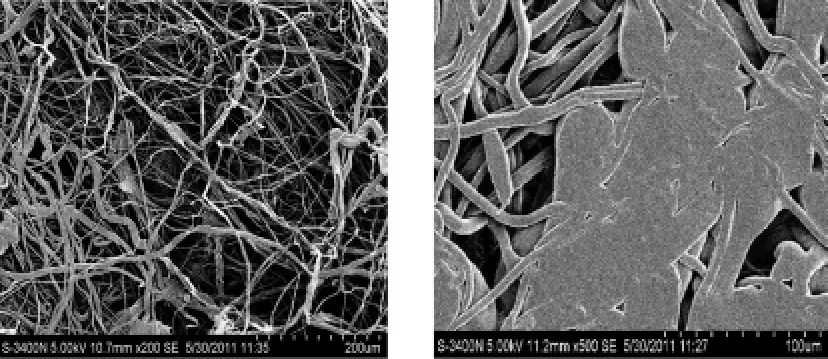
图8 SEM图像Fig.8 SEM images
由图8可知,左右两图分别为高碘酸钠氧化后的纤维素滤纸膜和固定化酶酶表面结构的SEM图。由图像对比可知:左图中经氧化后的纤维素滤纸膜较为松散,呈纤维状,因此有较大的空间来负载酶;右图是将磷脂酶A1固定在纤维素滤纸膜表面制成的固定化酶膜,从图中可看出用纤维素滤纸膜来固定磷脂酶,膜表面负载了部分酶,但由于氧化后的纤维素滤纸膜的羟基被氧化成醛基,所以酶被很好地固定在膜上。因此,进一步验证了将酶固定在膜上更有利于酶的稳定性。
3 结论
本试验研究了高碘酸钠氧化法在纤维素滤纸膜载体上固定化磷脂酶A1的最佳条件。采用高碘酸钠氧化法优化后固定化条件为:以固定化酶活力为指标,当高碘酸钠浓度为0.15mol/L,活化80min,与浓度为0.05g/mL的酶的磷酸盐缓冲溶液(pH为5.8)于戊二醛浓度0.4%,温度4℃下,交联4h,获得的固定化磷脂酶A1酶活力最高为4.8U/cm2。由于本试验采用高碘酸钠氧化法氧化固定化酶载体纤维素滤纸膜,而通常氧化程度以滤纸表面的羟基被氧化成醛基的量表示,醛基含量越高,与酶的交联率越大,以致所得到的固定化酶的活力较常规固定化方法有所提高。将固定化后的磷脂酶与游离磷脂酶的活力进行比较,固定化后的磷脂酶的pH变化范围不大,且对温度的敏感性更稳定,最适pH为9.0,最适温度为35℃,而经7次重复使用后,固定化酶膜活力为原酶活的65%以上,说明固定化酶膜有较好的稳定性。进一步对固定化后的磷脂酶A1稳定性进行SEM扫描验证,SEM结果显示:高碘酸钠氧化后的纤维素滤纸膜表面的纤维枝状大部分被酶覆盖,且酶堆积的非常致密,表明大部分酶滞留在纤维素滤纸膜的界面上,这种结构较利于磷脂酶的固定化。
[1]Kim IH,Garcia HS,Hill CGJr.Phospholipase A1-catalyzed synthesis of phospholipids enriched in n-3 polyunsaturated fatty acid residues[J].Enzymeand Microbial Technology,2007,40:1130-1135.
[2]杨继国,杨博,李秋生,等.新型磷脂酶LecitaseUltra用于菜籽油脱胶的研究[J].中国油脂,2003,28(12):31-34.
[3]张立武,徐僖.固定化酶技术进展[J].成都科技大学学报,1989(5):109-114.
[4]Carr FW,Bowers LD.Immobilized enzymes in analytical and clinical chemistry[M].New York:Fundamentals and Applications Wiley,1980:148-196.
[5]Atkinson B,Mavituna F.Biochemical engineering and biotechnology handbook[M].New York:The Nsture Press,1983:464-579.
[6]GuibaultGG,Kauffmann[J].M Biotechnol Appl Biochem,1987(9):95.
[7]YEMUL O,IMAE T.Covalent-bonded immobilization of lipase on polyphenylene sulfide dendrimers and their hy-drolysis ability[J].Biomacromolecules,2005,6(5):2809-2814.
[8]Torres R,Pessela B,Fuentes M,et al.Stabilization of enzymes by multipoint attachment via reversible immobi-lization on phenylboronic activated supports[J].J Biotech-nol,2005,120(4):396-401.
[9]Herring C D,Raffaelle M,Allen TE,et al.Im-mobilization of Escherichia coli RNA polymerase and location of binding sites by use of chromatin immunoprecipitation and microarrays[J].J Bacteriol,2005,187(17):6166-6174.
[10]李彦锋,李军荣,伏莲娣.固定化酶的制备及应用[J].高分子通报,2001(2):13-17.
[11]孙万成,将笃孝,罗毅皓.壳聚糖/海藻酸钠微胶囊固定化磷脂酶A1及其结构考察[J].食品科学,2005,26(9):100-103.
[12]Sheelu G,Kavitha G,Fadnavis NW.Efficient immobilization of Lecitase in gelatin hydrogel and degumming of rice bran oil using a spinning basket reactor[J].J Am Oil Chem Soc,2008,85:739-748.
[13]Lai J T,Wu S Ch,Lui H S.Investigation on the immobilization of Pseudomonas isoamylase onto the Polysaccharide matrices[J].Bioprocess Engineer,1998,18:155-161.
[14]Sanderson C J,Wilson D V.A simple methed for coupling proteins to insoluble polysaccharides[J].Immunology,1971,20:1061-1065.
[15]Bustos N ,Stella AM,Wider D X.Studies on erythrocyte amino-laevulinate dehydratase.I Its purification and possible therapeutic applications[J].Int J Biochem,1980(12):745-749.
[16]李脉,杨继国,杨博.磷脂酶A1酶活测定方法的研究[J].现代食品科技,2007,23(8):80-82.
Study on immobilization of phospholipase A1by sodium periodate oxidation
YU Dian-yu1,2,MA Ying1,*,LIU Jing2,ZHANG Jia-ning2,LI Lin1
(1.School of Food Science and Engineering,Harbin Institute of Technology,Harbin 150090,China;2.College of Food Science and Technology,Northeast Agricultural University,Harbin 150030,China)
The phospholipase A1was immobilized on the cellulose membrane carrier by sodium periodate oxidation and the different influential factors of immobilization condition on the catalytic activity of phospholipase A1were studied.The optimal conditions of the immobilized lipase:the sodium periodate concentration was 0.15mol/L,activated 80min,which the lipase concentration was 0.05g/mL under the phosphate buffered solution with pH5.8 under 4℃,crosslinking for 4h.The phospholipase A1activities was 4.8U/cm2.The immobilized lipase characterization:the optimal temperature for the immobilized lipase was 35℃;the optimal pH was 9.0,which drifted 1.0 to the alkaline side than that of free lipase;the immobilized lipase membrane was used for 7 times still with high activity above 65%.The results of SEM images showed that cellulose membrane could better immobilize lipase.
phospholipase A1;sodium periodate oxidation;immobilization;cellulose membrane;activity of lipase
TS201.2
A
1002-0306(2012)07-0188-04
2011-06-22 * 通讯联系人
于殿宇(1964-),男,教授,在读博士,主要从事大豆油脂加工技术研究。
国家863高技术研究发展计划(2010AA101503)。

