补加氨水对薛氏丙酸杆菌分批发酵及代谢物抑菌活性的影响
王晓云,金风杰,计芬芬,常忠义,高红亮,*
(1.华东师范大学生命科学学院,上海 200062;2.上海市纺织科学研究院,上海 200082)
补加氨水对薛氏丙酸杆菌分批发酵及代谢物抑菌活性的影响
王晓云1,金风杰1,计芬芬2,常忠义1,高红亮1,*
(1.华东师范大学生命科学学院,上海 200062;2.上海市纺织科学研究院,上海 200082)
研究了在分批发酵过程中补加氨水对1株薛氏丙酸杆菌(Propionibacterium shermanii)发酵及其代谢物对恶臭假单胞菌(Pseudomonas pudia)抑菌活性的影响。结果表明,薛氏丙酸杆菌代谢物在初始pH7.0时抑菌活性最高,为7.59AU/mL,显著高于其他实验组(p<0.05);每隔24h补加10%氨水溶液调节发酵液pH6.0时,薛氏丙酸杆菌的生物量和代谢物的抑菌活性都最大,分别为9.62mg/mL和16.42AU/mL;研究分别从第2、3或4d补加10%氨水开始调节发酵液pH6.0时发现,从发酵第2d开始调节pH效果最好,生物量和代谢物的抑菌活性分别达到9.55mg/mL和16.47AU/mL。这些结果表明,在分批发酵过程中补加氨水调节发酵液的pH可以显著提高丙酸杆菌代谢物的抑菌活性。
薛氏丙酸杆菌(Propionibacterium.shermanii),氨水,抑菌活性
目前食品工业常用的防腐剂主要有苯甲酸钠和山梨酸钾等。然而越来越多的研究表明山梨酸钾等化学合成防腐剂对人体都有潜在的毒副作用[1-2]。细菌素作为一种天然的防腐剂开始引起人们的关注。它是一种多肽,进入人体的消化道后,可以被消化道内的各种蛋白酶消化掉[3]。与常用的化学防腐剂相比,具有无毒、无副作用、无残留、无抗药性的优点,并可以抑制或杀死一些食品腐败菌[4]。目前研究最多的细菌素是乳酸链球菌素(Nisin)[5],作为天然微生物防腐剂已被多个国家批准使用,其对革兰氏阳性菌有较强的抑制作用,对革兰氏阴性菌、酵母和霉菌则没有明显的抑制作用[6]。丙酸杆菌素却有广泛的抑菌作用,不仅能抑制革兰氏阴性细菌、部分革兰氏阳性菌、霉菌和酵母的生长[7],且它是由乳品丙酸杆菌代谢产生,符合现代绿色食品无毒副作用的要求,因而作为食品防腐剂具有很大的潜力。国外已经报道的丙酸杆菌素有5种[8],即丙酸杆菌素PLG-1、丙酸杆菌素G、丙酸杆菌素T1、丙酸杆菌素JenseniiG和丙酸杆菌素SM 1。法国罗地亚公司开发的一种新型生物防腐剂MicrogardTM[9-10],已被美国医药和食品管理局(FDA)批准为防腐剂用于食品中,而M icrogardTM是谢氏丙酸杆菌的发酵代谢物。近年来国内在对丙酸杆菌进行菌种分离、鉴定与产酸的基础上也开始对其发酵条件[3,11-12]进行初步探索,包括碳源、氮源的选择,补料对发酵的影响等,马悦培[13]等人还对发酵环境的pH影响进行了一定的研究,然而对于用碱液调节pH对丙酸杆菌发酵的影响还尚无报道。氨水相对于发酵上较常见的氢氧化钠、碳酸钙等调节pH有三方面的优势:一是氨水属于弱碱,可以形成一个缓冲调节体系,二是在一定程度上可以提供氮源,三是不易形成沉淀。本文即主要研究补加氨水调节pH对丙酸杆菌分批发酵过程的影响,研究了在补加10%氨水调节不同pH的条件下丙酸杆菌的生长及代谢物的抑菌活性,为以后的研究打下基础。
1 材料与方法
1.1 材料与仪器
薛氏丙酸杆菌(Propionibacterium shermanii) 本实验室分离并保存;恶臭假单胞菌(Pseudomonas putida) 上海疾病控制防疫中心;恶臭假单胞菌培养基,LB培养基;氨水、苯酚、NaHSO3、酒石酸钾钠、3,5-二硝基水杨酸、酒石酸、NaOH 均为分析纯;丙酸杆菌种子培养基是SLB培养基[11]胰蛋白胨10g,酵母提取物10g,60%乳酸钠16.7m L,K2HPO40.25g,MnSO40.005g,加蒸馏水定容至1000m L,pH 7.0;丙酸杆菌发酵培养基是葡萄糖培养基 用2%的葡萄糖代替SLB中的乳酸钠,其它成分不变。
TDL-5型高速离心机,96孔聚苯乙烯酶标板,酶标检测仪(power wave xs)。
1.2 实验方法
1.2.1 指示菌的制备 活化的恶臭假单胞菌按1.0%的接种量接种于LB培养基中,37℃,200r/m in摇床振荡培养过夜至OD600nm为0.2,再用无菌的LB培养基稀释100倍备用。
1.2.2 丙酸杆菌的培养及其代谢物的制备 将丙酸杆菌接入种子培养基,32℃静置培养48h作为种子液,按10%的接种量接入装有发酵培养基的150m L锥形瓶中,32℃静置培养,每隔24h取样一次。所取样品于8000r/min冷冻离心15min取上清液,测定pH后用10%的NaOH溶液调pH至7.0,再用10%的酒石酸调至pH 5.3,最后进行膜(0.22μm)过滤除菌,置于4℃冰箱中保存。
1.2.3 补加氨水方法 a.不同初始pH对丙酸杆菌发酵的影响 分别设定发酵培养基的初始pH为6.5、7.0、7.5和8.0时进行发酵,以确定丙酸杆菌代谢物最大抑菌活性的最佳初始pH。
b.补加氨水调节不同的pH 从第2d开始起间隔24h补加10%氨水调节发酵过程的pH分别为5.5、6.0和6.5,研究其对丙酸杆菌发酵及其代谢物抑菌活性的影响。以初始pH为7.0未补加氨水的发酵作为对照。
c.不同补加氨水时间对丙酸杆菌发酵的影响 选择分别在发酵后的第2、3和4d开始间隔24h补加氨水调节发酵液pH6.0,研究不同补加时间对发酵的影响。
1.2.4 丙酸杆菌代谢物抑菌活性(AU)测定 采用改良的系列稀释法[14],测定丙酸杆菌代谢物抑菌活性,其中将丙酸杆菌代谢物用LB培养基(灭菌后用10%的酒石酸调pH 5.3)以2N逐步稀释。制备酶标板时每孔中加入20μL不同稀释度的丙酸杆菌代谢物和180μL上述指示菌液,以空白的20μL LB培养基和180μL上述指示菌液做对照,每个稀释度的样品做三个平行,37℃培养箱中静置培养24h。抑菌活力的计算:在酶标检测仪上读数测定每孔的OD600nm,OD值为对照值一半时代谢物的稀释度为一个抑菌活性单位(AU)。
1.2.5 还原糖含量的测定 采用3,5-二硝基水杨酸(DNS)法[15]。
1.2.6 生物量的测定 取丙酸杆菌发酵液50m L于8000r/m in离心15m in,沉淀用去离子水冲洗3次,105℃烘干至恒重后称取质量。
2 结果与分析
2.1 不同初始pH对丙酸杆菌发酵的影响
图1 不同初始pH下发酵液的pH变化Fig.1 The pH value of the fermentation brothswith different initialmedium pH
各处理组发酵液的pH在第1、2d下降很快(图1),pH均在第2d达到5左右,此后各处理组pH趋势相同,表明不同初始pH对发酵后期的pH影响不大。
图2 不同初始pH代谢物抑菌活性的变化Fig.2 Antimicrobial activity of themetaboliteswith different initialmedium pH
初始pH对代谢物抑菌活性有很大影响,如图2显示了不同初始pH发酵产生的丙酸杆菌代谢物对恶臭假单胞菌的抑菌活性。初始pH 7.0、7.5和8.0时,抑菌活性均在第7d达到最大值,其中初始pH7.0时的抑菌活性最大,为7.59AU/m L,和其他实验组差异显著(p<0.05)。因此,丙酸杆菌发酵的最优初始pH为7.0。
2.2 补加氨水对丙酸杆菌发酵的影响
如图3所示,补加10%氨水调节发酵液pH为6.0和6.5发酵所得的菌体生物量明显增加,且生物量在第5d出现最大值,pH为6.0的实验组为9.62mg/m L,极显著高于对照组的(p<0.01),但是和pH为6.5的实验组差异不显著。这一结果表明pH维持在6.0和6.5之间明显有利于丙酸杆菌菌体生长。
图3 补加10%氨水溶液调节不同pH时发酵液生物量的变化Fig.3 Biomass of P.shermanii by feeding ammoniawater to adjust pH of broth
根据图4可以看出,补加10%氨水调节pH为6.0和6.5的实验组还原糖消耗很快,在第5d分别仅有1.41和2.55mg/m L,和对照组差异极显著(p<0.01)。这与图3的结果相吻合,表明菌体生长消耗了大量的还原糖。
图4 补加10%氨水溶液调节不同pH时发酵液还原糖的变化Fig.4 Reducing sugar of P.shermanii by feeding ammoniawater to adjust pH of broth
如图5所示,用10%氨水调节发酵液不同pH,丙酸杆菌代谢物的抑菌活性有明显差异。实验组最大抑菌活性值均出现在第5d,比对照组早两天,且抑菌活性都明显高于对照组。其中pH为6.0的实验组在第5d达到最大值,为16.42AU/m L,抑菌活性与对照组的最大抑菌活性(发酵第7d)相比差异极显著(p<0.01),与其他实验组相比也差异显著(p<0.05)。因此,用10%氨水溶液调节丙酸杆菌发酵液pH 6.0效果是发酵代谢物的最优pH。
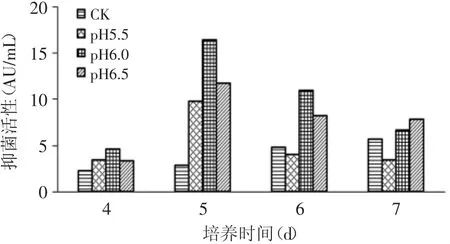
图5 补加10%氨水溶液调节不同pH时代谢物抑菌活性的变化Fig.5 Antimicrobial activity of P.shermanii by feeding ammoniawater to adjust pH of broth
2.3 不同补加氨水时间对丙酸杆菌发酵的影响
由图6可以看出,发酵第2d开始调节pH,生物量在第5d达到最大值,为9.55mg/m L,极显著高于对照组最高值4.94mg/m L(发酵第6d,p<0.01),其余实验组与对照组则在发酵第6d达到生物量最大值。

图6 不同时间补加氨水时发酵液生物量的变化Fig.6 Biomassof P.shermanii by feeding ammoniawater in different time
由图7可以看出,发酵第2d用氨水调节pH的实验组还原糖在第5d浓度已经很低,为1.31mg/m L,其余各实验组还原糖在第6d也基本利用完。这和图6的生物量的实验结果也比较相似。
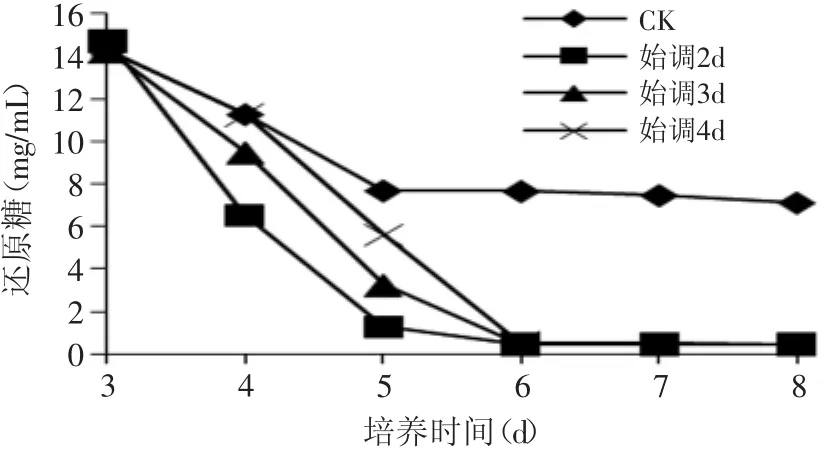
图7 不同时间补加氨水时还原糖的变化Fig.7 Reducing sugarby feedingammoniawater in different time
发酵第2d用氨水调节pH的实验组抑菌活性最高,第5d的抑菌活性为16.47AU/m L,极显著高于对照组和其他实验组(p<0.01)(图8)。由此可见,从发酵第2d用氨水调节pH为6.0的发酵方式最好,不仅可以缩短发酵时间,还可以极显著地提高抑菌活性。
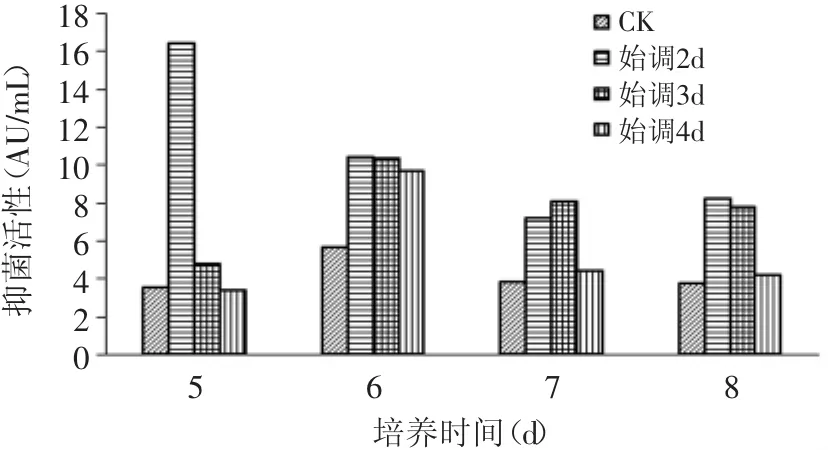
图8 不同时间下补加氨水时代谢物抑菌活性的变化Fig.8 Antimicrobialactivity of P.shermanii by feeding ammoniawater in different time
3 结论与讨论
薛氏丙酸杆菌在初始pH为7.0时发酵产生的代谢物抑菌活性最高,为7.59AU/m L,显著高于其他实验组;当补加10%氨水调节pH为6.0时,薛氏丙酸杆菌的生物量和代谢物的抑菌活性都最大,分别为9.62mg/m L和16.42AU/m L;不同的氨水补加时间表明,从发酵第2d开始每隔24h调节pH为6.0时效果最好,生物量和代谢物的抑菌活性分别达到9.55mg/m L和16.47AU/m L,其中抑菌活性在第5d就达到了最大值,且极显著高于对照组和其他实验组的最大值(其他组第6d达到最大值,p<0.01)。
由此可见,发酵第2d每隔24h补加10%氨水调节pH为6.0的发酵方式最好,不仅可以缩短发酵时间,还可以极显著地提高抑菌活性。
目前进行的丙酸杆菌发酵均是分批发酵,所以每次发酵在目标产物开始出现并积累时,培养基中已经积累了大量的生长限制因子和产物合成限制因子,如发酵产物乙酸、丙酸等有机酸,从而抑制了发酵液中菌体的生长和具有抑菌效价的丙酸杆菌代谢物的合成,为了增加发酵所得丙酸杆菌代谢物的抑菌效价,需要有效调节发酵液的pH,本实验首次用氨水对发酵液的pH进行了调节,显著提高了丙酸杆菌代谢物的抑菌活性,使其向工业化生产又迈进了一步。
[1]Hannuksela M,Haahtela T.Hypersensitivity reactions to food additives[J].Allergy,1987,42(8):561-575.
[2]Juhlin L.Recurrent urticaria:clinical investigation of 330 patients[J].British Journal of Dermatology,1981,104(3):369-381.
[3]孙帅,常忠义,唐学明,等.丙酸杆菌代谢物摇瓶补料分批发酵条件研究[J].西北农林科技大学学报:自然科学版,2011,39(7):135-140.
[4]陈乐乐,刘宁,常忠义,等.丙酸杆菌代谢物益生因子的研究[J].营养健康,2005,26(5):156-159.
[5]田文利,吴琼,吕红线,等.乳酸链球菌素(Nisin)的研究进展[J].食品工业,2000,21(3):28-30.
[6]Stevens K A,Sheldon BW,Klapes N A,etal.Nisin treatment for inactivation of salmonella species and other gram-negative bacteria[J].Applied and Environmental Microbiology,1991,57(12):3613-3615.
[7]Grinstead D A,Barefoot S F,Jenseniin G.A heat-stable bacteriocin produced by propionibacterium jensennii P127[J]. Applied and EnvironmentalMicrobiology,1992,58(1):215-220.
[8]Stiles M E.Biopreservation by lactic acid bacterin[J].Antonie Van Leewenhoek,1996,70:331-345.
[9]Marie JL,Julie C.Antimicrobial effectof natural preservatives in a cooked and acidified chicken meatmode[J].International Journal of Microbiology,2002,78:217-226.
[10]Salih M A,Sandine W E,Ayres T A.Inhibitory effect of micogard on yoghurt and cottage cheese spoilage organism[J]. Journal of Dairy Science,1990,73:887-889.
[11]冯晗,荣邵丰,贾彩凤,等.丙酸杆菌代谢物对恶臭假单胞菌抑制活性[J].兰州大学学报:自然科学版,2008,44(2):58-62.
[12]陈玉梅,高红亮,常忠义,等.乳酸钠和葡萄糖对薛氏丙酸杆菌生长及代谢物抑菌活性的影响[J].西北农林科技大学学报:自然科学版,2007,35(2):178-183.
[13]马悦培,高红亮,常忠义,等.不同初始pH对丙酸杆菌细菌素发酵的影响[J].食品工业科技,2010(5):215-217.
[14]Helge H,Therese F,Dag A B,etal.Bacteriocins of propionic acid bacteria[J].Lait,2002,82(2):59-68.
[15]刘坚真,陈国寿,李海波,等.国家标准测定食品细菌总数培养基的改进研究[J].微生物学通报,2001,28(2):63-67.
Study on fermentation and metabolites antim icrobialactivity of Propionibacterium shermanii by feeding ammonia
WANG Xiao-yun1,JIN Feng-jie1,JIFen-fen2,CHANG Zhong-yi1,GAO Hong-liang1,*
(1.School of Life Sciences,East China Normal University,Shanghai200062,China;2.Shanghai Textile Research Institute,Shanghai200082,China)
The fed-batch culture p rocess and the antim icrobial activity ofmetabolites from Propionibacterium. shermanii against Pseudomonas.putida by feed ing ammonia water were studied.The results showed that the activity ofmetabolites was 7.59AU/m L,when the initialmedium was pH 7.0,and the antim icrobial activity was remarkab le higher than that of other g roups(p<0.05).When feeding 10%ammonia water to ad just pH of broth to 6.0,the biomass of P.shermanii was 9.62mg/m L,and the antim icrobialactivity ofmetabolites was 16.42AU/m L. both of them were the highest among all the treatments.The pH of broth was ad just to 6.0 w ith 10%ammonia water begin w ith 2,3 and 4d,respectively.Maximalmetabolites antim ic robialactivity(16.47AU/m L)and maximal biomass(9.55mg/m L)were observed,when ad just pH w ith 10%ammonia water begin w ith 2d.It could remarkab ly im p rove the antim icrobial activity ofmetabolites from P.Shermanii against P.putida when feed ing 10%ammonia water to ad just pH of b roth in the batch-culture.
Prop ionibacterium Shermanii;ammonia water;antim icrobialactivity
TS201.3
A
1002-0306(2012)14-0224-04
2011-11-17 *通讯联系人
王晓云(1987-),女,在读硕士,研究方向:食品微生物。
上海市农业遗传育种重点实验室开放基金项目(Shagb2009-02)。

