麝香草酚抑菌活性及其影响因素研究
王 娣,谢海伟,曹珂珂,柯春林,钱时权,石亚中,任茂生
(蚌埠学院生物与食品工程系,安徽蚌埠 233030)
麝香草酚抑菌活性及其影响因素研究
王 娣,谢海伟,曹珂珂,柯春林,钱时权,石亚中,任茂生
(蚌埠学院生物与食品工程系,安徽蚌埠 233030)
采用滤纸片法和扩散法,研究不同浓度的麝香草酚对食品中常见10种污染菌的体外抑菌作用,并对其抑菌影响因素进行了研究。实验结果表明,麝香草酚对细菌、酵母和霉菌均有一定抑制作用。经测定,麝香草酚对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、变形杆菌、保加利亚乳杆菌、嗜热乳酸链球菌、异常汉逊氏酵母、酿酒酵母、黑曲霉、黄曲霉的最低抑菌浓度分别为10、20、20、40、40、40、80、40、80、160μg/mL。抑菌影响因素研究表明,吐温-80和有机氮(BSA)能明显消弱麝香草酚的抑菌能力;低pH则会明显增强麝香草酚的抑菌作用。
麝香草酚,抑菌活性,最低抑菌浓度,影响因素
麝香草酚(Thymol),别名百里酚、5-甲基-2-异丙基酚,是一种单萜酚,主要存在于唇形科百里香属植物中,是百里香属植物挥发油的主要成分[1-2]。百里香属植物是一种多用途植物,在我国主要分布于甘肃、内蒙古、陕西、山西等地区[3],可作为天然调味品、药用植物、蜜源植物等开发利用。目前使用的麝香草酚多从百里香属植物挥发油中提取[4-6],具有宜人香气。钟少枢等[7]采用麝香草酚等七种单离食用香料对食品腐败菌的抑菌活性进行了研究,结果表明麝香草酚对细菌、霉菌和酵母均具有一定的抑制能力。闭兴明等人[8]测定了麝香草酚对临床分离红色毛癣BMU01672株、酿酒酵母标准株和24株临床分离耐氟康唑(FLC)白色念珠菌的最小抑菌浓度,发现麝香草酚有较好的抗真菌活性。麝香草酚具有抑菌作用机理可能是[9]:与细胞膜蛋白质相互作用,引起跨膜质子的倒流,影响了由质子驱动供能的细胞活性;或者与微生物生长所必需物质结合,导致微生物死亡等。本文尝试采用滤纸片法及扩散法研究麝香草酚对食品中10种常见污染菌的抑制活性,并对其影响因素进行初探,为其作为天然食物防腐剂的开发应用提供理论依据。
1 材料和方法
1.1 材料与设备
麝香草酚 无色片状结晶,有特殊香味,分子式C10H14O,麝香草酚>98%,分析纯,天津博迪化工股份有限公司;金黄色葡萄球菌(StapHylococcus aureus)GIM 1.55、枯草芽孢杆菌(Bacillus Subtilis)GIM 1.131、大肠杆菌(Escherichia coli)GIM 1.154、变形杆菌(Proteus vulgaris)GIM 1.192、保加利亚乳杆菌(Lactobacillus bulgaricus)GIM 1.189、嗜热乳酸链球菌(Streptococus thermopHilus)GIM 1.83、酵母异常汉逊氏酵母(Hansenula anomala)GIM 2.18、酿酒酵母(Saccharmuces cerevisiae)GIM 2.34、霉菌黑曲霉(Aspergillusniger)GIM 3.24、黄曲霉(Aspergillus flavus)GIM 3.18 广州微生物研究所;牛肉膏蛋白胨培养基(BPA) 培养金黄色葡萄球菌(StapHylococcusaureus)、枯草芽孢杆菌(Bacillus subtilis)、大肠杆菌(Escherichia coli)、变形杆菌(Proteus vulgaris),用牛肉膏蛋白胨琼脂培养基,每100m L中加入95%的酒精5m L(BPAE);乳酸细菌培养基(MRS琼脂培养基) 培养保加利亚乳杆菌(Lactobacillus bulgaricus)、嗜热乳酸链球菌(Streptococus thermopHilus);马铃薯汁葡萄糖琼脂培养基(PDA) 培养异常汉逊氏酵母(Hansenula anomala)、酿酒酵母(Sacchromuces cerevislac)、黑曲霉(Aspergillus niger)、黄曲霉(Aspergillus flavus)。
LRH-150-II智能生化培养箱、SW-CJ-2F超净工作台 上海一恒科学仪器有限公司;LDZX-40BI高压灭菌锅 北京京仪东方科技有限公司;LX41多功能显微镜 上海富众生物科学有限公司。
1.2 实验方法
1.2.1 菌悬浮液的制备 将供试菌种划线接入试管斜面培养基上,细菌于37℃恒温培养箱中培养24h,酵母于28℃培养48h,霉菌于28℃培养5d,4℃冰箱中冷藏备用。用接种环分别挑取少许培养成熟的细菌、酵母菌和霉菌孢子于装有玻璃珠和10m L无菌生理盐水的三角瓶中,振荡,采用活菌计数法测定菌数[10],制成菌体或孢子浓度为106~107CFU/m L均匀的菌悬浮液或孢子悬液。
1.2.2 不同浓度麝香草酚的制备 由于麝香草酚不溶于水,可加入少许吐温-80增溶[11],再加适量无菌水超声乳化、定容,配制成500、800、1000μg/m L系列浓度的麝香草酚(吐温-80含量不超过0.5%)。以0.5%的吐温-80作为对照。
1.2.3 滤纸片法[12]取灭菌后的滤纸圆片(d=6mm)于麝香草酚中浸泡10min,沥去多余液体,置于已用0.1m L菌悬液涂布均匀的培养皿中,每个菌种做3次平行。细菌恒温培养24h,酵母培养48h,霉菌培养5d,测量抑菌圈直径。
1.2.4 扩散法(打孔法)[13]用无菌打孔器(孔径6mm)在用0.1m L菌悬液涂布均匀的培养皿中十字对称打4个孔,用无菌微量移液器分别加入100μL不同浓度的麝香草酚,每种菌做3个平行,测量抑菌圈直径。
1.2.5 最低抑菌浓度(MIC)的测定[13]用无菌打孔器(孔径6mm)在用0.1m L菌悬液涂布均匀的培养皿中打4个孔,其中一个加0.5%的吐温-80作为对照,其它分别加入2.5~320μg/m L系列浓度的麝香草酚100μL,每种菌做3个平行,得到最低抑菌浓度(M IC)。
1.2.6 麝香草酚抑菌作用的影响因素研究
1.2.6.1 乳化剂(吐温-80)对麝香草酚抑菌作用的影响 麝香草酚加吐温-80增溶,稀释,使制备的培养基中麝香草酚含量达到200μg/m L,吐温-80(含量为0.25~8μL/m L)系列浓度。选取对麝香草酚敏感的3种供试菌:StapHylococcus aureus、Bacillus subtilis、Escherichia coli,制备菌悬浮液,取0.1m L菌悬液在上述培养基中涂布均匀,培养成熟,计算各皿菌落数,计算lgCFU/m L。
1.2.6.2 有机氮(BSA)对麝香草酚抑菌作用的影响麝香草酚加吐温-80增溶,稀释,使制备的化学合成培养基中麝香草酚含量为200μg/m L。将8mg/m L牛血清白蛋白(BSA)添加到化学合成培养基中,取0.1m L菌悬液在上述培养基中涂布均匀,培养成熟,计算lgCFU/m L。
1.2.6.3 pH对麝香草酚抑菌作用的影响 麝香草酚加吐温-80增溶,稀释,使制备的培养基中麝香草酚含量为200μg/m L,吐温-80含量为4μL/m L,将培养基的pH分别调至5.0、5.5、6.0、6.5。取0.1m L菌悬液在上述培养基中涂布均匀,培养成熟,计算lgCFU/m L。
2 结果与分析
2.1 滤纸片法及扩散法抑菌测试结果

表1 滤纸片法测得不同浓度麝香草酚的抑菌直径(mm)Table 1 The antimicrobial diameter of different concentration thymol by filter paper disks tests(mm)

表2 扩散法测得不同浓度麝香草酚的抑菌直径(mm)Table 2 The antimicrobial diameter of different concentration thymol by diffused tests(mm)
抑菌活性研究表明见表1、表2,麝香草酚对细菌、酵母和霉菌均有较强的抑制作用,是一种广谱性抑菌剂。当麝香草酚含量为1000μg/m L时,滤纸片法测定的抑菌直径大小次序为:Escherichia coli>StapHylococcus aureus>Bacillus subtilis>Saccharmuces cerevisiae>Proteus vulgaris>Lactobacillus bulgaricus>Streptococus thermopHilus>Hansenula anomala>Aspergillus niger>Aspergillus flavus。扩散法测定的抑菌直径大小次序为:StapHylococcus aureus>Escherichia coli>Bacillus subtilis>Lactobacillus bulgaricus>Proteus vulgaris>Saccharmucescerevisiae>Hansenulaanomala>StreptococusthermopHilus>Aspergillusniger>Aspergillus flavus。抑菌结果之所以有差别,可能是每次加入的菌悬液浓度有误差,或者实验操作有误差所致。
2.2 最低抑菌浓度(MIC)的测定
麝香草酚对10种供试菌的最低抑菌浓度:StapHylococcus aureus10μg/m L;Bacillus subtilis“-”表示抑菌实验阴性。
20μg/m L;Escherichia coli20μg/m L;Proteus vulgaris40μg/m L;Lactobacillusbulgaricus40μg/m L;Streptococus thermopHilus40μg/m L;Hansenula anomala80μg/m L;Saccharmuces cerevisiae40μg/m L;Aspergillus niger80μg/m L;Aspergillus flavus160μg/m L。细菌的最低抑菌浓度为10~40μg/m L,酵母的最低抑菌浓度为40~80μg/m L,霉菌的最低抑菌浓度为80~160μg/m L。由表3可以看出,麝香草酚对细菌抑制作用>酵母菌>霉菌。对霉菌抑制作用相对较弱可能是由于霉菌大多是通过孢子繁殖,而麝香草酚是通过培养基扩散与细胞接触,因而对孢子抑制作用稍差。
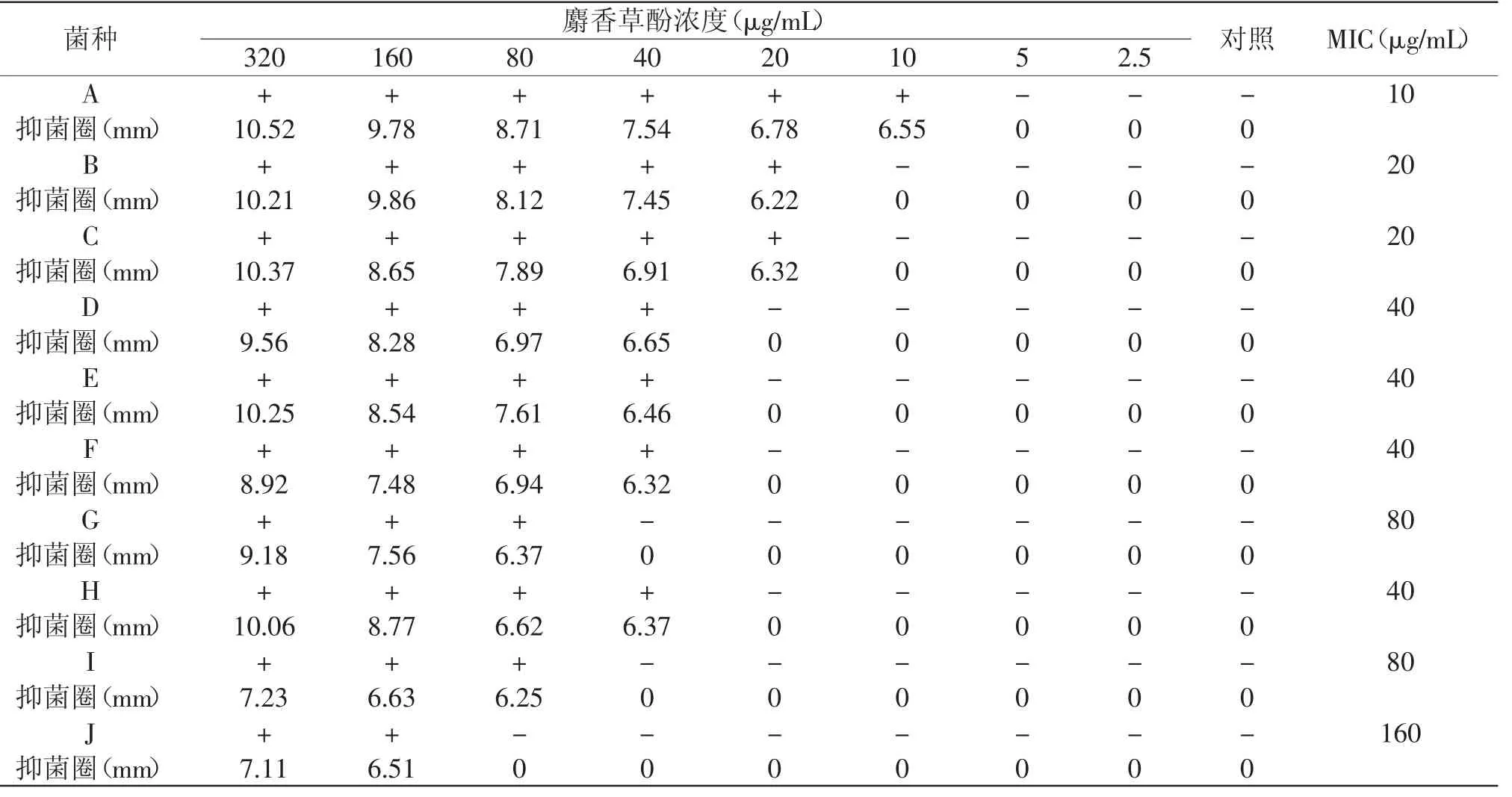
表3 麝香草酚对供试菌的最低抑菌浓度Table 3 MIC of thymol to differentbacteria
2.3 影响麝香草酚抑菌作用因素研究
2.3.1 乳化剂(吐温-80)对麝香草酚抑菌作用的影响 由表4可知,乳化剂吐温-80对麝香草酚的抑菌作用会产生一定影响。培养基中麝香草酚的浓度为200μg/m L,完全可以抑制供试菌的生长。培养基中吐温-80浓度较低时(<1.0μL/m L),检测不到细菌菌落。当吐温浓度由1.0μL/m L增加到8.0μL/m L时,StapHylococcus aureus菌数则由8.3(lgCFU/m L)增加到11.3(lgCFU/m L),这说明随着吐温-80浓度的增加,麝香草酚的抑菌作用在消弱,细菌的菌落数不断上升。分析原因可能是麝香草酚与供试菌的细胞膜蛋白质通过氢键或疏水作用相结合,使蛋白质变性或失活,造成细菌细胞生理功能紊乱死亡,这种现象会被吐温-80乳化剂消弱,因为乳化剂也能与酚类物质结合,所以降低了和供试菌蛋白质结合的麝香草酚相对浓度。此外,吐温-80还有增溶作用,会增加麝香草酚在水中的溶解度,减少其在细胞膜上的浓度,使麝香草酚和供试菌蛋白质结合的数量和程度大为下降,降低了麝香草酚的抑菌能力。
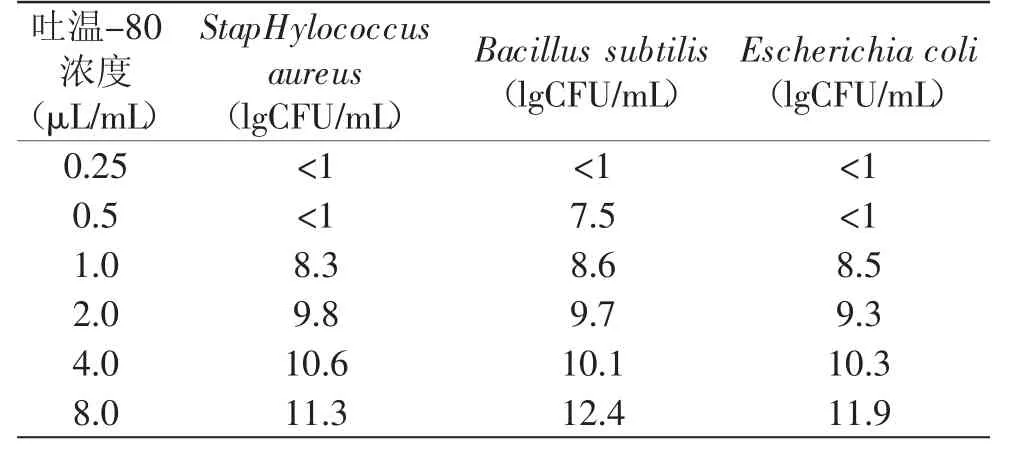
表4 吐温-80浓度对麝香草酚抑菌作用的影响Table 4 Effectof Tween 80 concentration on antimicrobial activity of thymol

表5 BSA对麝香草酚抑菌作用的影响Table 5 Effect of BSA on antimicrobial activity of thymol
2.3.2 有机氮(BSA)对麝香草酚抑菌作用的影响 由表5可知,有机氮(BSA)对麝香草酚的抑菌能力有明显的减弱作用。在不加牛血清白蛋白(BSA)只加麝香草酚的化学合成培养基上,麝香草酚表现出较强的抑菌作用,细菌基本上不能生长。同时添加了麝香草酚和牛血清白蛋白(BSA)的培养基上,BSA可基本抵消麝香草酚的抑菌作用。可能是BSA与麝香草酚结合,使麝香草酚和细胞膜蛋白质结合的机会和能力大大下降,降低了麝香草酚的抑菌作用。
2.3.3 pH对麝香草酚抑菌作用的影响 由表6可知,随着pH的降低,麝香草酚的抑菌能力逐渐增强。pH为6.5时,有大量细菌生长;pH降低为5时,细菌基本上不能生长。可能是低pH降低了细菌活性,改变了细菌生长的外环境,使细菌不易生存,或者使麝香草酚的疏水性增加,使其更利于和细菌细胞膜上的蛋白质结合,使蛋白质变性或活性降低,造成细胞死亡。

表6 pH对麝香草酚抑菌作用的影响Table 6 Effectof pH on antimicrobial activity of thymol
3 结论
麝香草酚对食品中常见的细菌、酵母菌和霉菌有一定抑菌作用。抑菌影响因素研究表明,随着吐温-80浓度的增加,麝香草酚的抑菌能力会明显消弱;培养基中添加有机氮(BSA)会明显消弱麝香草酚的抑菌能力;低pH则会明显增强麝香草酚的抑菌能力。从植物中寻找毒副作用小、安全性高的天然植物防腐剂,一直是科学工作者研究的热点[14]。麝香草酚是从可食用植物中提取出来的,安全性高,资源丰富,希望作为一种良好的天然食品防腐剂开发使用。
[1]Meriem Bensmira,Bo Jiang.Effect of lavender and thyme incorporation in sunflower seed oil on its resistance to frying temperatures[J].Food Research International,2007,40:341-346.
[2]N Solomakos,A Govaris.The antimicrnbial efect of thyme essential oil,nisin,and their combination against listeria monocytogenes in minced beef during refrigerated storage[J]. Food Microbiology,2008,25:120-127.
[3]员铭,吕国华.百里香应用价值研究[J].安徽农学通报,2007,13(2):89-91.
[4]Iraj Rasooli,Mehdi Razzaghi Abyaneh.Inhibitory effects of thyme oils on growth and aflatoxin production by Aspergillusparasiticus[J].Food Control,2004(15):479-483.
[5]Goodner K I,Mahattanataweek,Plotto A,et al.Aromatic profiles of thymus hyemalis and Spanish thymus uvlgaris essential oils by GC-MS[J].Industrial Crops and Products,2006(24):264-265.
[6]Tabak M,Armon R.In vitro inhibition of helicobacter pylori by thyme extract[J].Journal of Applied Bacterilogy,1996,80:667-672.
[7]钟少枢,吴克刚,柴向华,等.七种单离食用香料对食品腐败菌抑菌活性的研究[J].食品工业科技,2009(5):68-71.
[8]闭兴明,孟日增,郭娜,等.麝香草酚体外抗真菌活性研究[J].中国农学通报,2009,25(1):21-24.
[9]樊明涛,李亚琴.百里香提取物抑菌作用影响因素研究[J].江苏理工大学学报:自然科学版,2001,22(3):13-16.
[10]管至远,王艾琳,李坚.医学微生物学实验技术[M].北京:化学工业出版社,2005:84.
[11]刘晓丽,钟少枢,吴克刚,等.丁香和肉桂精油气相抑菌活性研究[J].食品与发酵工业,2010,36(1):21-24.
[12]王忠民,程明冬,王有平.葡萄多糖的抑菌作用研究[J].食品科学,2007,28(7):35-38.
[13]李建慧,马会琴,陈尚武.葡萄多酚抑菌效果的研究[J].中国食物学报,2008,8(2):100-106.
[14]钟瑞敏,王羽梅,曾庆孝,等.芳香精油在食品保藏中的应用进展[J].食品与发酵工业,2005,31(3):93-94.
Study on antim icrobialactivity of thymoland its influencing factors
WANG Di,XIE Hai-wei,CAO Ke-ke,KE Chun-lin,QIAN Shi-quan,SHIYa-zhong,REN Mao-sheng
(Departmentof Biology and Food-Engineering,Bengbu College,Bengbu 233030,China)
The antim icrobial activity of thymol to 10 im portant foodborne pathogens bacteria and influencing factors were studied by means of filter paper disks and d iffused tests.The results showed that foodborne pathogens bacteria were obviously inhibited.The test ob tained the m inimum inhibition concentrations of thymol to foodborne pathogens bac teria,inc lud ing StapHylococcus aureus,Bacillus sub tilis,Escherichia coli,Proteus vulgaris,Lactobacillus bulgaricus,Strep tococus thermopHilus,Hansenula anomala,Saccharmuces cerevisiae,Aspergillus niger,Aspergillus flavus,were as follows:10,20,20,40,40,40,80,40,80 and 160μg/m L.The factors affecting antibac terial action experiment results showed that Tween-80 and BSA remarkab ly decreased the antibac terialaction and low pH condition strong ly increased antibacterialaction.
thymol;antim icrobialactivity;m inimum inhibition concentrations(MIC);influencing factor
TS201.2
A
1002-0306(2012)14-0096-04
2011-12-05
王娣(1976-),女,硕士,副教授,主要从事食品生物技术的教学和研究工作。
安徽省高校优秀青年人才基金项目(2010SQRL116)。

