气相色谱法分析小球藻脂肪酸的组成
郑雪红, 郑爱榕
(厦门大学 海洋学系, 福建 厦门 361005)
气相色谱法分析小球藻脂肪酸的组成
郑雪红, 郑爱榕
(厦门大学 海洋学系, 福建 厦门 361005)
利用超声波破碎技术在1 mol/L HCl-CH3OH溶液中提取小球藻脂肪酸并酯化, 并用气相色谱和气质联用仪对其进行定量和定性分析, 鉴定出 C14:0, C16:2, C16:1, C16:0, C18:2, C18:1, C18:3, C18:0,C20:0共 9种脂肪酸, 其中不饱和脂肪酸占总脂肪酸的 65%。6份平行样的相对标准偏差为 6.04%~9.84%, 样品加标回收率范围为77.0%~122.6%, 各种脂肪酸甲酯的仪器检测限<0.3 ng。初步探讨了脂肪酸甲酯在弱极性色谱柱上的保留时间规律。
小球藻; 脂肪酸; 气相色谱; 气质联用仪; 保留时间
海藻中含有大量有益于人体健康的生物活性物质, 其中的不饱和脂肪酸具有抗癌、抗菌、预防心血管疾病、养颜、健脑益智等功效[1-5], 可以增加动物成活率和生长率, 被广泛应用于水产饲料添加剂[6-7]。同时, 海藻脂肪酸可以作为藻类的分类依据[8]、生物地球化学循环研究的生物标志物[9]及生物柴油的原料[10]。目前, 很多学者开展了海藻脂肪酸研究[11-14],样品前处理方法一般依次为皂化、酸化、萃取分离、浓缩、甲酯化、萃取分离、浓缩, 操作步骤多, 耗时长; 仪器分析多采用气相色谱或气质联用仪中的一种方法进行定性和定量, 但实际上, 海藻中含有的脂肪酸种类非常复杂, 对于一些相同碳数的各种不饱和脂肪酸, 在色谱柱上的保留时间非常相近甚至重叠, 在定性时易出现误判。气质联用仪的长处在于提供丰富的离子碎片信息有利于定性, 但定量的准确性不如气相色谱。所以, 本文以我国近海常见的微藻种群之一小球藻为研究对象, 采用超声波破碎、在HCl-CH3OH溶液中提取脂肪酸并酯化, 免去皂化、酸化逐步进行的操作, 减少分离、浓缩的次数, 分别用气相色谱和气质联用仪进行定量和定性分析, 探讨前处理步骤简化后方法的可行性, 归纳出脂肪酸甲酯的保留时间规律, 便于相同碳数脂肪酸相似组分的判定, 旨为海藻的开发利用研究提供更加简捷的分析手段与色谱分析的基础数据。
1 实验仪器、材料和方法
1.1 主要仪器和试剂
6890N气相色谱仪(美国安捷伦公司); Saturn 2200 气质联用仪(美国瓦里安公司); SGD-300 氮、氢和空发生器(北京市精华苑技术研究所); 数显恒温水浴锅(常州国华电器有限公司); 超声波清洗器(上海超声波仪器厂)。
饱和脂肪酸标准为国产分析纯试剂, 不饱和脂肪酸标准为美国Fluka公司色谱纯试剂, 甲醇和正己烷均为色谱纯。
1.2 生物样品
海水经过滤灭菌, 添加f/2培养基及小球藻藻种,在自然光下培养。通过离心、洗涤、干燥、研磨, 获得小球藻藻粉, 密封冷藏保存。
1.3 脂肪酸甲酯的制备
称取约10 mg小球藻于水解管中, 加入62.4 μg正十九烷酸内标, 加入2 mL 1mol/L HCl-CH3OH溶液, 充氮气1min后密封, 超声破碎 5 min, 然后在100 ℃水浴中抽提甲酯化40 min, 冷却后用3 mL正己烷分3次萃取。合并提取液并用氮气浓缩至1 mL,封口, 在冰箱中冷冻保存。按上述方法将脂肪酸标准衍生为脂肪酸甲酯。所有样品分别用气相色谱和气质联用仪分析。
1.4 气相色谱分析条件
进样口温度280 , ℃不分流进样, 进样量1 μL, 采用 HP-5毛细管柱(30 m×0.32 mm×0.25 μm), 载气高纯氮, 流量为1 mL/min, FID检测器温度为300 , ℃尾吹氮气、氢气和空气流量分别为25、30和400 mL/min。升温程序为: 在120 ℃恒温1 min, 以20 /min℃升到210 , ℃恒温10 min, 以6 /min℃升到250 , ℃恒温3 min, 以30 /min℃升到280 , ℃恒温6 min。
1.5 气质联用仪分析条件
进样口温度、进样模式、进样量、载气流量、升温程序同气相色谱分析条件, 采用与HP-5极性等同的 VF-5MS毛细管柱(30 m×0.25 mm×0.25 μm), 载气高纯氦, 传输线温度280, ℃离子阱温度180, ℃用电子轰击 EI-Auto电离模式分析, 电子轰击能量70 eV, 质荷比扫描范围40~650。
1.6 定性和定量方法
以正十九烷酸为内标, 采用色谱相对保留时间和质谱定性, 利用相对校正因子按内标法定量。每种脂肪酸的含量用质量比(mg/g, 干质量)表示。
2 结果与讨论
2.1 小球藻脂肪酸组成
各种脂肪酸甲酯的相对保留时间及相对校正因子如表1所示。图1是标准脂肪酸甲酯和小球藻脂肪酸甲酯的气相色谱图, 有两组脂肪酸甲酯共馏出,分别是 C18:1 和 C18:3、C20:1 和 C20:3, 其他脂肪酸甲酯得到较好的分离。通过质谱鉴定(图 2), 发现小球藻中含有顺-9,12-十六碳二烯酸(C16:2)。
小球藻脂肪酸的组成及含量见表 2, 共鉴定出C14:0, C16:2, C16:1, C16:0, C18:2, C18:1、C18:3,C18:0, C20:0共9种脂肪酸, 其中不饱和脂肪酸占总脂肪酸的 65%, 饱和脂肪酸以 C16:0和 C20:0为主,这与[15,16]的研究结果相似。本实验、程远月等[16]及Georgi和Guillermo[17]均未在小球藻中检测到C20及C22系列的不饱和脂肪酸, 而廖启斌等[18]和王明清等[12]报道小球藻中 C20:5含量高达 26.3%和 27.3%,吕冬伟等[14]的研究表明 C20:5含量为 13%, 这可能与微藻培养条件的差异有关, 或是小球藻受到其他藻种、细菌的影响[17]。
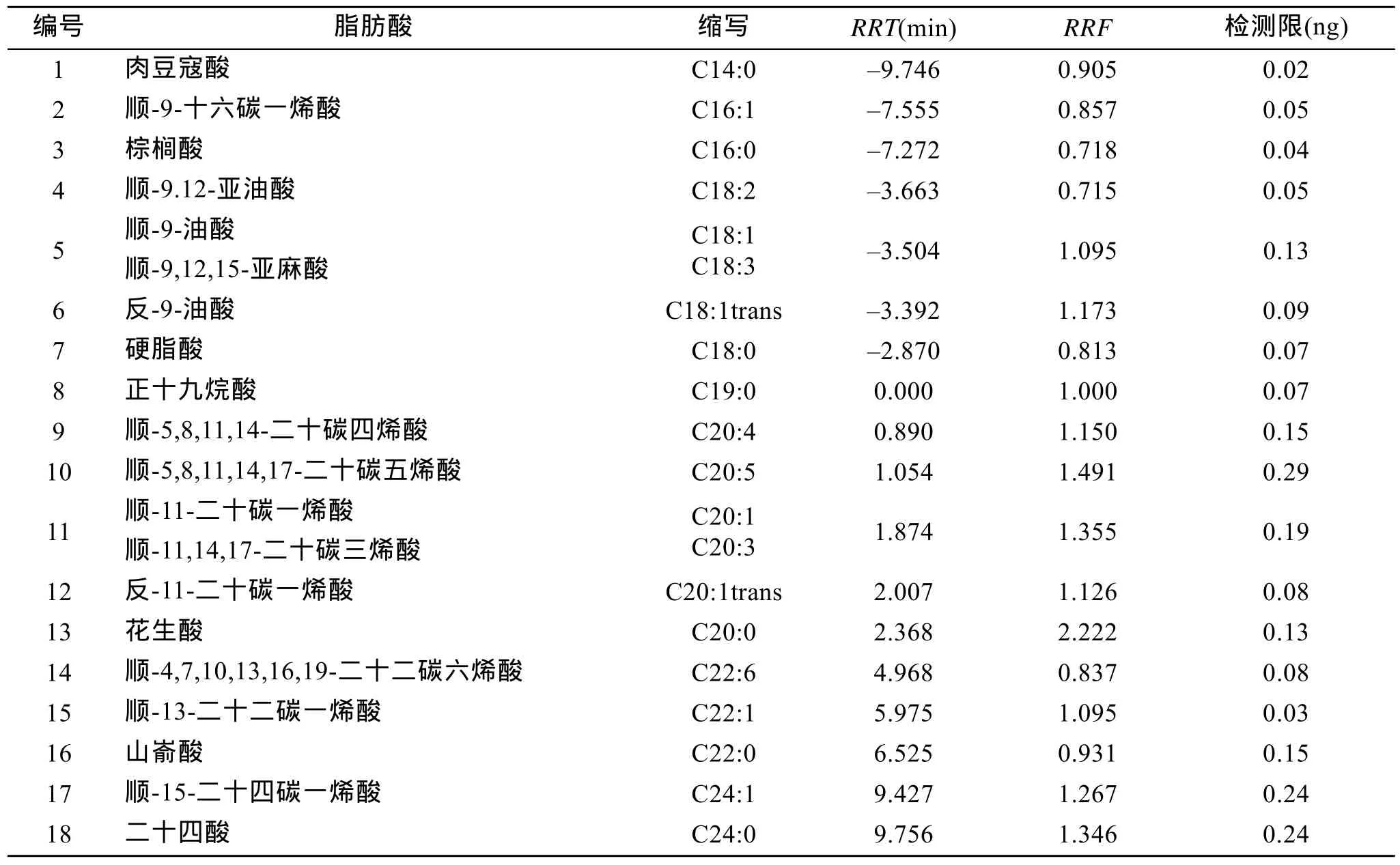
表1 脂肪酸甲酯的相对保留时间(RRT)、相对校正因子(RRF)及仪器检测限Tab. 1 Relative retention time (RRT), relative rectification factor (RRF) and limit of detection for instrument of fatty acid methyl esters
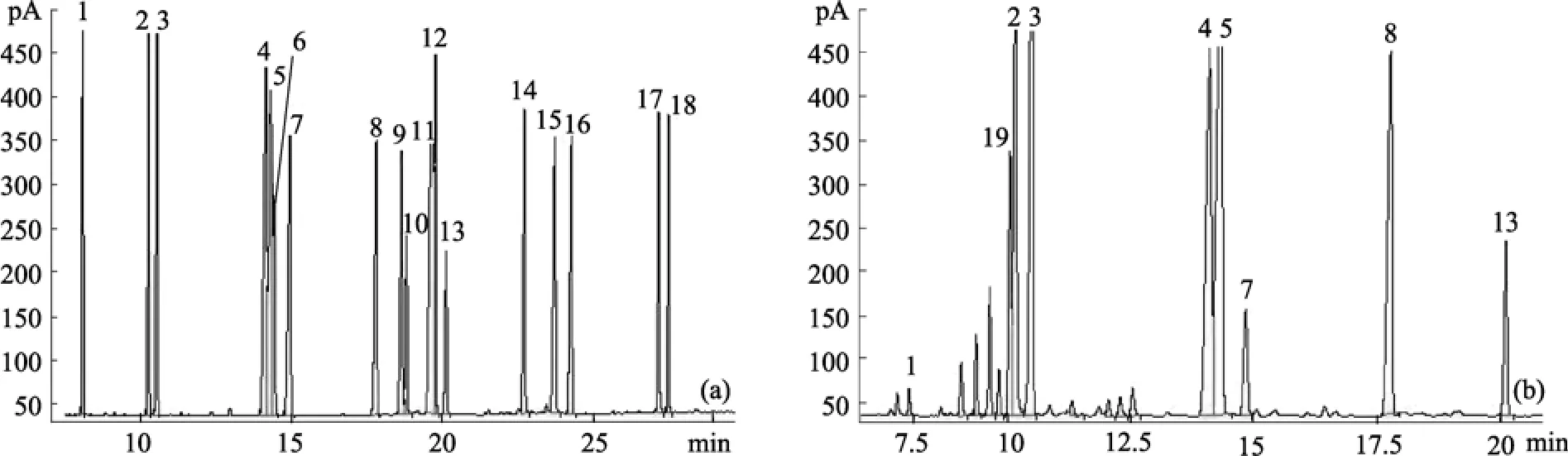
图1 标准脂肪酸甲酯(a)和小球藻脂肪酸甲酯(b)的气相色谱图Fig. 1 Gas chromatograms of fatty acid methyl esters for standard (a) and algae Chlorella (b)(1. C14:0, 2. C16:1, 3. C16:0, 4. C18:2, 5. C18:1+C18:3, 6. C18:1trans, 7. C18:0,8. C19:0, 9. C20:4,10. C20:5, 11. C20:1+C20:3, 12. C20:1trans, 13. C20:0, 14. C22:6,15. C22:1, 16. C22:0, 17. C24:1,18. C24:0, 19. C16:2)

图2 小球藻中顺-9,12-十六碳二烯酸甲酯(C16:2)质谱图Fig. 2 Mass spectrum of cis-9,12-hexadecadienoic acid methyl ester in algae Chlorella
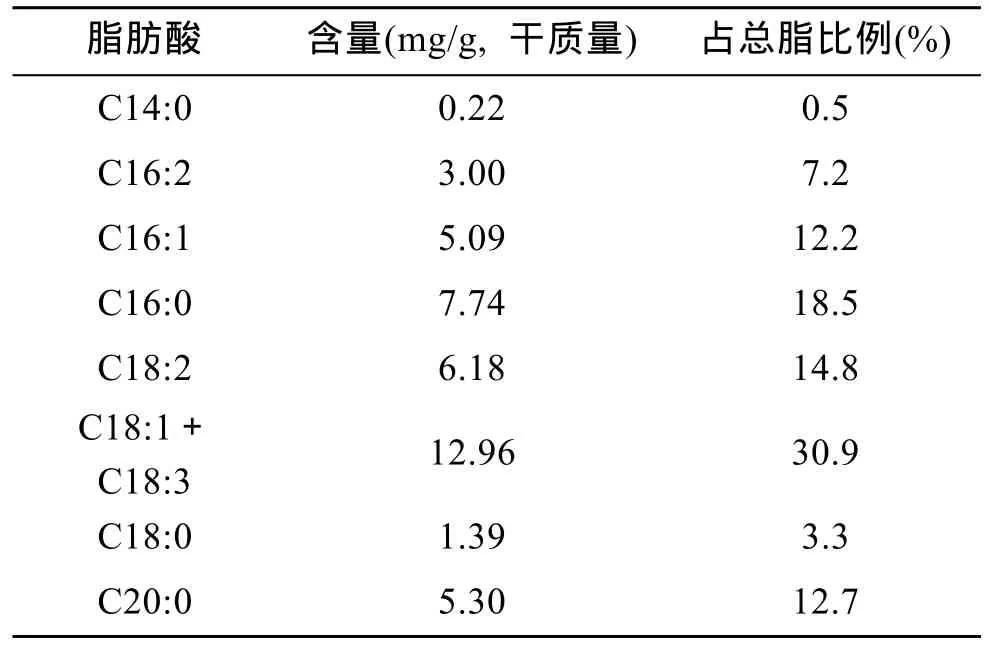
表2 小球藻脂肪酸组成Tab. 2 Composition of fatty acids in algae Chlorella
2.2 仪器检测限
脂肪酸甲酯标样稀释后用气相色谱分析, 计算3倍信噪比时的标样质量, 得到的仪器检测限如表 1所示, 各种脂肪酸甲酯的检测限为 0.02~0.29 ng,
说明仪器具有很好的灵敏度。
2.3 仪器精密度
取一份经抽提并甲酯化衍生的小球藻样品, 在气相色谱上重复进样 6次, 各组分的相对标准偏差(RSD)在 0.29%~5.34%之间(表 3), 说明仪器的精密度良好。
2.4 方法精密度
对同一小球藻样品, 平行称取6份, 经抽提甲酯化后用气相色谱分析, 其结果如表4所示。6份平行样品中各种脂肪酸甲酯的RSD为6.04%~9.84%, 说明方法的精密度良好。
2.5 加标回收率
称取约10mg藻粉3份, 分别加入低、中、高三种质量水平的各种脂肪酸标准, 经抽提甲酯化后用气相色谱分析, 其回收率范围分别为 77.0%~111.7%、78.8%~116.8%、86.9%~122.6%(表5), 说明该方法的回收率较好。
2.6 脂肪酸甲酯的保留时间规律
从表1可以看出, 脂肪酸甲酯在HP-5这种弱极性柱上的保留时间规律为: (1)保留时间与脂肪酸的碳数成正比, 即碳数越大, 保留时间越长; (2)从C18、C20和C22系列脂肪酸甲酯的相对保留时间可以看出, 对于相同碳数的各种脂肪酸甲酯, 饱和脂肪酸最后出峰, 双键数目越多, 保留时间越短, 同时双键数目为偶数的脂肪酸甲酯早于双键数目为奇数的脂肪酸甲酯出峰; (3)同一种脂肪酸甲酯, 顺式脂肪酸甲酯先出峰, 反式脂肪酸甲酯后出峰。根据上述
规律, 有利于在标准品种类不足或缺乏质谱定性时对脂肪酸组分进行推断。

表3 重复6次进样的分析结果(mg/g, 干质量)Tab. 3 Results of six injections for one sample (mg/g, dry weight)
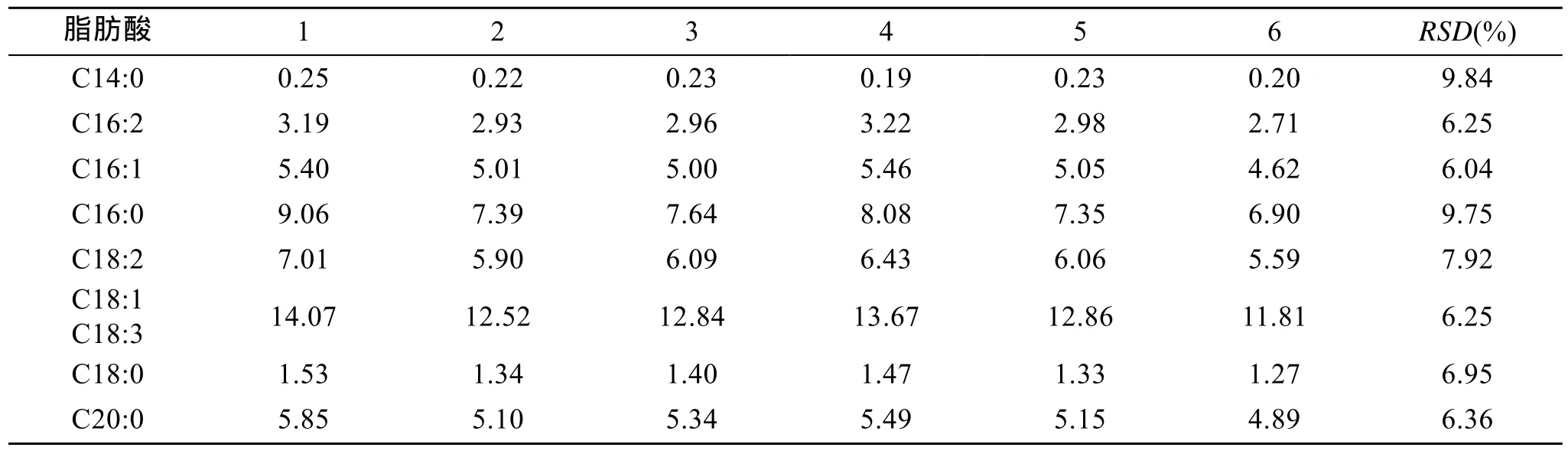
表4 小球藻平行样测定结果(mg/g, 干质量)Tab. 4 Results of six parallel samples for algae Chlorella (mg/g, dry weight)
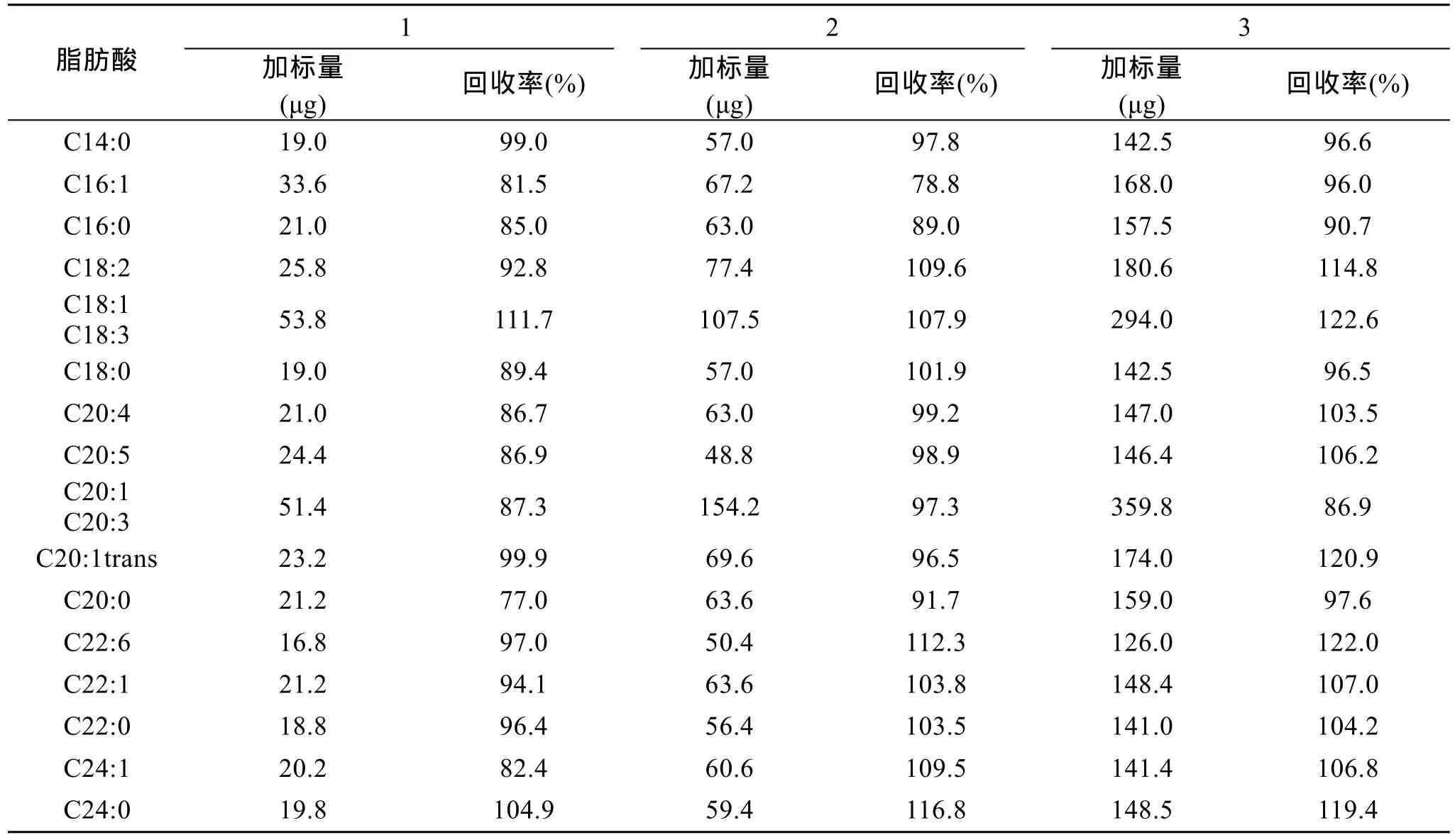
表5 小球藻样品加标回收率结果Tab. 5 Recoveries for spiked standards in samples
3 结论
建立了小球藻脂肪酸超声波破碎、抽提与甲酯化同时进行的前处理方法及气相色谱、气质联用仪的分析方法, 大部分脂肪酸甲酯得到较好的分离并经过质谱准确定性。各种脂肪酸甲酯的仪器检测限均小于 0.3ng, 实际样品的相对标准偏差为 6.04%~9.84%, 加标回收率77.0%~122.6%, 具有简便、快速、灵敏等特点, 可满足实际应用的需要。实验推断出的脂肪酸甲酯保留时间规律, 为脂肪酸的色谱分析提供了基础数据。
[1] Vincent A van Beelen, Bert Spenkelink, Hans Mooibroke, et al. An n-3 PUFA-rich microalgal oil diet protects to a similar extent as a fish oil-rich diet against AOM -induced colonic aberrant crypt foci in F344 rats[J]. Food and Chemical Toxicology, 2009, 47(2):316-320.
[2] Plaza M, Santoyo S, Jaime L, et al. Screening for bioactive compounds from algae[J]. Journal of Pharmaceutical and Biomedical Analysis, 2010, 51(2): 450-455.
[3] 倪学文. 海洋微藻应用研究现状与展望[J]. 海洋渔业, 2005, 27(3): 51-255.
[4] 李春颖, 仇雪梅.海洋微藻脂肪酸组成的研究进展[J].生物技术通报, 2008, 4: 63-65.
[5] 王文博, 高俊莲, 孙建光, 等. 螺旋藻的营养保健价值及其在预防医学中的作用[J]. 中国食物与营养,2009, 1: 48-51.
[6] 金骏, 林美娇. 海藻利用与加工[M]. 北京: 科学出版社, 1993: 301-306.
[7] Amanda K, Pettersen, Giovanni M, Turchini, Samad Jahangard, et al. Effect of different dietary microalgae on survival, growth, settlement and fatty acid composition of blue mussel(Mytilus galloprovincialis) larvae[J].Aquaculture, 2009, 309(1-4): 115-124.
[8] Zhukova N Y, Aizdaicher N A. Fatty acid composition of 15 species of marine microalgae[J]. Phytochemistry,1995, 39(2): 351-356.
[9] 褚宏大, 苏荣国, 王修林,等.东海赤潮高发区表层沉积物中部分脂类标记物的分布与来源[J]. 海洋科学,2008, 32(10): 68-76.
[10] 夏金兰, 万民熙, 王润民,等. 微藻生物柴油的现状与进展[J]. 中国生物工程杂志, 2009, 29(7):118-126.
[11] 徐继林, 叶芳挺, 严小军. 微量海洋微藻脂肪酸甾醇及游离氨基酸 GC/MS分析研究[J]. 中国药学杂志,2006, 41(24): 1895-1899.
[12] 王明清, 迟晓元, 秦松, 等. 海洋微藻总脂含量和脂肪酸组成测定[J]. 中国油脂, 2008, 33(11): 67-70.
[13] 许华, 潘灿平. 气相色谱-质谱法分析螺旋藻中脂肪酸[J]. 食品科学, 2009, 30(22): 280-282.
[14] 吕冬伟, 宋茜, 王旭晨. 小球藻和三角褐指藻中脂肪酸和长链烷烃组成的比较研究[J]. 海洋科学, 2009,33(5): 28-32.
[15] 蒋霞敏, 郑亦周. 14种微藻总脂含量和脂肪酸组成研究[J]. 水生生物学报, 2003, 27(3): 243-247.
[16] 程远月, 郑爱榕, 陈丁, 等. 天然胶体对微藻脂肪酸组成含量的影响[J]. 厦门大学学报(自然科学版),2005, 44(2): 259-263.
[17] Georgi Petkov, Guillermo Garcia. Which are fatty acids of the green alga Chlorella? [J]. Biochemical Systematics and Ecology, 2007, 35(5): 281-285.
[18] 廖启斌, 李文权, 陈清花, 等. 海洋微藻脂肪酸的气相色谱分析[J]. 海洋通报, 2000, 19(6): 66-70.
Determination of fatty acids in algae Chlorella by gas chromatography
ZHENG Xue-hong, ZHENG Ai-rong
(Department of Oceanography, Xiamen University, Xiamen 361005, China)
Mar.,1,2012
Algae Chlorella; Fatty acids; Gas chromatography; Gas chromatography/mass spectrometry; Retention time
A shortcut method to analyze fatty acids in marine algae quickly and easily was reported in the paper.The ultrasonic extraction was used in the pretreatment of algae Chlorella, then the fatty acids were converted to fatty acid methyl esters by 1 mol/L HCl-CH3OH. The composition of fatty acid methyl esters was analyzed with gas chromatography and gas chromatography/mass spectrometry. Nine fatty acids including C14:0, C16:2, C16:1,C16:0, C18:2, C18:1, C18:3, C18:0, C20:0 were found and the unsaturated fatty acids was 65% of total. The relative standard deviations of six parallel samples were 6.04%~9.84%. The recoveries for spiked standards in samples were 77.0%~122.6%. The limits of detection for instrument were below 0.3 ng. The rule of retention time for fatty acid methyl ester was investigated. This method is very simple, quick and accurate and could be used in practical application.
0657.71; P734.5
A
1000-3096(2012)06-0022-06
2012-03-01;
2012-03-20
国家教育部高等学校骨干教师计划基金资助项目; 厦门大学预研基金资助项目(B类 2003xdyy40); 国家海洋局公益性项目(201005012)
郑雪红(1977-), 福建龙岩人, 工程师, 研究方向: 从事海洋化学领域研究及色谱仪的功能开发, 电话: 0592-2186493 , E-mail:xhzheng@xmu.edu.cn
(本文编辑:康亦兼)

