金薄香核桃茎段初代培养的影响因素
牛 青,田建保,王国平
(1.山西大学生物工程学院,山西太原030006;2.山西省农业科学院,山西太原030006;3.山西省农业科学院果树研究所,山西太谷030815)
核桃(Juglans regia L.)属胡桃科胡桃属,是世界四大干果之一,有很高的经济、生态和社会效益以及潜在的营养、保健和医疗价值,在世界各地广泛栽培[1]。当前,在农业产业结构调整和加入世贸组织的新形势下,种植和发展核桃生产具有重要意义[2]。但作为异花授粉的果树,核桃实生繁殖常易丧失优良品种的特性,扦插又难以生根,嫁接繁殖也因接口处易发生褐变而成活率较低[3]。
组织培养以其快速繁殖苗木不受季节、时间、穗条数量限制和病虫害的影响,以及可周年生产试管苗的显著特点,被广泛应用于各种花草、果树苗木的培育[4]。同时,从遗传角度讲,利用组培技术还可得到高度一致、具有良好表现型的群体。
因此,20世纪60年代末,组织培养技术就已应用于核桃的快速繁殖。国外主要有奇异核桃、北加州黑核桃、东部黑核桃及普通核桃的成年树种组培快繁的报道[5];而国内侧重于普通核桃组织培养的报道较多,如核桃组培离体繁殖技术在取材方面、控制外植体褐化、培养基组成及生根方面都有了很大进展[6],尤其是针对核桃的茎段、芽、叶片、胚、子叶等作为外植体都有培养成功的报道[7-9]。近年来,国外利用组织培养技术已开始进行核桃优良品种商业化生产。
金薄香核桃是山西省农业科学院果树研究所经过近20 a的实生选育从新疆核桃中选育出的核桃优良新品种。该品种具有早实、壳薄、出仁率高、取仁易、品质优、丰产、抗逆性强等优良特性[10]。
本试验以金薄香核桃为试验材料,利用组织培养技术进行核桃茎段的快速繁殖,筛选出适合该品种组织培养的初代培养的最佳时间、最佳培养基及生长调节物质浓度的最佳配比,旨在为以后金薄香核桃的继代培养及生根培养提供理论支持。
1 材料和方法
1.1 试验材料
金薄香核桃茎段初代培养所取外植体材料为金薄香核桃母株的枝条。试验在山西省农业科学院果树研究所进行。
1.2 外植体材料的处理
将当年生核桃枝条的叶片去掉,仅留0.5 cm的叶柄,保湿带回实验室。先用洗洁精清洗1遍,然后用肥皂水清洗,再用自来水冲洗干净。用解剖刀将枝条截成单芽茎段,放在无菌水中。在超净工作台上用无菌水冲洗2次后,将茎段置于75%乙醇中浸泡30 s,再用0.1%HgCl2消毒7~10 min,最后用无菌水冲洗4~5遍,用滤纸将表面水液吸干,切去茎段的两头部分,接种到培养基中[7]。
1.3 培养基的制作
试验采用的基本培养基分别为MS,DKW,WPM,同时附加不同种类和浓度的生长调节物质,制成所需的培养基。各培养基均加入6 g/L琼脂粉,用1 mol/L的NaOH或1 mol/L的HCl调pH值至5.8~6.0。所有配好的培养基经高压蒸汽灭菌18~20 min(120~125℃,1.2个标准大气压)。抗生素经过滤灭菌,再加入经高温灭菌的培养基中。
1.4 金薄香核桃茎段初培最佳时间的选择
在金薄香核桃生长的季节(5月4日至9月12日),取当年生茎段为外植体,每月取材1次,1月20日取经过低温处理的休眠枝条为外植体,共6个处理,每个处理3次重复。每处理接种外植体50瓶,接种方式为竖直插入,每瓶1个茎段,培养基为MS+6-BA2.0 mg/L+IBA0.3 mg/L。接种3周后,统计污染率、褐化率、萌发率。
1.5 金薄香核桃茎段初培最佳培养基选择试验
试验采用L9(34)正交试验设计,试验因素及水平排列为:A.基本培养基为 MS(A1),DKW(A2),WPM(A3);B.6-BA 质量浓度为 0.5(B1),1.0(B2),2.0(B3)mg/L;C.IBA 质量浓度为 0.1(C1),0.3(C2),0.5(C3)mg/L;D.庶糖质量浓度为20(D1),30(D2),40(D3)g/L。共 9 个处理,每处理接种30瓶,每瓶1个茎段,重复2次。初代培养约20 d左右调查萌发率。
在培养过程中,培养条件为(26±2)℃,空气相对湿度75%左右,光周期14 h/d,日光灯作为光源,光照强度2 000~3 500 lx。
2 结果与分析
2.1 金薄香核桃茎段初培最佳时间的选择
对采自不同时期的外植体茎段进行试验。从表1可以看出,不同生长季节的外植体茎段对初培的污染率、褐化率和萌发率有明显的影响。造成污染的主要原因是霉菌污染和内生菌污染。污染率随着取材时间的推移而升高,主要是由内生菌污染率的明显提高造成的。而休眠枝的污染率明显降低的原因是新抽生的枝条和5,6月份的枝条一样,枝条内部的内生菌数量很少。褐化率在生长季节没有明显的区别。萌发率为5,6月份较高,分别为86.4%和85.1%,且随着时间的推移,萌发率逐渐降低。而休眠枝的萌发率相对较高,这是因为休眠枝的污染率较低的缘故。因此,生长季节核桃茎段的初代培养以5,6月份最好;经过冬季低温处理的休眠枝的初培效果也不错,只是枝条要经过低温处理并水培萌发,程序多,较麻烦。所以,生长季节的5,6月份做核桃的初代培养最好。
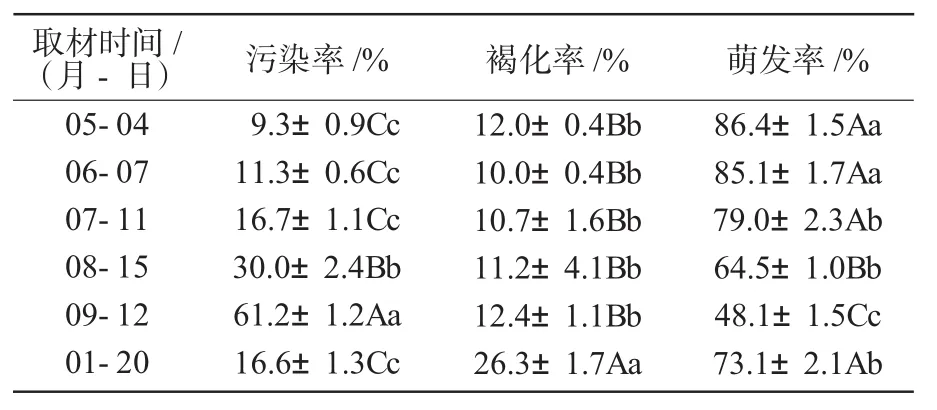
表1 不同取材时间对金薄香核桃初培中污染率、褐化率、萌发率影响的多重比较
2.2 金薄香核桃茎段初培最佳培养基选择
由表2可知,最优的组合是A3B3C2D2,即在WPM培养基中,添加6-BA2.0mg/L,IBA0.3 mg/L,蔗糖30 g/L,但这并没有在本试验中反映出来;而从实际来看,最佳组合为处理2,即在MS培养基中,添加 6-BA 1.0 mg/L,IBA 0.3 mg/L,蔗糖30 g/L。因此,在进一步的试验中,可以验证这2个培养基的优劣。极差值越大,表示该因素越重要。表2显示,4个因素中,IBA的极差最大,表明最重要的是IBA,其次依次是6-BA、基本培养基和蔗糖。
从表3可以看出,初代培养最佳培养基的最优组合是处理2,且它与其他组合相比,有显著性差异。

表2 核桃初代培养最佳培养基选择
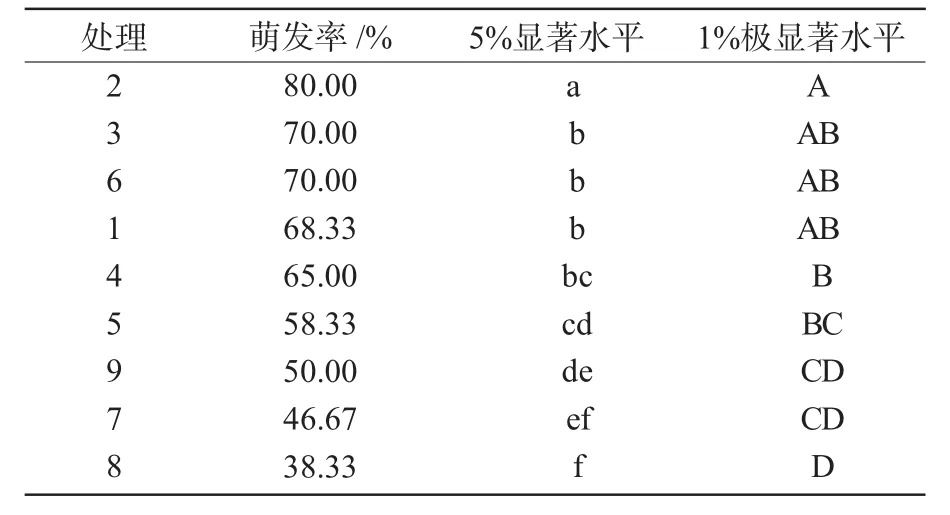
表3 核桃初代培养最佳培养基的多重比较
3 讨论和结论
在核桃的初代培养中,外植体的取材时间是初代培养成功的关键。因为核桃是多年生木本植物,核桃枝条暴露在田间,菌类滋生,还有的细菌甚至渗透到组织内部,因此,试验中外植体即使经过细致的表面灭菌,仍然有污染情况出现。同时,外植体的褐变是初培失败的主要原因。而外植体取材时间的不同,外植体的污染率和褐化率变化很大。本试验结果表明,外植体取材最佳时间是5—6月,此时污染率、褐化率相对较低,而萌发率有大幅度的提高。主要原因是此时采集的外植体材料生活力强,对外源激素敏感,反应强,分化能力也较强。同时,初代培养基的选择、外源生长调节剂的添加等也是促使外植体芽体萌发的主要影响因子。正交试验结果表明,在MS培养基中,添加 6-BA 1.0 mg/L,IBA 0.3 mg/L,蔗糖30 g/L,外植体萌芽效果最好。
[1]王娟,田建保,贺小红,等.“金薄香”核桃组培中灭菌及防止褐变的研究[J].山西农业大学学报,2008,28(3):290-292.
[2]霍晓兰,刘和,冀爱青.植物生长调节剂在核桃上的应用[J].山西农业科学,2003,31(1):34-39.
[3]王琴.核桃试管微繁增殖培养基的筛选 [J].甘肃林业科技,2003,28(4):16.
[4]王国平,李晓梅.核桃无根试管苗微枝嫁接技术[J].山西果树,2006(1):28-29.
[5]Driver J,Kuniyuki A.In vitro propagation of Paradox walnut rootstock[J].Hort Science,1984,19:507-509.
[6]刘淑兰,韩碧文.核桃愈伤组织的诱导[J].植物生理学通讯,1984(4):38.
[7]张进,张燕,吴国良,等.核桃茎段组织培养[J].经济林研究,2005,23(2):36-38.
[8]曹孜义.实生植物组织培养技术教案[M].兰州:甘肃科学技术出版社,1999.
[9]裴东,袁丽釵,谷瑞升.核桃子叶不定根发生调控的研究[J].林业科学,2003,39(6):33-40.
[10]田建保,陈秋芳,程恩明,等.核桃新品种:金薄香1号[J].山西果树,2005(2):3.

