基于六西格玛管理的药品生产内控标准制定方法研究
北京市药品监督管理局昌平分局(102200)徐立民 张来俊 梁建贞 董磊
根据休哈特控制图原理和六西格玛管理理论[1],在药品生产过程中,在严格控制生产过程的前提下,影响药品质量属性的工艺参数在控制范围之内有微小波动属于正常现象。为防止波动过大导致过程失控而出现非预期的偏差,药品生产质量管理规范(2010年修订)(以下简称新版GMP)管理提出质量风险管理,提出警戒限度与纠偏限度的管理理念,企业内控标准中的这些限度值如何设定才能达到理想效果?
笔者通过调查研究辖区14家药品生产企业的质量管理水平,发现部分企业制定的内控标准不合理,没有根据产品质量年度回顾分析结果,确认工艺稳定可靠性,没有确认原辅料、成品现行质量标准的适用性。本文基于六西格玛管理相关理论,讨论如何结合实际生产的历史数据制定科学合理的企业内控标准。
1 内控标准的理解
1.1 企业内控标准
药品生产企业内控标准是生产企业制定的工艺参数控制标准和严于国家药品标准的产品质量检验标准。内控标准包括原辅料、包材、中间体、半成品和成品的质量内控标准,工艺参数的上、下控制限度。在新版GMP中提出的警戒限度与纠偏限度,也应该是企业内控标准的一部分。
1.2 新版GMP的要求
新版GMP规定,如果系统的关键参数超出了“可接受标准”(法定标准或企业制定的内控标准),就需要启动偏差处理程序。按照GMP产品质量回顾分析的要求,药品生产企业必须对过去的批生产记录、批检验记录进行回顾性分析。以此修改完善工艺规程和标准操作规程。
1.3 企业内控标准设定的目的及意义
在法定标准的基础上制定更加严格的企业内控标准,是加强药品生产过程的质量控制,确保药品安全、有效的重要举措。制定科学合理的内控标准,才能持续稳定地生产出符合预定用途和注册要求的药品。
2 基本概念和原理
2.1 基本概念
警戒限度是系统的关键参数超出“正常范围”,但是未达到纠偏限度,需要引起警觉,可能需要采取纠正措施的限度标准[2]。
纠偏限度是系统的关键参数超出“可接受标准”,需要进行调查并采取纠正措施的限度标准[2]。
规格限度是六西格玛管理理论提及的概念,它是过程能力分析时必须使用的参数。规格限度由国家法定标准、客户的合同要求以及企业制定的内控标准确定。控制限度是休哈特控制图原理中提到的概念,用以区分偶然波动与异常波动,并用以考察过程是否稳定受控。常用±3σ来求得上、下控制限,σ为标准差。
严格受控的过程通常是在上下控制限度内波动,上、下控制限确定的范围应该就是警戒限度概念中提及的“正常范围”。规格限度与纠偏限度形式上虽是两个不同的概念,但本质上属于同一个概念。
以葡萄糖注射液的含量为例,《中国药典》(2010版)二部规定,葡萄糖注射液含葡萄糖应为标示量的95.0%~105.0%。法定标准规定的规格限度就是95.0%~105.0%,容差T=10%;目标值M与有效成分标示量相关,M=100.0%。见下图所示:
在新版GMP中,对制药用水微生物总数,洁净车间内尘埃粒子数及微生物总数,提出了制定警戒限度与纠偏限度的要求。对于其他需要严格控制的关键生产工序,可参照执行。
2.2 从严制定企业内控标准,过程能力应满足的前提条件
基于休哈特控制图原理和六西格玛管理理论,生产过程控制能力务必要达到四西格玛质量水平。按法定标准规定的规格限度计算过程能力指数,CPK值务必大于或等于1.33。否则,过程控制能力不足,就要改进过程控制。对于某些关键工序的工艺参数,如果没有法定标准要求,其过程能力也要充分满足研发设计的要求,CPK值也要务必大于或等于1.33。

注释:控制点1处设置警戒限度;在控制点2处设置纠偏限度
按法定标准判定过程能力充裕前提下,才能从严制定企业内控标准。基于六西格玛管理理论,在顾及纠偏概率的基础上,设置警戒限度和纠偏限度。
2.3 利用控制图原理判断过程的稳定性
根据控制图判异的“八原则”判断过程的稳定性[3]。若违背控制图的任何一条原则,则过程不稳定,企业应采取纠正措施,调查原因,消除影响质量波动的因素,确保过程能力指数CPK值能达到要求。
2.4 在过程稳定的基础上,根据CPK的大小设定企业内控标准

其中,USL为规格上限;LSL为规格下限;T为容差,即规格上限(USL)减去规格下限(LSL)的差值;ε为实际分布中心μ值与目标值M的偏移量,即ε=∣M-μ∣;σ为过程分布的标准差;CPU为上单侧过程能力指数;CPL为下单侧过程能力指数。
有双侧规格限度的过程,才有中心目标值M。对于成品质量指标,目标值M由国家药品标准规定;对于生产工艺参数的控制标准,如果国家药品标准中没有明确规定的,企业应在研发设计阶段设定上、下控制限度和中心目标值M。
以法定标准或企业研发设计的工艺参数控制标准,作为规格限度,计算过程能力指数。按过程能力指数的大小分类,有下述三种情形。
2.4.1 当CPK>2时,过程控制能力过度充裕
说明法定标准或研发设计的工艺参数控制标准过于宽松,要从严制定企业内控标准。具体计算方法与过程能力充裕时的情形相同。
2.4.2 当1.33≦CPK≦2时,过程能力充裕
按过程能力指数计算公式,可推出T=6σ×CPK+2ε,根据六西格玛设计原理,令过程能力指数CPK=1,求得T=6σ+2ε。T值确定之后,建立如下一元二次方程:

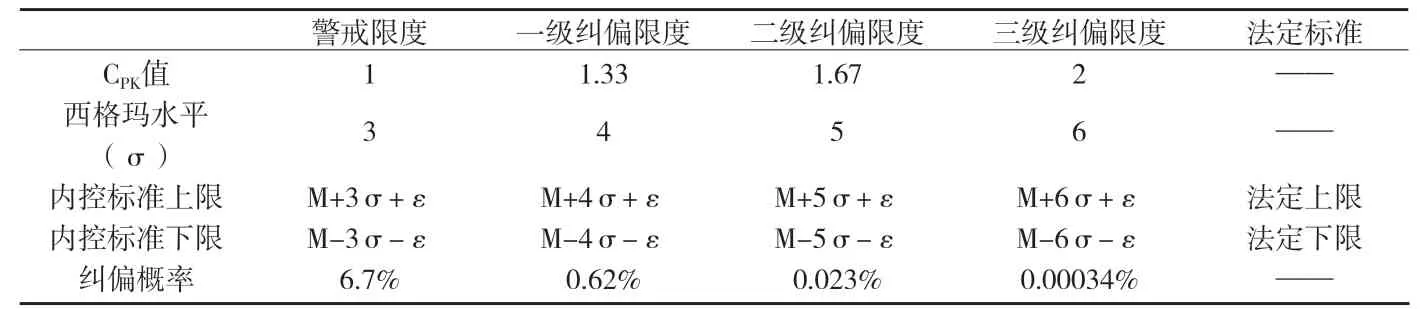
附表1 警戒限度及各级内控标准设定的范围和纠偏概率表

附表2 XX化学药胶囊剂24批的成品主成分相对百分含量
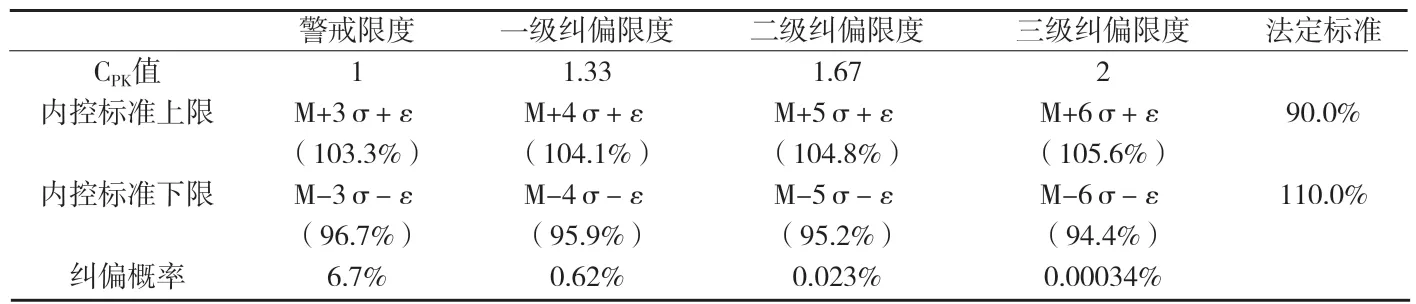
附表3 XX化学药胶囊剂警戒限度与纠偏限度计算结果
可求出USL=M+3σ+ε和LSL=M-3σ-ε。求得的USL作为警戒上限;求得的LSL作为警戒下限。
采用同样的方法计算纠偏限度,分别令过程能力指数CPK=1.33;CPK=1.66;CPK=2,分别求得USL和LSL。CPK=1.33,对应一级纠偏限度;CPK=1.66,对应二级纠偏限度;CPK=2,对应三级纠偏限度。
企业可根据实际生产情况,选择合理的限度作为纠偏限度。按上述办法,不同的纠偏限度,纠偏概率也不一样,其关系见附表1。
2.4.3 当CPK<1.33时,过程能力不足过程能力指数计算公式
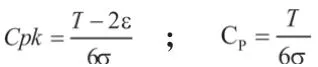
从过程能力指数计算公式可以看出,影响过程能力指数CPK大小有三个因素:容差T值、过程漂移量ε值、过程控制标准差σ值。
如果CPK<1.33,但CP≥1.33,此时优先考虑减小ε值。让实际过程分布中心μ值尽可能接近规格中心M值。如西药有效成分的相对百分含量的平均值μ小于目标值100.0%,可采用追加投料的方法,提高平均含量μ值。
如果CPK<1.33,同时CP<1.33,此时优先考虑减小σ值。减小σ的措施,应分析人、机、法、料、环、测六要素对过程的影响,加强过程控制。
特别注意,一定要谨慎选择扩大T值的办法。采取上述两项措施后,过程能力仍然不足,说明容差T值过小。容差T值如果是企业制定的内控规格限度,相对法定标准还有放宽的余地,可增加T值,但不得比法定标准更宽松。如果T值就是法律法规设定的规格限度,企业就不可放大T值,应该考虑和分析过程设计是否存在重大缺陷。
3 案例分析
3.1 有双侧控制限的实例
以某企业的XX胶囊剂成品的含量为例,按《中国药典》(2010年版)二部规定,本品含X X 应为标示量的90.0%~110.0%。企业制定的内控标准为93.0%~107.0%。
第一步:收集该产品连续的24批成品的含量,见附表2。
第二步:判断过程能力是否满足6σ管理要求,用Minitab软件做出该组数据的六合图,见上图。
从右上方的能力直方图和右中方的正态概率图可看出该过程是呈正态分布的,P值为0.888(P>0.05);从左上方的单值控制图、左中方的移动极差控制图和最后25个观测值的散点图可看出无异常点出现,该过程是稳定的;从右下方的能力图可看出,该过程的过程能力指数CP值为4.43,CPK值为3.96,CP值与CPK值都大于2。以法定标准90.0%~110.0%作为规格限度,判定过程能力非常充裕,远远地超出了六西格玛管理的目标。
第三步:在过程稳定的前提下,计算警戒限度与纠偏限度。
分析六合图,可得到μ和σ二个重要参数的估计值。其中,用估计μ的大小,由单值控制图得=98.929%,即μ≈98.929%。用组内标准差估计σ的大小,σ≈0.7516%。有效成分含量目标值M=100.0%,实际过程漂移量=∣Mμ∣=∣100.0%-98.929%∣=1.071%。计算结果见附表3。
第四步:判断现行企业内控标准的适用性。
根据计算结果,当采用三级纠偏限度94.4%~105.6%作为企业内控标准时,纠偏的可能性有0.00034%。如按此标准判断,生产一百万批次的产品,约有3.4批产品需要采取纠偏措施。企业现行的内控标准93.0%~107.0%,与三级纠偏限度相比,过于宽松,可将内控标准修订为94.4%~105.6%。
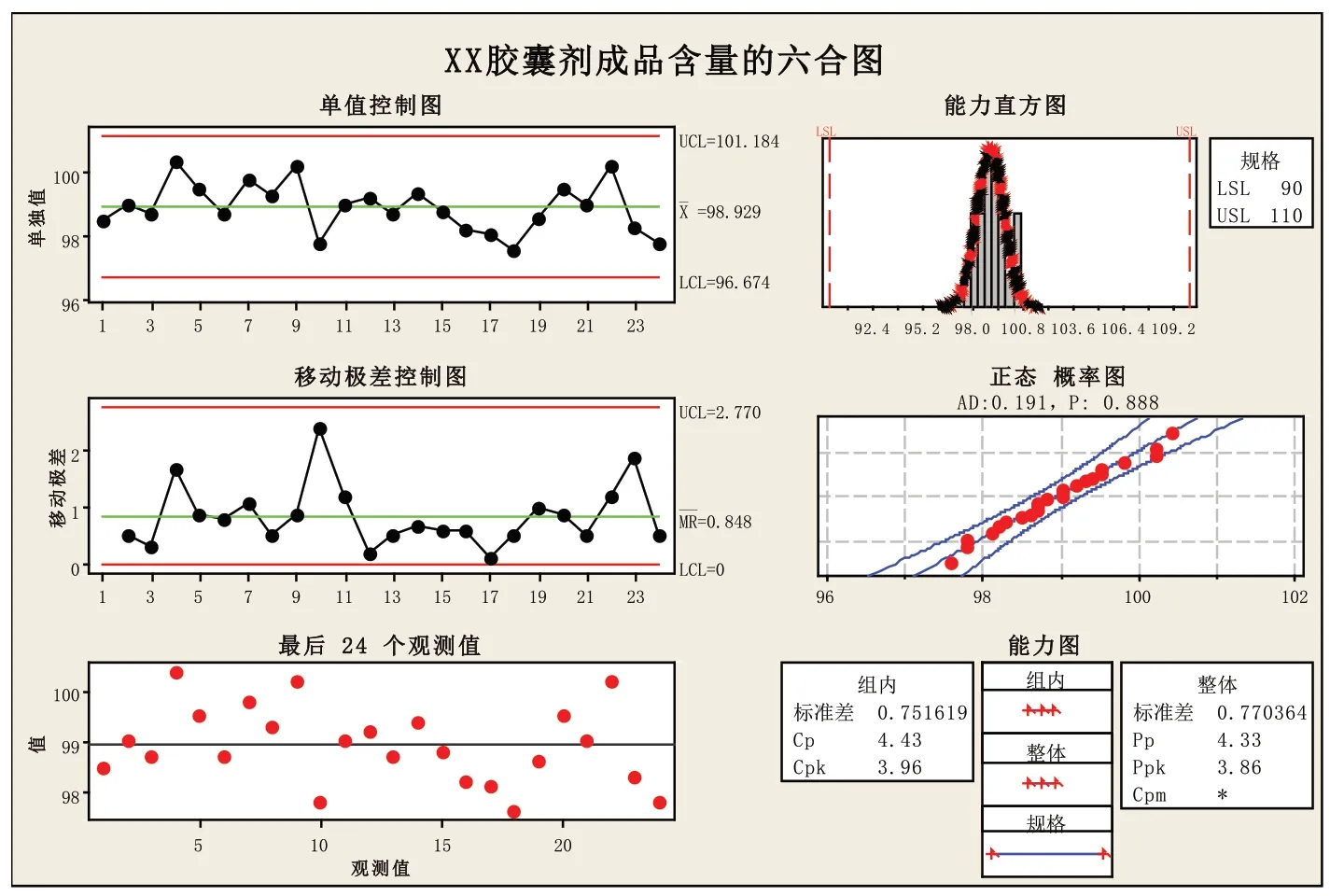
XX化学药胶囊剂24批的成品主成分含量的六合图
3.2 只有单侧规格限度的情形
对只有单侧控制限的情形,因为没有目标值,就没有过程漂移。内控标准的计算过程要比有双侧控制限的计算过程简单,只是在最后的计算公式上稍有区别。
3.2.1 只有上侧规格限度的情况
3.2.2 只有下侧规格限度的情况
4 展望
4.1 本方法的适用性
药品生产企业按照新版GMP的要求,开展年度质量回顾分析工作,必须基于统计学原理,才能对企业制定的内控标准的适用性做出科学合理的评价。要进行统计学分析,就必须有大量的历史数据。因此,此方法仅适用于已经上市且生产批次较多(建议30批以上)的产品。对于新上市或年生产批次很少的产品,企业可积累数据,按GMP的要求,适时开展年度质量回顾工作或趋势分析,加强质量监控。
4.2 关于警戒限度与纠偏限度
在新版GMP中,对制药用水的微生物限度,药品生产洁净环境的尘埃粒子数和微生物个数,提出了制定警戒限度与纠偏限度的要求。尘埃粒子数、微生物总数属于计数型数据。因此,不能用正态分布规律去估计总体分布的均值和标准差。这两项计数型质量指标服从于泊松(Poisson)分布,应使用泊松分布规律去估计总体分布的均值和标准差。
4.3 关于中药制剂
新版GMP要求中药制剂企业,制定中药提取物的收率限度范围。中药材作为中药制剂生产原料,其提取物的收率波动范围也很大。但无论有多大,理论上也应服从正态分布。但实际有待结合具体案例进行分析研究。
4.4 其他方面当前,医疗器械生产企业正在实施GMP,保健食品生产企业GMP正在制定过程中。

