常压下甲醇-原甲酸三甲酯体系汽液平衡数据的测定及关联
李春利,张凤娇,方 静
(河北工业大学化工学院,天津 300130)
研究开发
常压下甲醇-原甲酸三甲酯体系汽液平衡数据的测定及关联
李春利,张凤娇,方 静
(河北工业大学化工学院,天津 300130)
采用双循环汽液平衡釜测定了101.3 kPa下甲醇-原甲酸三甲酯二元体系在337~372 K的等压汽液平衡数据。实验数据经Herington面积积分法检验,满足热力学一致性。分别采用Wilson、NRTL、UNIQUAC活度系数模型对实验数据进行关联,得到了模型参数。并对汽液平衡的计算值与实验值进行比较,两者吻合良好,其中由Wilson方程关联得到的数据与实验数据偏差最小,平均温度偏差和汽相组成偏差分别为0.57 K和0.0092。本工作为工程设计提供了基础数据。
汽液平衡;甲醇;原甲酸三甲酯;测定;关联
原甲酸三甲酯(TMM)[1],又名三甲氧基甲烷,是重要的有机合成中间体,广泛应用于医药、染料、香料等领域。近年来,原甲酸三甲酯作为燃料替代甲醇的研究受到广泛关注[2-3]。在氢氰酸法[4]生产原甲酸三甲酯过程中,得到含有原甲酸三甲酯、甲醇的混合物,需进一步精馏分离。然而关于甲醇和原甲酸三甲酯的汽液平衡数据尚未见文献报道。本文作者采用双循环汽液平衡釜测定了101.3 kPa下甲醇和原甲酸三甲酯二元体系的汽液平衡数据,并分别采用 Wilson[5]、NRTL[6]、UNIQUAC[7]活度系数模型对数据进行关联,得到了模型参数。以期为工艺模拟和工程设计提供基础数据。
1 实验部分
1.1 实验试剂
无水甲醇,分析纯,质量分数≥99.5%,天津市江天化工技术有限公司生产;原甲酸三甲酯,分析纯,质量分数≥99.0%,天津市江天化工技术有限公司生产。所用试剂主要物性参数如表1所示。
1.2 实验装置
1.2.1 汽液平衡装置
汽液平衡数据采用双循环汽液平衡釜[8]测定,实验装置如图1所示。温度由经过标定的精度为0.1 K的水银温度计测定。压力控制系统由真空泵和U形压差计组成,通过调节真空泵使压力维持在101.3 kPa。

图1 汽液平衡测定装置
1.2.2 检测装置
汽液组成分析采用北京北分瑞利分析仪器有限公司生产的3420 A型气相色谱仪,FID检测器。色谱柱为 50 m×0.32 mm×0.5μm的毛细柱。柱温、汽化室温度、检测器温度分别为90 ℃、 200 ℃、150 ℃。载气为氮气,流量为30 m L/min;氢气流量为30 m L/min;空气流量为300 m L/m in;进样量0.3 μL。
1.3 装置的准确性校验
为验证实验装置的可靠性,用双循环汽液平衡釜测定了常压下苯-甲苯的汽液平衡数据,将实验值与文献值[9]对比,如图2所示。其中苯的汽相平均偏差为0.0032,最大偏差为0.0087。实验值与文献值基本吻合,说明此套装置可以用于测量汽液平衡数据。
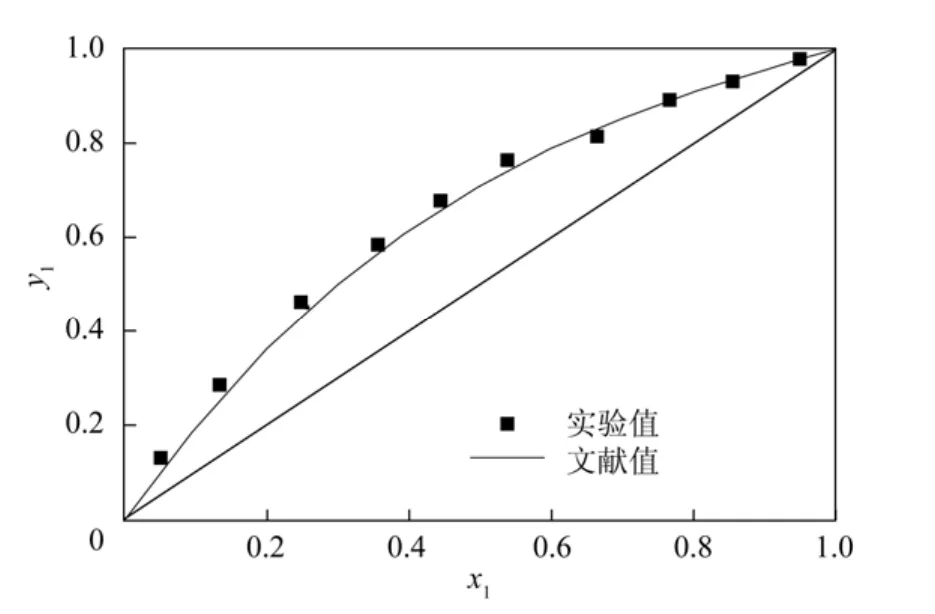
图2 苯-甲苯体系汽液平衡数据实验值与文献值对比
2 结果与讨论
2.1 汽液平衡数据的测定结果
在常压(101.3 kPa)下,测定了甲醇-原甲酸三甲酯二元体系的汽液平衡数据,测得的甲醇汽、液相摩尔分数见表2。
常压下汽相可视为理想气体,汽液平衡关系式可以简化为式(1)。

式中,下角标i为组分甲醇和原甲酸三甲酯;γ为活度系数;ps为饱和蒸汽压;xi、yi分别为组分的液相摩尔组成和汽相摩尔组成。根据式(1)可计算出相应的活度系数,结果见表2。
2.2 热力学一致性检验
热力学一致性检验的基础是Gibbs-Duhem方程[10]。本文采用Herrington面积检验法[11]对实验数据进行了热力学一致性检验。以In(γ1/γ2)对x1作图,x1为横坐标,在横坐标上的面积为A,在横坐标下的面积为B,如图3所示。设D=100×[(A-B)/(A+B)],J=150×[︱ΔTmax︱/Tmin],其中ΔTmax是两组分的沸点差,Tmin是体系的最低沸点。对甲醇-原甲酸三甲酯体系,D=15.59,J=15.63,D<J,说明所测数据是符合热力学一致性的。
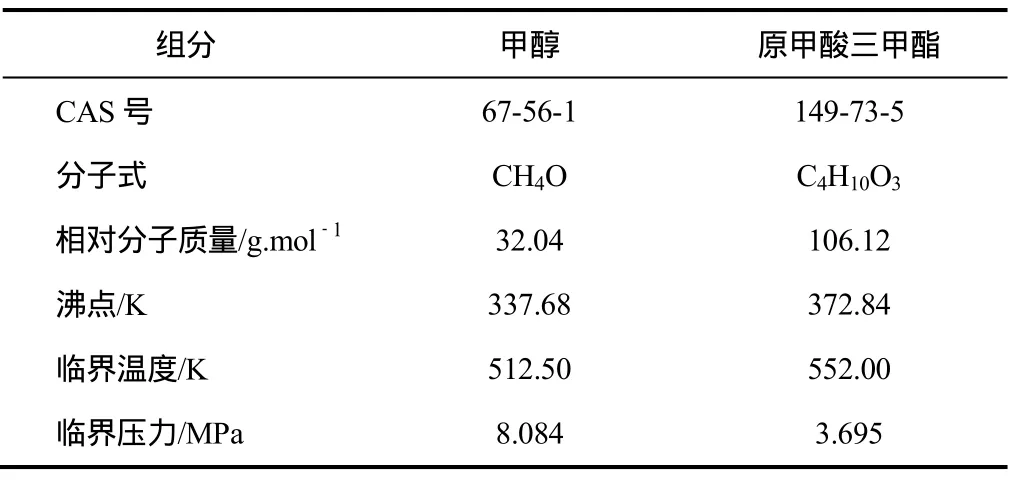
表1 所用试剂的主要物性参数

表2 甲醇+ 原甲酸三甲酯在101.3 kPa下的汽液平衡数据
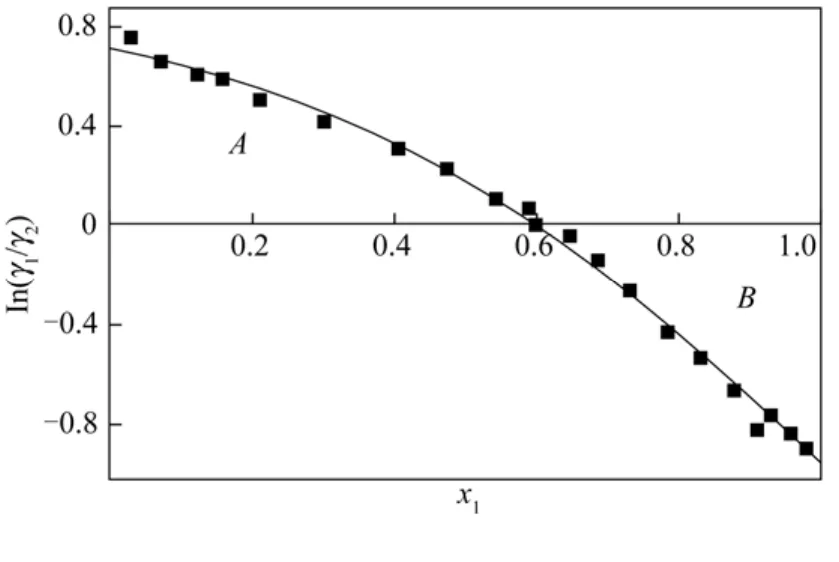
图3 热力学一致性检验
2.3 汽液平衡数据的关联
对实验数据分别采用Wilson、NRTL、UNIQUAC方程进行关联,选定目标函数如式(2)所示。

式中,N代表实验的数据点,exp、cal分别代表实验值和计算值。关联得到的二元交互作用参数以及温度和汽相组成的偏差分别列于表3。

表3 二元交互作用参数和偏差

由表3可得,由Wilson方程关联得到的温度和汽相组成偏差最小,其汽液组成相图见图4所示。由图4可知,在富甲醇段,相图有一挟紧段,说明要想精馏得到高纯度的原甲酸三甲酯存在一定困难。
3 结 论

图4 甲醇-原甲酸三甲酯体系中甲醇的汽液组成
(1)利用双循环汽液平衡釜测定了常压下甲醇-原甲酸三甲酯二元体系汽液平衡数据,实验结果经 Herrington面积积分法检验,符合热力学一致性。
(2)所得数据分别用 Wilson、NRTL和UNIQUAC方程相关联,分别得到了二元交互作用参数。其中,由Wilson方程关联得到的结果与实验值的偏差最小,平均温度偏差和甲醇的汽相摩尔偏差分别为0.57 K和0.0092。本工作在过程模拟以及工程设计中具有实用价值。
[1] Ohorodnik A,Neumaier H,Sennewald K. Process for the manufacture of orthoformic acid alkylesters. US,3641164[P]. 1972-02-08.
[2] Raghuram C,Keith S. Dimethoxymethane and trimethoxymethane as alternative fuels for fuel cells[J].Journal of Power Sources,2007,173:166-171.
[3] Prakash G K S,Smart M C,Olah G A,et al. Performance of dimethoxymethane and trimethoxymethane in liquid-feed direct oxidation fuel cells [J].Journal of Power Sources,2007,173:102-109.
[4] 雷洪. 氢氰酸法合成高品质原甲酸三甲酯[J]. 精细化工,2008,25(1):94-97.
[5] W ilson G M. Vapor-liquid equilibrium. XI. A new expression for the excess free energy of mixing[J].Am. Chem. Soc.,1964,86:127-130.
[6] Renon H,Prausnitz J M. Local compositions in thermodynamic excess functions for liquid mixtures[J].AIChE J.,1968,14:135-144.
[7] Abrams D S,Prausnitz J M. Statistical thermodynam ics of liquid m ixtures:A new expression for the excess Gibbs energy of partly or completely m iscible systems[J].AIChE J.,1975,21:116-128.
[8] 张文林,侯凯湖,米冠杰,等. 噻吩-正辛烷体系等压汽液相平衡研究[J]. 高校化学工程学报,2007,21(6):911-913.
[9] Gmehling J,Onken U,Arlt W. Vapor-Liquid Equilibrium Data Collection,Organic Hydroxyl Compounds:Alcohols[M]. Germany:D,1982.
[10] 朱自强,徐汛. 化工热力学[M]. 北京:化学工业出版社,1980.
[11] Herington E F. Herington test for the consistency of experiment isobaric vapor-liquid equilibrium data[J].Inst.Pet.,1951,37:457-470.
[12] Zhang W L,Hou K H,M i G J. Liquid-liquid equilibria of ternary systems sulfide + octane + solvents at different temperatures[J].Chem. Eng. Data,2008,53:2275-2281.
[13] Walas S M. Phase Equilibria in Chemical Engineering[M]. Boston:Butterworth,1985.
Determ ination and correlation of VLE data for methanol and trimethoxymethane system at 101.3 kPa
LI Chunli,ZHANG Fengjiao,FANG Jing
(School of Chem ical Engineering, Hebei University of Technology, Tianjin 300130, China)
Isobaric vapor-liquid equilibrium data for the binary system of methanol and trimethoxymethane (TMM) were measured at 101.3 kPa over the temperature range of 337-372 K using a double circulating vapor-liquid equilibrium still. The experimental data were thermodynamically consistent according to the Herington test and were correlated w ith the NRTL, Wilson and UNIQUAC models, respectively. All the models were satisfactorily correlated w ith the VLE data. The data calculated by the W ilson model were the best, and the average deviations of temperature and vapor-phase mole fraction of methanol were 0.57 K and 0.0092, respectively. These data would be helpful to engineering design.
VLE; methanol; trimethoxymethane(TMM); determination; correlation
O 642.42
A
1000–6613(2012)07–1454–04
2011-12-22;修改稿日期:2012-03-21。
河北省高等学校科学技术研究重点项目(ZH20112242)。
李春利(1963—),男,教授,博士生导师,从事新型分离工艺过程研究。E-mail ctstlcl@163.com。联系人:方静,副教授,从事新型分离工艺过程研究。E-mail ctstfj@hebut.edu.cn。

