芦花鸡PRKAG3基因单核苷酸多态性及与肉质性状的相关性分析
哈桑·阿巴克,张永宏,郭 将,李传民,马 倩,赵衍铜,邱峥艳,张嘉保,赵志辉*
(1.吉林大学 畜牧兽医学院,吉林 长春 130062;2.吉林大学 实验动物中心,吉林 长春 130062)
AMPK(adenosine monophosphate activated protein kinase)是一种能被腺苷一磷酸(AMP)激活的蛋白激酶,在动物应激时通过改变机体内脂类和糖代谢起着重要作用。AMPK是一个异三聚体酶复合体,包含一个催化α亚基,以及调控的β和γ亚基。7个不同的亚型(α1,α2,β1,β2,γ1,γ2 和γ3)由不同的基因编码。部分研究表明,在AMPK亚基基因中自然出现的突变能引起显著的表型效应。PRKAG3基因是编码一磷酸腺苷激活蛋白激酶(AMP-activated protein kinase,AMPK)调节亚基 γ3的基因,包含13个外显子和12个内含子,主要在骨骼肌中 表 达[1,2], 与 糖 代 谢 有 关, 通 过 调 节AMPK的活性来调节机体的能量平衡,通过磷酸化作用抑制糖原合成酶活性,降低糖原的合成速率,促进肌肉对葡萄糖的吸收能力,从而提高骨骼肌中肌糖原含量,进而对肉质品质产生影响[3~5],是近年来确定的一个影响猪肉质pH值、肉色以及系水力的主效基因。
目前,国内外对芦花鸡PRKAG3基因的相关研究报道比较少,因此研究其肉质性状与遗传标记之间的关系将具有重要的理论和现实意义。本研究以芦花鸡为研究对象,以PRKAG3基因作为候选基因,采用PCRSSCP的方法分析PRKAG3基因外显子11多态性,并与肉质性状的相关性进行分析,旨在进一步认识芦花鸡种质特性,以期对芦花鸡的选种、早期选育、杂种优势的利用等提供基础参数,为芦花鸡改良育种和新品系的培育提供理论依据和实验基础。
1 材料与方法
1.1 实验材料
本实验屠宰的芦花鸡均来自吉林省农业科学院,饲养环境和条件相同,从而避免了牧场效应和环境因素对试验结果的影响。87只芦花鸡颈静脉放血处死后取其胸肌组织,一侧胸肌用于基因组DNA的提取,-20℃冰箱中保存备用,另一侧胸肌用于肉质性状的测定。
1.2 常规肌肉品质测定
pH值:在屠宰后45 min内用pH-start普通版酸度计测定。
肉色:使用OPTO-start普通版测定。
剪切力:将胸肌放入75℃的水浴锅中,水浴加热至中心温度达到70℃,保持5 min取出,冷却至室温,用直径为1.27 cm的空心取样器沿肌纤维方向钻取3个肉柱,然后用C-LM3型嫩度计进行测定,求其平均值。
滴水损失:将修整好的样品称重(W0),悬吊于冰箱冷藏层,保存24 h,取出肉样,用洁净滤纸轻轻拭去肉样表层汁液后称重(W1),按该公式计算滴水损失:滴水损失= [(W0-W1)/W0] ×100%。
1.3 引物设计
根据PRKAG3基因的序列(GeneBank登录号为:DQ280152),利用软件Premier 5.0设计引物,扩增片段长度为303 bp。引物由上海生工生物工程技术有限公司合成,上游引物:5'-CCCTCCTCTGTCTCCTTACA-3',下游引物:5'-AAGGGATGCGCTCCTACCGC-3'。
1.4 目的片段PCR扩增
50 μL 反应体系:基因组 DNA2.0 μL(约50 ng),上游引物(10 pmol·μL-1)1.0 μL,下游引物 (10 pmol· μL-1)1.0 μL,dNTP Mixture(2.5 mmol/L)4.0 μL,10 ×PCR Buffer5.0 μL,ExTaq DNA 聚合酶(1U·μL-1)0.5 μL,灭菌水 36.5 μL。扩增条件为:94℃预变性4 min,94℃变性30 s,63℃退火45 s,72℃延伸30 s,35个循环,72℃延伸10 min。扩增产物用1.5%琼脂糖凝胶电泳检测。
1.5 PCR产物的SSCP分析
2 μL PCR 产物与5 μL 变性 Buffer混匀,98℃变性10 min,迅速冰浴5 min,用微量注射器将变性样品点于11%PAGE中,150 V电泳14 h;取下凝胶,置于70%乙醇中,轻摇10~15 min,双蒸水洗胶3次,将凝胶置于染色液中,轻摇约30 min,去染色液,双蒸水洗胶3次,显色液显色至条带清晰出现,用双蒸水冲洗以终止反应。
1.6 数据统计分析
本研究所用芦花鸡的年龄、性别以及饲料等试验条件一致,数据采用SPSS13.0软件进行统计,差异显著用ONE-WAY ANOVA方差分析,进行Duncan's LSD检验。
2 结果
2.1 PCR扩增结果
扩增产物经1.5%的琼脂糖凝胶电泳检测,可看到一条大小为303 bp的片段,目的片段明亮、特异性好,可进行SSCP分析。

图1 PRKAG3基因PCR产物电泳图
2.2 PCR-SSCP检测结果
PCR产物经10%非变性聚丙烯酰胺凝胶电泳检测,结果出现3种基因型:TT、TG和GG(如图2)。由图2中可以推断出,该位点由1对等位基因控制(分别命名为等位基因T和G)。

图2 PRKAG3基因PCR-SSCP凝胶电泳图
2.3 测序结果
将测序结果与GeneBank上序列(登录号:DQ280152)进行同源性分析,结果发现TT型的序列与GeneBank中的序列相同,定义为野生型,GG型第2832位的T突变为G,定义为突变型。两个纯合基因型的测序结果见图3。
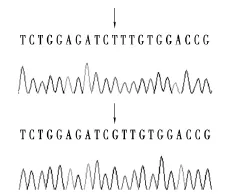
图3 TT和GG基因型的测序峰图
2.4 基因频率与基因型频率
检测结果发现,芦花鸡PRKAG3基因TG基因型的频率最高,其次是TT型和GG型(如表1)。等位基因T和G的频率分别为0.747和0.253,等位基因T在群体中占优势。适合性X2检验结果表明,芦花鸡(X2=0.1412,P>0.05)群体 PRKAG3基因第11外显子处于Hardy-Weiberg遗传平衡状态。

表1 芦花鸡PRKAG3基因的基因型和等位基因频率
2.5 PRKAG3不同基因型与芦花鸡肉质性状的相关性分析
将PRKAG3基因多态位点与芦花鸡肉质性状进行最小二乘分析,结果显示PRKAG3不同基因型对pH值有显著影响,如表2所示。pH值为GG型极显著低于TG型和TT型(P<0.01),而TG型显著低于TT型(P<0.05);其它肉质性状在不同基因型间差异不显著。

表2 芦花鸡PRKAG3基因不同基因型的肉质性状的最小二乘分析
3 讨论与结论
在生命科学的研究领域里,对动物生长发育的研究是一个永恒的课题,揭示动物生长发育规律和实现对动物生长发育的调控一直是人类美好的愿望。肉质性状一直是消费者和生产者共同关心的问题,是近年遗传育种学家研究的热点和难点。随着育种学及分子生物学的飞速发展,动物育种工作已取得了前所未有的进步。
肉质性状包括胴体组成和肌肉品质两大部分,为典型的数量性状,其遗传力大都在0.15~0.30之间,其中有关胴体组成的部分肉质性状具有较高的遗传力,有的可高达0.50左右。大量研究表明,PRKAG3基因可作为一个影响肉质性状的候选基因,存在较高的变异频率。Matthieu在总长8 048 bp的cds上共发现32个SNPs位点,平均每250 bp就存在1个SNP,有5个突变使氨基酸发生 了 改 变[6]。 李 静 等[7]对 延 边 黄 牛 的PRKAG3基因的多态性进行了分析,发现PRKAG3基因第10外显子存在C4738T突变,且不同基因型所对应的嫩度、肉色(24h红色度与黄色度)、油酸、亚麻酸、天冬氨酸、谷氨酸、精氨酸、丙氨酸、缬氨酸和脯氨酸存在一定的相关性。李武峰等[8]对7个品种牛的PRKAG3基因的多态性进行了分析,发现 PRKAG3基因第4内含子存在T2643C和T2885C两处突变,且不同基因型所对应的嫩度性状存在显著差异。在PRKAG3基因中发现的一个单碱基突变(R200Q)解释了RN-性状的显性变异,这个R200Q突变导致RN-/RN-和RN-/rn+动物的肌肉糖原含量提高了70%,猪被屠宰之后24h测定肌肉的pH值较低,肌肉系水力下降,烤制火腿的产量也降低。这个R200Q等位位点与所有RN-型动物有关,并在汉普夏品种中有很高的比例,但不存在于 rn+ 基因型或其它品种猪中[9,10]。而I199V对几乎所有研究的性状都有极显著的效应,不仅包括糖原、乳酸、糖酵解潜能这些指标,还有一些与之相关的其他肉质性状[11]。发生在猪γ3亚基V224I的变异,进一步证明了γ3亚基变异对骨骼肌糖原内含物和全部的肌肉生化内含物的作用,它与在糖原内含物以及乳酸内含物和糖酵解潜能的减少相关[12]。
近年来,经济性状功能基因的多态性研究,已成为动物遗传育种研究的热点之一。标记辅助选择(MAS)是目前研究最多的方法,它是将现代分子生物学技术与常规育种方法相结合,借助分子标记选择某一位点基因改变该位点基因频率的过程,也称分子辅助选择。当前,国内外对PRKAG3基因的研究主要集中在它与猪的肉质性状的关联分析上,而对鸡的肉质性状的研究相对较少。本研究采用PCR-SSCP检测了芦花鸡PRKAG3基因的外显子11的遗传多态性,结果显示PRKAG3不同基因型对pH值有显著影响,其它肉质性状在不同基因型间差异不显著。由此证明,PRKAG3基因有可能成为对芦花鸡肉质性状产生影响的候选基因,可作为选育芦花鸡肉质性状的分子标记,用于标记辅助选择意义重大。
[1] Cheung P C, SaltI P, Davies S P, etal.Characterization of AMP- activated protein kinase gamma-subunit isoforms and their role in AMP binding[J].J Biochem,2000,346:659-669.
[2] YU S L,J E Kim,H J Chung,et al.Molecular cloning and characterization of bovine PRKAG3 gene:structure,expression and single ntcleotide polymorphism detection [J].Anim Breed Gent,2005,122:249-301.
[3] 李梦云,陈代文,张克英.PRKAG3在猪组织器官中的表达差异及与胴体品质关系研究 [J].畜牧兽医学报,2006,37(6):566-570.
[4] Ferre P, Azzoutmarniche D, Foufelle F. AMP activated protein kinase and hepatic genes in volved in glucose metabolism [J].Biochem Soc Trans,2003,31:220-223.
[5] Winder W W,Holmes B F,Rubink D S,et al.Activation of Amp-actived protein kinase increases mitoehondrial enzymes in skeletal muscle [J].J Appl Physiol,2000,88:2219-2226.
[6] Matthieu R,Angelique N,Lionel F,et al.Transcripts and polymorphisms of the bovine PRKAG3 gene [J].Msmmalian Genome,2006,17:83-92.
[7] 李静,曹阳,张立春,等.延边黄牛PRKAG3基因第10外显子单核苷酸多态性及其与肉质性状的相关分析 [J].中国畜牧兽医,2010,37(3):123-126.
[8] 李武峰,杨润军,甘乾福,等.肉牛PRKAG3基因多态性及其与胴体和肉质性状的关联分析 [J].畜牧兽医学报,2009,40(7):1106-1111.
[9] Milan D,Jeon J T,Looft C,et al.A mutation in PRKAG3 associated with excess g!ycogen content in pig skeletal musele [J].Seience,2000,288(5469):1248-1251
[10] 徐宁迎,赵兴波,蒋思文.猪鸡肉质性状分子标记及主效基因的研究进展 [J].中国畜牧杂志,2004,40(4):42-44.
[11] Ciobanu D,Bastiaansen J,Malek M,etal.Evidence for new alleles in the protein kinase adenosine monoPHosPHate-aetivatedgamma(3)-subunit gene assoeiated with low glyeogen ceontent in Pig skeletal musele and improved meat quality [J].Geneties,2001,159(3):1151-1162.
[12] Ciobanu D, Bastiaansen J, Malek M, et al.Evidence for new alleles in the protein kinase adenosine monophosphate-activated gamma(3)-subunit gene associated with low glycogen content in pig skeletal muscle and improved meat quality [J].Genetics,2001,159:1151-1162.

