MSCs-肝细胞共培养上清对体外培养L02细胞的影响
刘 永,胡文君,蔡家利,王英杰
1.第三军医大学西南医院感染病研究所,重庆 400038;2.重庆理工大学药学与生物工程学院
目前研究表明,间充质干细胞(MSCs)可分泌多种细胞因子,能够促进肝细胞增殖及肝脏血管再生[1],因此国内不少单位已将其用于肝硬化和肝衰竭的临床治疗。实验研究同时发现,移植共培养的MSCs-肝细胞可抑制急性肝衰竭的肝细胞凋亡,降低炎症因子水平,改善肝生化指标,提示MSCs联合肝细胞移植治疗肝衰竭可能更有临床价值[2]。迄今为止,有关MSCs与肝细胞的相互作用及其共同治疗肝衰竭的具体作用机制尚不十分清楚。本研究采用共培养策略和体外研究方法,观察了MSCs-肝细胞共培养上清对L02细胞增殖和活力的影响及L02细胞损伤的保护作用,旨在为MSCs联合肝细胞治疗肝衰竭提供新的实验依据。
1 材料与方法
1.1 MSCs、肝细胞的分离与共培养 实验动物SPF级SD大鼠(4~6周龄,购于第三军医大学实验动物中心)。采用全骨髓贴壁筛选法分离MSCs,传至第3代备用。采用体外胶原酶两步灌注法分离肝细胞,用台盼蓝染色计数测活力,接种于6孔板,待肝细胞完全贴壁后换液。与此同时,胰酶消化第3代MSCs,计数并以1∶10的比例加入肝细胞培养板,共培养6 d。每日收集共培养上清,同时收集单独培养的肝细胞、MSCs上清作为对照,采用500×g离心10 min和滤膜过滤的方法除去死细胞及杂质,-20℃保存备用。
1.2 L02细胞的培养及细胞损伤模型的建立 常规方法复苏L02细胞(本实验室保存购置于上海细胞所),采用1640加10%的新生牛血清进行常规培养。胰酶消化状态良好的L02细胞,以1×104的密度接种到24孔板,将细胞培养液与酒精以1∶1的比例混合,倍比稀释加入L02细胞培养板里,次日观察细胞状态,并用MTT法检测细胞的增殖情况,以细胞半数致死量的酒精浓度作为制备细胞损伤模型的最佳浓度。
1.3 普通培养组L02细胞活力和总蛋白含量检测
1.3.1 细胞活力检测:采用MTT法检测L02细胞活力,细胞以1×104的密度接种于24孔板,分别加入单独培养的肝细胞上清、MSCs上清和MSCs-肝细胞共培养上清(对照组加入10%NCS)。培养2~3 d后吸弃上清,加入5 mg/mL的MTT液200 μL,培养6 h后吸弃上清,加入二甲亚砜10 min,取样,在 Fortune labsystems酶标仪(苏兰雷勃公司)490 nm波长测吸光度值。
1.3.2 总蛋白检测:L02细胞细胞以2×104的密度接种L02细胞于12孔板,同时加入各细胞培养上清,48 h后消化、离心,500 μL蒸馏水重悬,-70℃反复冻融3次。每次约2~3 h,第3次冻融后离心取上清,采用考马斯亮蓝法(Bradford法)检测L02细胞中蛋白质的含量。
1.4 损伤培养组细胞活力、总蛋白含量及细胞损伤的检测 细胞损伤次日换液,分别加入肝细胞上清、MSCs上清和肝细胞-MSCs共培养上清培养,48 h后同上方法检测细胞活力、总蛋白含量。同时取L02细胞培养上清、离心,紫外动力学方法在7020型日立自动分析仪上检测AST、LDH漏出量。按照细胞凋亡试剂盒(Annexin-V-FITC细胞凋亡检测试剂盒)步骤处理样品,流式细胞仪进行细胞凋亡率的检测。
2 结果
2.1 形态观察 采用改良的两步胶原酶分离肝细胞活力>90%,培养后呈典型的多边形态。采用全骨髓贴壁筛选法分离的MSCs,接种24 h换液后,可见数目较多的梭形、不规则形态细胞,传代后细胞增殖速度加快,至第3代时,细胞呈均一的梭形排列。肝细胞与MSCs以1∶10的比例共培养,可见肝细胞呈岛屿状排列分布,大部分被MSCs包围生长(见图1)。

图1 原代大鼠肝细胞、MSCs以及混合培养 A:原代24 h肝细胞(40×);B:MSCs(第3代,40×);C:第3代MSCs和肝细胞共培养1 d(100×)Fig 1 Primary hepatoctyes of SD rats,MSCs and the co-culture of hepatoctyes,MSCs A:Primary 24 h hepatoctyes(40 × );B:MSCs(P 3,40×);C:MSCs and hepatoctyes co-culture 1 d(100×)
2.2 共培养上清对普通培养L02细胞的影响 采用MSCs-肝细胞共培养上清及肝细胞上清、MSCs上清对L02细胞进行培养,MTT检测结果显示,L02细胞活力显著升高,与对照组相比有显著性差异,其中共培养上清效果最佳(P<0.05)。总蛋白合成量检测结果显示共培养上清组及肝细胞上清、MSCs上清明显高于对照组(P <0.05,见图2)。同时检测 AST、LDH 漏出量显示,MSCs-肝细胞共培养上清组及肝细胞上清组、MSCs上清组细胞AST、LDH漏出量明显低于对照组,且两两相比差异也具有统计学意义(见表1)。
2.3 细胞凋亡的检测 采用流式细胞检测细胞凋亡率,加入细胞培养上清作用后的L02细胞凋亡率显著低于对照组,尤其是共培养组上清组细胞凋亡率最低,对照组的细胞凋亡率是共培养组的近4倍(见图2)。

表1 细胞上清对损伤L02细胞AST、LDH的影响Tab 1 The effect of supernatant liquid on AST,LDH of L02
3 讨论
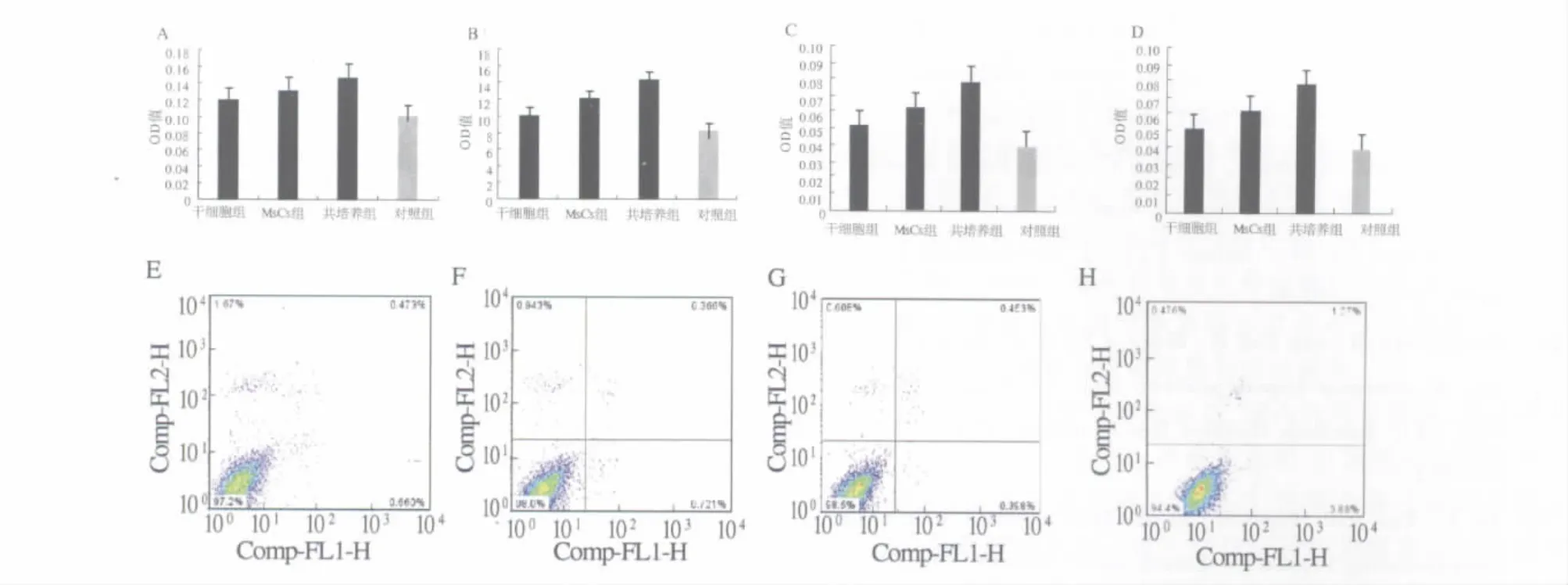
图2 细胞上清对体外培养L02生长的影响 A:普通培养L02活力;B:损伤后培养L02活力;C:普通培养L02总蛋白合成;D:损伤后培养L02总蛋白合成;E:肝细胞上清组L02细胞凋亡;F:MSCs上清组L02细胞凋亡;G:共培养组L02细胞凋亡;H:对照组L02细胞凋亡Fig2 The effect of supernatant liquid on the growth of L02 in vitro A:Cell viability of normal culture L02;B:Cell viability of damaged L02;C:Total protein synthesis of normal cultured L02;D:Total protein synthesis of damaged L02;E:The effect of hepatoctyes supernatant liquid on L02 cell apoptosis;F:The effect of MSCs supernatant liquid on L02 cell apoptosis;G:The effect of co-culture group supernatant liquid on L02 cell apoptosis;H:The control group of L02 cell apoptosis
近年来,随着干细胞研究的快速发展,越来越多的研究显示MSCs对肝脏疾病的治疗有良好的前景。其中将MSCs用于治疗肝衰竭的动物或临床研究均取得一定的疗效[3]。在 MSCs治疗肝衰竭的研究中,将MSCs与肝细胞进行体外共培养是研究的热点之一。据报道MSCs与肝细胞共培养既有利于肝细胞功能和活力的维持,也有助于MSCs向肝细胞分化。二者分别对肝硬化和肝衰竭具有多种有效的治疗作用,包括分泌细胞因子抑制肝细胞凋亡、降低炎症因子水平及对肝细胞功能的支持和改善生化指标等[2]。鉴于MSCs、肝细胞对肝衰竭的治疗作用可能源于某些细胞因子,猜测细胞培养上清可能也有一些细胞因子对肝衰竭具有治疗作用。因此,本研究就MSCs-肝细胞共培养上清在体外对L02细胞生长和功能的影响进行初步探讨,从而为肝衰竭的治疗提供新的依据。
细胞的生长活力和总蛋白合成量能直接反映细胞的生长状况,本研究也采用细胞生长活力和总蛋白合成量两项指标来评价细胞的生长状况。结果显示细胞培养上清对体外培养的L02细胞的生长都有明显的促进作用,尤其共培养组上清对L02细胞的活力影响最大。为了验证实验结果,本实验分设普通培养组和损伤培养组,结果显示MSCs-肝细胞共培养上清对于普通培养的L02细胞以及酒精损伤的L02细胞都有显著的刺激增殖作用,表现为L02增殖活跃,总蛋白合成量增加。该结果提示细胞培养上清中可能含有某种或者某一类活性物质对细胞的活力有较为明显的促进作用。推测这类活性成分可能是肝细胞、MSCs分泌的各种可溶性细胞因子或者生长因子。我们的实验还发现共培养48 h时段的上清与其他时段的共培养上清相比,对L02刺激作用更为显著,而且这种促进作用随时间变化而呈周期性变化,这种变化与肝细胞的生长曲线相一致。这也提示了共培养上清中确实有某种有效成分可以刺激L02的增殖,且这种有效成分与肝细胞可能存在某种联系。
LDH漏出量是细胞膜损伤的重要标志,而AST是肝细胞损伤灵敏的检测指标。本实验采用酒精制备细胞损伤模型,AST和LDH值显著升高。将MSCs、肝细胞及共培养上清加入L02细胞损伤组培养一段时间后,再在相同的条件下检测AST和LDH值,发现加入细胞培养上清培养之后的L02细胞与对照组相比,AST和LDH有不同程度的降低,尤其是加MSCs-肝细胞共培养上清更为显著。提示细胞培养上清能够减轻酒精对L02细胞膜的损伤,对L02细胞损伤有保护作用。为了进一步验证上述结果,我们采用流式细胞仪分析细胞凋亡情况,结果也证实了MSCs-肝细胞共培养上清可以有效地减少细胞凋亡,这与Parekkadan等的研究相一致[2,4]。
已有多项体外实验证明MSCs可以分泌多种细胞因子如白细胞介素 IL-1、IL-6、IL-8、血管内皮生长因子、转化生长因子、前列腺素E2、神经生长因子等发挥其调节免疫的作用[5-7]。肝细胞培养上清中亦含有减少肝细胞死亡,有效改善肝功能的有效成分[8]。我们的研究结果显示了MSCs-肝细胞共培养上清有促进细胞增殖、减少细胞凋亡和保护细胞损伤的作用,且这种作用要强于单独培养的肝细胞和MSCs培养上清,推测这种作用可能是多种细胞因子和生长因子协同作用的结果,但具体是哪一类细胞因子在起作用及其作用机制有待于进一步的研究。
[1]Jiang Y,Jahagirdar BN,Reinhardt RL,et al.Pluripotency of mesenchymal stem cells drived from adult marrow[J].Nature,2002,418(4):41-49.
[2]Parekkadan B,van Poll D,Suganuma K,et al.Mesenchymal stem cell-derived molecules reverse sefulminant hepatic failure[J].PLos one,2007,2(9):e941-e947.
[3]Agnieszka B,Takumi T,Yusuke Y,et al.Rapid hepatic fate specification of adipose-derived stem cells and their therapeutic potential for liver failure [J].J Gastroenterol Hepatol,2009,24(1):70-77.
[4]Parekkadan B,van Poll D,Megeed Z,et al.Immunomodulation of activated hepatic stellate cells by mesenchymal stem cells[J].Biochem Biophys Res Commun,2007,363(2):247-252.
[5]Yu Y,Yao AH ,Chen N,et al.Mesenchymal stem cells over-expressing hepatocyte growth factor improve small-for-size liver grafts regeneration[J].Mol Ther,2007,15(7):1382-1389.
[6]Zender L,Hutker S,Mundt B,et al.NF-κB-mediated upregulation of bcl-xlrestrains TRAIL-mediated apoptosis in murine viral hepatitis[J].Hepatology,2005,41(2):280-288.
[7]Kharaziha P,Hellst rim PM,Noorinayer B,et al.Improvement of liver function in liver cirrhosis patient s after autologous mesenchymal stem cell injection:a phase I-II clinical trial[J].Eur Gastroenterol Hepatol,2009,21(10):199-205.
[8]Molnar C,Garcia-Trevijano ER,Luduiczek O,et al.Antiinflammatory effects of hepatocyte growth factor:induction of interleukin-1 receptor antagnist[J].Eur Cytokine Netw,2004,15(4):303-311.

