双环醇片治疗肾移植术后药物性肝损伤的疗效观察
胡小鹏,尹 航,王 玮,杨晓勇,任 亮,刘 航,车 乐,张小东
首都医科大学附属北京朝阳医院泌尿外科,北京 100020
随着肾移植治疗在我国的逐渐普及,新型免疫抑制剂的不断研发和利用及组织配型技术的日趋完善,同种异体肾移植成功率日益提高,人/肾存活周期不断延长。然而,由于免疫抑制剂肝毒性的存在和肝炎病毒感染率的增加,肝损害已成为同种异体肾移植术后常见的内科并发症,其不仅可影响移植肾脏功能的发挥,还会威胁患者的生命安全[1]。肾移植术后肝损伤的发病率较高,发病原因主要为药物性肝损伤、病毒性肝炎和免疫性损伤等。由于肾移植术后患者需长期服用免疫抑制剂,出现排斥反应时还需加大使用剂量,所以由免疫抑制剂导致的肾移植术后药物性肝损伤已引起临床医生的广泛关注。国外文献报道,移植后肝损害的发生率大概为30%左右[2]。本研究采用随机对照的方法,应用口服保肝药物双环醇片治疗肾移植术后药物性肝损伤,疗效显著,报道如下。
1 材料与方法
1.1 病例选择 选择2007年1月-2011年8月间于我院泌尿外科行同种异体肾移植术后出现药物性肝损伤的患者80例,年龄15~61岁,中位年龄39.6岁,其中男58例,女22例。将所有入组患者随机分为两组,双环醇治疗组和硫普罗宁治疗组各40例。全部入组病例满足如下条件:①符合中华医学会消化病学分会提出的急性药物性肝损伤临床诊断标准(2007版)[3];② 总胆红素(TBIL)升高在53.1 μmol/L以下;③ 丙氨酸氨基转移酶(ALT)升高在400 U/L以下。两组患者在人口资料学、病程、用药等方面情况相似,具有可比性。
1.2 治疗方法 术后免疫抑制剂应用方案:入组患者术后应用环孢素A(CsA)/他克莫司(Tac)+霉酚酸酯(MMF)/硫唑嘌呤(Aza)+强的松(Pred)三联用药方案。其中CsA和Tac的初始剂量分别为7 mg·kg-1·d-1和 0.1 mg·kg-1·d-1,治疗过程中根据血药浓度及临床情况予以调整。
双环醇治疗组在常规护肝退黄(维生素C、熊去氧胆酸等)基础上联用双环醇片(北京协和药厂生产)75 mg/d(每次25 mg,3次/d)。硫普罗宁治疗组在常规治疗基础上联用硫普罗宁片(河南新谊药业集团公司生产),600 mg/d(每次200 mg,3次/d)。两组疗程均为4周,治疗期间部分患者视病情调整免疫抑制方案及剂量。
1.3 观察指标 ①两组患者在治疗前及治疗2周和4周后分别检测肝功能、肾功能、血糖、血脂、血常规、尿常规、心电图等指标;② 患者治疗前后症状体征的改善情况;③观察、记录用药后的不良反应。
1.4 疗效评价标准 显效:临床症状消失及肝功能恢复正常;有效:临床症状明显好转,氨基转移酶下降大于治疗前的1/2;无效:临床症状无明显好转,氨基转移酶下降小于治疗前的1/2。
1.5 统计学处理 全部数据采用SPSS 17.0软件进行统计分析,计量资料以平均值±标准差表示,治疗前后差异采用t检验进行分析,计数资料的比较采用卡方检验。P<0.05为差异有统计学意义,P<0.01为差异有显著性统计学意义。
2 结果
2.1 两组患者治疗前后肝功能指标的变化情况 治疗后,两组患者的肝功能指标均有不同程度改善,但双环醇治疗组氨基转移酶水平的改善情况明显优于硫普罗宁治疗组(P<0.01),两组对于总胆红素和碱性磷酸酶(ALP)的改善情况差异无统计学意义(见表1)。
2.2 两组综合疗效比较 治疗4周后,双环醇治疗组的总有效率明显优于硫普罗宁治疗组,差异有统计学意义(P <0.05,见表2)。
表1 两组患者治疗前后肝功能的变化情况()Tab 1 Changes of liver function before and after treatment in two groups()
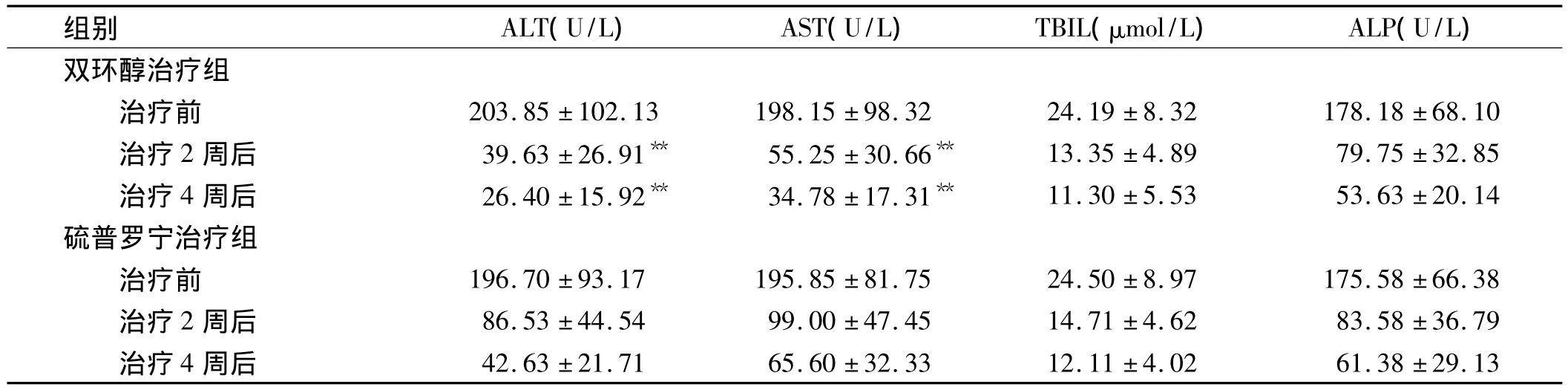
表1 两组患者治疗前后肝功能的变化情况()Tab 1 Changes of liver function before and after treatment in two groups()
与硫普罗宁治疗组相比,**P<0.01
组别 ALT(U/L) AST(U/L) TBIL(μmol/L) ALP(U/L)双环醇治疗组治疗前 203.85 ±102.13 198.15 ±98.32 24.19 ±8.32 178.18 ±68.10治疗2 周后 39.63 ±26.91** 55.25 ±30.66** 13.35 ±4.89 79.75 ±32.85治疗4 周后 26.40 ±15.92** 34.78 ±17.31** 11.30 ±5.53 53.63 ±20.14硫普罗宁治疗组治疗前 196.70 ±93.17 195.85 ±81.75 24.50 ±8.97 175.58 ±66.38治疗2 周后 86.53 ±44.54 99.00 ±47.45 14.71 ±4.62 83.58 ±36.79治疗4 周后 42.63 ±21.71 65.60 ±32.33 12.11 ±4.02 61.38 ±29.13

表2 两组患者治疗总有效率的比较(%)Tab 2 Comparison of total effective rate between two groups(%)
2.3 不良反应 所有入组患者在治疗过程中未见严重药物不良反应发生。出现皮肤瘙痒5例,未停药自行缓解,治疗前后血糖、血脂、血尿常规及心电图均无明显变化。
3 讨论
近年来,肾移植已成为肾功能衰竭的常规治疗手段,这与免疫抑制剂的临床应用是密切相关的。但是免疫抑制剂不仅抑制排斥反应,促进移植物的存活,同时也会导致受者和移植物的毒性损伤。部分免疫抑制剂在临床应用后引起的肝、肾毒性已影响到肾移植术后患者的生存质量和移植肾的长期存活。肾移植术后肝功能异常可发生在术后任何时期,但常见于移植后的半年内,一般认为药物性肝损伤多发生在术后2周左右[4]。
钙调蛋白酶免疫抑制剂CsA和FK506是目前肾移植免疫抑制联合治疗中的核心药物,但CsA及FK506均存在一定的肝毒性,尤其是CsA对肝脏毒性较大[5]。CsA可通过干扰微粒体的膜蛋白功能,影响肝细胞膜的稳定性和渗透性,同时可扰乱mRNA生产,影响DNA及核糖体合成,导致蛋白及胆汁合成、分泌功能障碍,影响肝脏解毒及各种代谢功能[6]。FK506的肝毒性虽然较低,但是高昂的治疗费用让很多肾移植患者无力承担。因此,肾移植术后出现肝功能异常时,如何调整免疫抑制剂的用法用量并控制和改善肝毒性已成为治疗的关键。
临床实践证实,对于肾移植术后出现药物性肝损伤的患者,大部分可应用常规保肝药物治疗结合调整免疫抑制剂使用方案使肝功能恢复正常。由于免疫抑制剂引起的肝损伤主要影响肝细胞膜和细胞器膜的稳定性、通透性,破坏膜的完整性,且临床发病快,需迅速缓解,因此应选用具有稳定细胞膜功能,起效快,安全性好的保肝药及时进行治疗[7]。
双环醇片(商品名百赛诺)是中国医学科学院药物研究所研制的具有国际自主知识产权的国家一类化学新药。既往研究证实,双环醇片对多种实验性肝损伤和肝纤维化均有明显的保护作用,并具有显著的抗炎活性。其作用机制与清除自由基、保护生物膜和线粒体功能、抑制氧化损伤、诱导体内抗氧化物的产生等密切相关[8]。近期研究证实双环醇片对刀豆蛋白A、顺铂、四环素、酒精等引起的肝损伤均具有保护作用[9-12]。
本组研究结果显示,双环醇片治疗肾移植术后药物性肝损伤,可显著降低氨基转移酶水平并改善患者的临床症状,总有效率达85.00%,优于硫普罗宁片,且二者的临床疗效存在统计学差异。因此我们认为,双环醇片对于肾移植术后药物性肝损伤具有良好的临床疗效。双环醇片的有效治疗,不仅有利于改善患者的生活质量,而且也有益于保证免疫抑制剂的治疗效果,值得临床推广应用。
[1]López-Larrea C,Ortega F.Advances in translational transplant immunology[J].Transplantation,2009,88(3 Suppl):S1-S7.
[2]Europen Multicentre Trial Group.Cysiosporine in cadaveric renal transplantation:on-year follow-up of a multicentre trial[J].Lancet,1983,2:986.
[3]Chinese Medical Association on Digestive Disease credits of hepatobiliary disease Coworking Group.Diagnosis and treatment recommendations of Acute drug-induced liver injury(draft)[J].Chin J Dig,2007,27(11):765-767.中华医学会消化病学分会肝胆疾病协作组.急性药物性肝损伤诊治建议(草案)[J].中华消化杂志,2007,27(11):765-767.
[4]Tong Q,YAO LX,Yang JP,et al.Clinical research on the liver damage in the patients with viral hepatitis after renal transplantation [J].Journal of Southeast China National Defence Medical Science,2008,10(2):93-96.童强,姚立欣,杨继平,等.肝炎病毒阳性患者肾移植术后肝损害的临床研究[J].东南国防医药,2008,10(2):93-96.
[5]Hamawy MM,Knechtle SJ.An overview of the action of cyclosprine and FK506 [J].Transplant Rev,2003,17(4):165-17l.
[6]Mueller EA,Viess D,Mellein B,et al.Cyclosporine microemulsion formulation:Pharmacokinetic/pharmaoodynamicrelationship [J].Transplant Proc,1998,30(7):1694-1696.
[7]Wang WS,Li X,Xing XY,et al.Therapy of Liver injury postoperative renal transplantation[J].Journal of Modern Urology,2006,11(4):233-234.王文生,李鑫,邢晓燕,等.肾移植术后肝功能损害的治疗[J].现代泌尿外科杂志,2006,11(4):233-234.
[8]Wang YM,Li Y.Research progress in mechanism of hepatoprotective and anti-inflammatory by Bicyclol[J].Chin J Gastroenterol Hepatol,2010,19(7):674-677.王宇明,李燕.双环醇保肝抗炎药理机制研究新进展[J].胃肠病学和肝病学杂志,2010,19(7):674-677.
[9]Zhao DM,Liu GT.Protective effect of bicyclol on concanavalin A-induced liver DNA injury in mice[J].Natl Med J China,2001,81(14):844-848.赵冬梅,刘耕陶.双环醇对刀豆蛋白A所致小鼠肝细胞核DNA损伤的保护作用[J].中华医学杂志,2001,81(14):844-848.
[10]Yu YN,Chen H,Li Y.Effect of Bicyclol on cisplatin-induced hepatotoxicity in the hepatocarcinoma 22 tumour-bearing mice[J].Basic Clin Pharmacol Toxicol,2009,104(4):300-305.
[11]Yu HY,Wang BL,Zhao J,et al.Protective effect of bicyclol on tetracycline-induced fatty liver in mice[J].Toxicology,2009,261(3):112-118.
[12]Zhao J,Chen H,Li Y.Protective effect of bicyclol on acute alcoholinduced liver injury in mice [J].Eur J Pharmacol,2008,586(1-3):322-331.

