薇菜红变底物的初步鉴定
田 瑞,莫开菊,程 超,向 曦,汪兴平*
(1.湖北民族学院生物科学与技术学院,湖北恩施445000;2.生物资源保护和利用重点实验室(湖北民族学院),湖北 恩施445000)
薇菜(Osmunda)属紫萁科(Osmundaceae)紫萁属(Osmunda)多年生蕨类植物[1],学名紫萁(Osmunda japonica Thunb),俗称猫儿蕨、狼蕨、蓝茎苔,其嫩茎有红色和绿色两种.以嫩茎制成干菜即为薇菜干.在国际市场上,以“中国红薇干(赤干)”品质最佳,是我国目前出口创汇的重要蔬菜之一,为国际市场高档紧俏无公害产品.王谋强等[2]从传统的加工方式出发指出高品质薇菜干的加工技术要点,即控采集、速烫漂、转红足、巧揉搓、干燥短,为了获得高质量的红薇干,加工中采用黄金分割法得到了薇菜加工的最佳烫漂水温和时间,即93.18℃烫漂3.236 min,且特别指出干燥过程中,涉及的技术环节为转红、揉搓、及干燥方式,对于如促使薇菜转红未作说明.孙红绪等[3]主要研究了薇菜机械化加工的工艺参数,对于薇菜红变机理的研究还未见报道.因此本文针对薇菜红变问题进行研究,主要报道可能引起薇菜红变的底物.
1 材料与方法
1.1 材料与试剂
薇菜:湖北长友现代农业股份有限公司提供.
薇菜干的制作工艺:鲜薇菜→烫漂→转红→揉搓→干燥→薇菜干
盐酸、氢氧化钠、乙醇、正丁醇、硫酸铁氨、硫酸、三氯化铁、茴香醛、丙酮、三氯甲烷、甲醇、醋酸(以上药品均为分析纯).硅胶GF254薄层板自制.
1.2 仪器与设备
TU-1810紫外分光光度计(普析通用仪器有限责任公司);离心机(上海安亭科学仪器厂);水浴锅(上海一恒科学仪器有限公司);鼓风干燥箱(上海博讯实业有限公司医疗设备厂).
1.3 方法
1.3.1 不同pH值条件下薇菜浸提液颜色反应及可见光谱特性 将抢烫后的薇菜精确称取2.0 g,以1∶5的料液比加入用盐酸和氢氧化钠调配的不同pH值的溶液研磨,4800 r/min离心,取上清液,观察不同pH值下溶液的颜色,并取上清液在400~700 nm下扫描.
1.3.2 花色素反应 制备丙酮浸提液,方法同于1.3.1.根据Porter[4]提出的改进的花色素反应的方法,以铁离子为催化剂.反应的条件是:①1.0mL提取液;②6mL正丁醇-浓盐酸(95:5,体积比);③0.2 mL2%铁离子试剂[NH4Fe(SO)4·12H2O];④在(95±0.2)℃反应40min.不同原花色素的花色素反应产生的花色素存在差异,通过测定反应溶液的紫外吸收光谱,有利于得到更多的信息,可用来初步判断原花色素的存在及类型[5].
1.3.3 薇菜丙酮浸提液的特殊显色反应 精确称取2.0 g薇菜,以1∶9的料液比加入80%的丙酮浸提液研磨,避光超声浸提60 min,离心,取上清液定容于25 mL容量瓶,备用.取1.0 mL上述提取液于试管共6管分成两组,其中一组逐滴加入2%的三氯化铁溶液,观察现象;另外一组逐滴加入浓硫酸,观察现象.
1.3.4 TCL显色反应 制备丙酮浸提液,方法同于1.3.2.以丙酮浸提液为样品,点样后以三氯甲烷 ∶甲醇∶醋酸(17∶12∶1)将样品在硅胶GF254薄层板上展开后,先用三氯化铁显色,然后用茴香醛-硫酸显色,从颜色变化判断化合物的类型[6].
2 结果与分析
2.1 不同pH条件下薇菜浸提液的颜色变化及紫外可见光波谱图
由于薇菜干以红色最佳,而在自然界中呈现红色的物质主要是花青素,所以本文首先研究薇菜色素是否具有花青素性质.在不同的pH条件下花青素的结构会发生变化,颜色也发生变化[7].结果如表1所示,从颜色的变化可知,不同的pH条件同样影响薇菜色素提取液颜色的变化,颜色变化的趋势符合花青素在不同pH值下的颜色变化情况[8].
研究表明花青素在可见光区域的最大吸收波长为465 ~560nm[9-10],花青素在溶液介质中会随着pH的变化而存在红移和蓝移[11-12].
薇菜色素提取液在这个波长范围内存在最大吸收峰,从图1及表2可知,随着pH值增大,薇菜色素提取液存在明显的红移现象,当7<pH<12时,最大吸收波长为571nm.这与吴春等人的研究相符合,由此可见薇菜色素提取液符合花青素的光谱学特性.值得注意的现象是在表2和图1中显示,随着酸性增加,其最大吸光度值增大,说明存在原花色素在酸性条件下水解为花色素的可能.
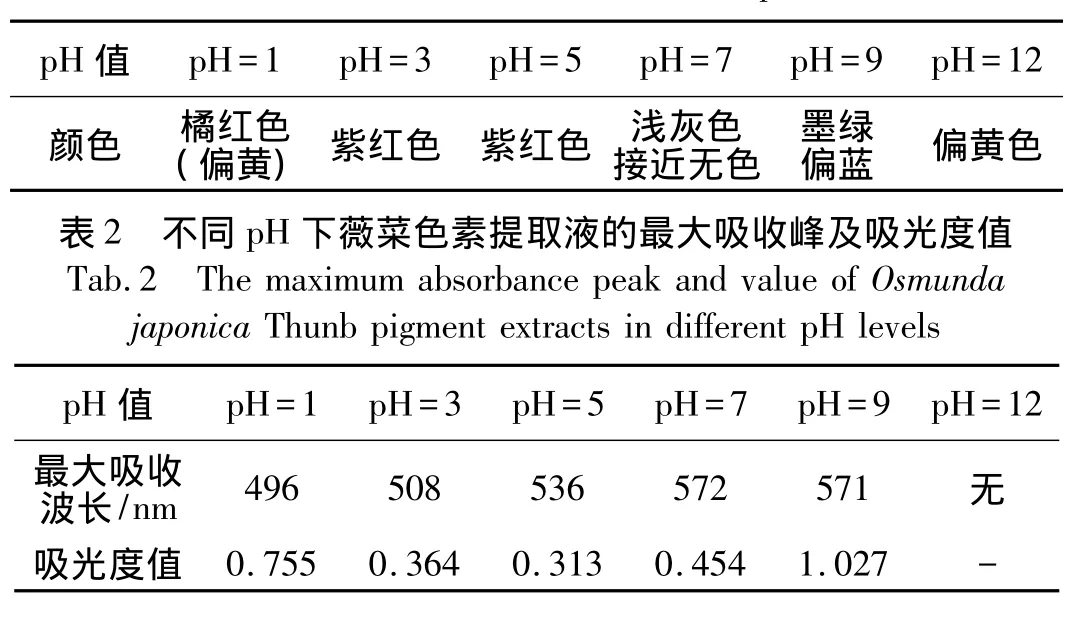
表1 不同pH值下薇菜色素提取液的颜色Tab.1 The color of Osmunda japonica Thunb pigment extract in buffer solution with different pH levels
2.2 原花色素的特征反应
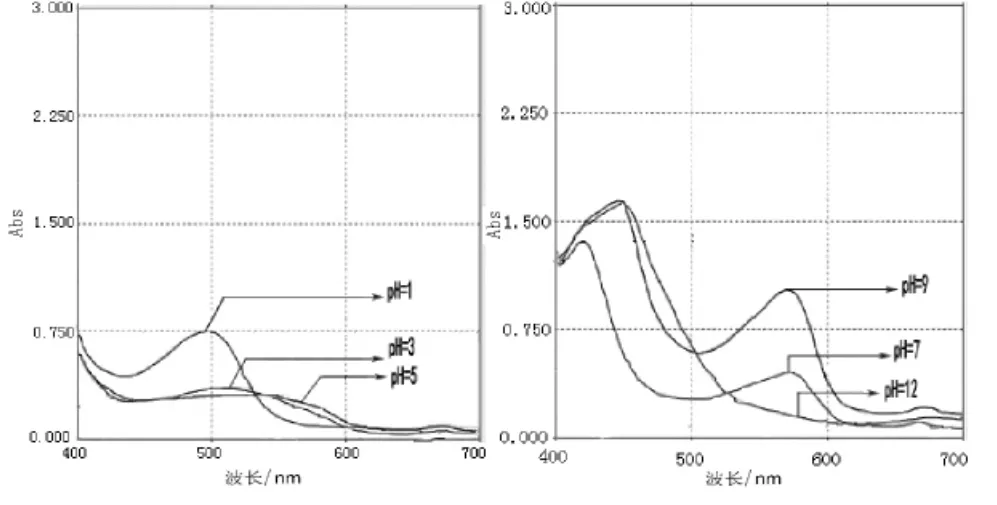
图1 不同pH条件下薇菜色素浸提液的波谱特性Fig.1 Spectrum curves of Osmunda japonica Thunb pigment extracts in different pH levels

图2 烫漂后薇菜浸提液和花色素反应产物的紫外可见光吸收图谱Fig.2 The UV-Vis spectrum of blanching Osmunda japonica Thunb extracts and anthocyanidin reaction products
淡黄色偏绿的丙酮提取液经过花色素反应后变成红色溶液,这是典型的原花色素反应.紫外可见光谱扫描结果如图1、2所示,花色素反应前丙酮提取液在500~530 nm间无明显吸收峰,花色素反应后无论是烫漂后的薇菜提取液还是干薇菜浸提液在545 nm附近都有明显的特征吸收峰,前者在最大吸收波长处的A值是0.6752,后者的A值为1.990 5,最大吸收峰出现的范围是典型的花青素的最大吸收波长500~550 nm[13-14].由此可以推测两种提取液中都含原花色素.
2.3 薇菜丙酮色素浸提液的特殊显色反应
由于原花色素属于缩合单宁,通过简单的显色反应可以初步判定单宁的类别.因此本文选取了下列显色反应.
2.3.1 三氯化铁反应 烫漂薇菜浸提液与三价铁离子反应生成绿色,干薇菜浸提液的颜色反应和前者略有不同,呈现蓝绿色接近墨绿色,由此推断,薇菜提取液中含有大量的缩合单宁.
2.3.2 与浓硫酸的反应 随着浓硫酸的加入,提取液生红色,依据资料,遇浓硫酸变红的物质同样为缩合单宁[10].
2.3.3 单宁的定性检测 将薇菜丙酮浸提液在硅胶板上点样展开,经三氯化铁显色,呈现蓝色,然后经茴香醛-硫酸显色呈现较淡的橙色,根据单宁的定性鉴定理论来判断,薇菜干样品中可能含有较多的缩合单宁且以原翠雀定为主.比较薇菜干和烫漂后的薇菜样品提取液的颜色发现:经三氯化铁显色后,前者呈现出明显的蓝色,后者颜色较浅.经茴香醛-硫酸显色后,同样是前者呈较淡的橙色,而后者橙色不明显.两者显色程度的差异,可能与样品提取时所用原料量一样,但是样品的含水量不一样,提取液中目标成分含量不一样所致.
根据以上颜色变化,可以初步判定薇菜丙酮浸提液中含有原翠雀定或者原花青定,但不能确定究竟是哪种成分,还是兼而有之.因为二者的显色区别主要是在三氯化铁显色后,呈现蓝色者为原翠雀定,呈现绿色者为原花青定.因为仅用肉眼难以准确区分蓝色和绿色.
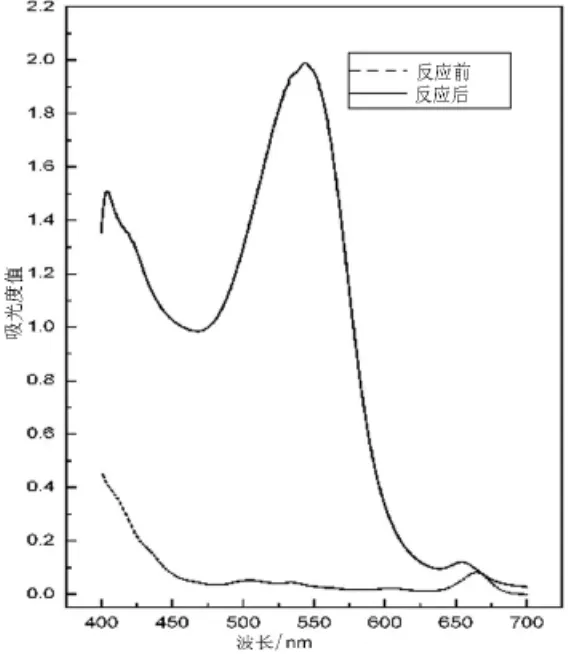
图3 薇菜干浸提液和花色素反应产物的紫外可见光吸收图谱Fig.3 The UV-Vis spectrum of dry Osmunda japonica Thunb extracts and anthocyanidin reaction products
3 结论与讨论
本文通过对薇菜色素提取液进行初步鉴定,得出以下结论:①薇菜中含有花色素和原花色素.根据色素提取液具有以下特性:在酸性条件下显红色,中性时接近无色,碱性条件下显蓝色;在500~550 nm区域具有最大吸收峰,其特性和花青素的性质一致,而且随着酸性增强,色素溶液的吸光度值增加,初步说明有花色素和原花色素存在.再经过原花色素的特征反应,进一步确证薇菜中含有花色素和原花色素;②还无法确定薇菜中的原花色素是原翠雀定,还是原花青定,或者是两种都有.根据TLC的显色反应的结果可以进一步验证薇菜中含有原花色素,但由于颜色近似,无法肉眼准确判定其类型.
综上所述薇菜红色的来源可能是原花色素和花青素共同作用的结果,要准确判定薇菜中原花色素的具体类型及结构还有待于进一步研究.
[1] 中国科学院植物研究所.中国高等植物图鉴[M].北京:科学出版社,1994:901.
[2] 王谋强,励启腾.薇菜干的营养品质分析[J].植物资源与环境学报,1995(2):63-64.
[3] 孙红绪,张曙光,张敏,等.薇菜机械化干制技术研究[J].湖北农业科学,2012,51(3):594-597.
[4] 孙旺达.植物单宁化学[M].北京:中国林业出版社,1992:213.
[5] 石碧,狄莹.植物多酚[M].北京:科学出版社,2000:39.
[6] 谭仁祥.植物成分分析[M].北京:科学出版社,2005:523.
[7] 张琳琳.黑加仑色素分离、结构初步鉴定及稳定性分析[D].长春:东北农业大学,2008.
[8] 冯建光,谷文英,葡萄皮红色素的示差检测[J].食品工业科技,2002,23(9):85-86.
[9] 詹太华.紫脚板薯色素的提取理化性质及体外抗氧化活性的研究[D].南昌:南昌大学,2008.
[10] 孙旺达.植物单宁化学[M].北京:中国林业出版社,1992.
[11] 石红旗.盐生植物翅碱蓬花青素类物质研究[J].中国海洋药物杂志,2005,24(6):32-36.
[12] Giusti M M,Rodriguez-Saona L E.Molar absorptivity and color characteristies of acylated and non-acylated pelargonidin-based anthocyanins[J].J Agric Food Chem,1999,47:4631-4737.
[13] 汪苗苗.示差法测定红花炸酱草花瓣花青素[J].科技传播,2012(2):90-91.
[14] Proual H.Progues a anthocyanes maladies vassculaires[J].Plant Med Phytother,1997,11(9):143.
——“单宁”

