苦荞麦总黄酮含量测定方法研究
施明毅,李建利,2,张继斌,毛琼丽
苦荞麦Fagopyrum tataricum(L.)Gaertn为蓼科荞麦属植物,作为一种重要的小宗杂粮作物和药食同源植物,在我国东北、西北、西南地区均有分布;其根及根茎为中药苦荞头的来源,收录于《中华本草》[1]。现代研究表明[2~6],苦荞麦中主要有效成分为黄酮类化合物,其籽粒、根、茎、叶及花中均含有较多主要粮食作物所缺乏或不具有的黄酮等药用成分,具有降血糖、降血脂,抗氧化和清除自由基等多种生理活性,对糖尿病、高血压、高血脂、冠心病、中风等有一定的预防和辅助治疗效果。劲牌有限公司技术中心旨在苦荞酒降血糖、降血脂、降血压方面的保健功能开发,因此,探索苦荞麦提取工艺条件并制定准确的含量测定方法是很有必要的。本研究采用紫外-可见分光光度法,建立总黄酮含量测定方法,为苦荞酒的开发提供参考依据。
1 仪器与材料
TU-1901型紫外-可见分光光度计(北京普析通用仪器有限责任公司);DJ600-2型电子天平(成都倍塞克仪器表研究所);DZKW-4电子恒温水浴锅(北京中兴伟业仪器有限公司);KQ5200型数控超声波清洗器(昆山市超声仪器有限公司)。
芦丁对照品(中国药品生物制品检定所,批号为100080-200707);苦荞麦(劲牌有限公司技术中心提供,经考证为蓼科植物苦荞麦 Fagopyrum tataricum(L.)Gaertn的果实部分);其他试剂均为分析纯。
2 方法与结果
2.1 正交试验法优选苦荞麦提取工艺条件
根据有关文献[2,6~8]及预实验,以苦荞麦总黄酮提取率为评价指标,选取溶媒用量、溶媒种类、提取次数和提取时间等主要影响因素为考察因素,进行L9(34)正交试验优化提取工艺。因素、水平及试验结果见表1~表3。

表1 总黄酮提取工艺因素水平表

表2 总黄酮提取的L9(34)正交试验结果
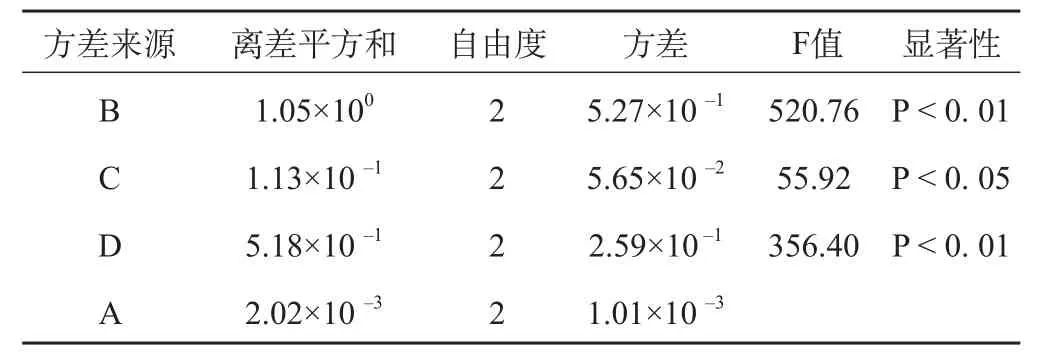
表3 总黄酮提取方差分析表
结果表明,影响总黄酮提取率的各因素作用的大小是B>D>C>A,且B和D因素有极显著性差异,C因素有显著性差异,A因素没有显著性差异,且水平A1和A2差异不大。综合考虑提高总黄酮提取率和降低工业生产成本的要求,确定最佳提取工艺条件为A1B3C2D3,即100倍量甲醇,提取2次,每次2 h。3批验证试验结果表明,该工艺稳定可行。
2.2 苦荞麦总黄酮含量测定方法研究
2.2.1 对照品溶液的制备 取芦丁对照品适量(4.99 mg),精密称定,置于50 mL容量瓶中,加适量30%乙醇超声使其溶解,放冷后用30%乙醇定容至刻度,摇匀,即得0.0998 mg﹒mL-1的对照品溶液。
2.2.2 供试品溶液的制备 精密称取本品粗粉0.5 g,置于烧瓶中,按正交试验优选所得工艺条件进行制备,即加甲醇50 mL,加热回流提取2次,每次2 h,过滤,合并滤液,用甲醇定容至100 mL,摇匀,即得。
2.2.3 测定波长的选择 将芦丁对照品溶液在200 nm~800 nm波长进行扫描,结果显示在510 nm处有最大吸收,故选择该波长作为测定波长。
2.2.4 测定方法 取1 mL供试品溶液置于10 mL容量瓶中,加入0.3 mL 5% NaNO2溶液,摇匀,放置6 min后加入0.3 mL l0% Al(NO3)3溶液,摇匀,放置6 min后加入2 mL 1 mol﹒L-1NaOH溶液,摇匀,放置15 min后用30%乙醇定容,摇匀。用紫外-可见分光光度计在510 nm处分别测定吸光度,试剂为空白。
2.2.5 标准曲线的绘制 精确吸取0.5,1,2,3,4,5 mL的芦丁标准品溶液分别置于10 mL容量瓶中,照“2.2.4”项下方法测定吸光度A。以浓度c为横坐标,吸光度A为纵坐标,得回归方程为:A=0.01154c-0.00431,r=0.9998。结果表明,芦丁对照品在0.0499 mg~0.4990 mg范围内线性关系良好。
2.2.6 精密度试验 取对照品溶液2 mL,照“2.2.4”项下方法测定吸光度A,并连续测定5次。结果吸光度平均值为0.2349,RSD为0.14%,见表4。结果表明,该方法精密度良好。

表4 精密度试验结果(n=5)
2.2.7 稳定性试验 取同一对照品溶液(0.0998 mg﹒mL-1)2 mL和苦荞麦供试品溶液1 mL,分别置于10 mL容量瓶中,照“2.2.4”项下方法测定吸光度A,于0、15、30、45、60、90 min后各测1次。结果RSD分别为0.35% 和0.91%,见表5。结果表明,对照品和供试品在90 min内基本稳定。

表5 稳定性试验结果
2.2.8 重复性试验 取苦荞麦粗粉0.5g,共5份,分别按“2.2.2”项下制备,并照“2.2.4”项下方法测定吸收度A,并计算含量。结果平均含量为4.03%,RSD为0.98%,见表6。结果表明,采用该方法提取与检测,重复性良好。
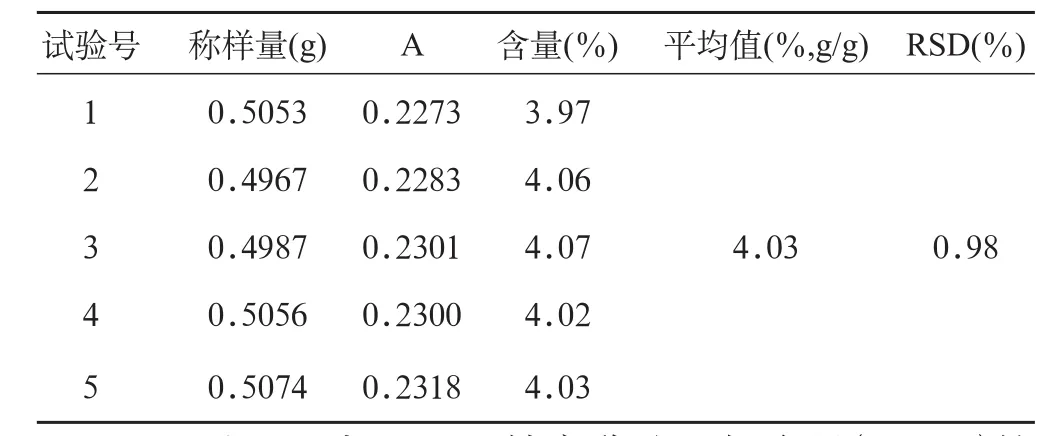
表6 重复性实验结果(n=5)
2.2.9 加样回收率试验 精密称取已知含量(4.03%)的苦荞麦粗粉0.1 g,共5份,各加入46 mL甲醇,再准确加入4 mL的芦丁标准品溶液(浓度为0.9196 mg﹒mL-1)加热回流提取,其作法同“2.2.2”项下,照“2.2.4”项下方法测定吸收度A,并计算含量。结果平均回收率为100.98%,RSD为2.15%,见表7。结果表明,供试品溶液的制备及测定方法合理可行。
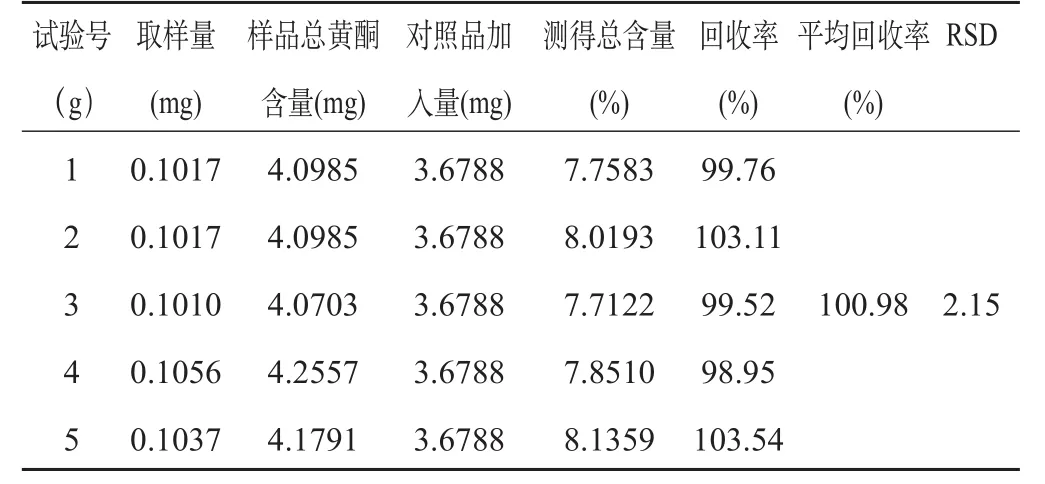
表7 加样回收率试验结果(n=5)
3 小结与讨论
3.1 苦荞麦是我国一种传统的农作物,其种植历史悠久,具有一定的药用和保健作用,是我国药食同源文化的典型体现,亦是国际粮农组织公认的优秀粮药兼用之良种。近年来,苦荞麦作为保健食品原料进行开发,已开发出苦荞麦挂面、苦荞麦快餐粥、苦荞维夫饼干、苦荞麦麦片、苦荞麦冲剂、苦荞茶等多种产品。目前市场上以苦荞作为原料开发的白酒亦不在少数,具有良好的接受基础和市场基础。苦荞的相关产品开发与运用,前景看好。
3.2 实验结果发现,按优选工艺条件提取的苦荞麦总黄酮含量高达4.03%,高于文献报道的1.97%~3.03%[6]。紫外-可见分光光度法具操作简单、准确度高、重现性好等优点。本研究优选所得提取工艺条件稳定可行;建立的含量测定方法稳定性好,合理、可行,可为苦荞酒的开发提供参考依据。
[1] 国家中医药管理局《中华本草》编委会.中华本草[M].上海:上海科学技术出版社,1999,1279.
[2] 孙博航,吴雅清,高慧媛,等.苦荞麦的化学成分[J].沈阳药科大学学报,2008,25(9):541.
[3] 李玉田,徐峰,闰泉香.苦荞麦黄酮对家犬肾缺血的影响[J].中药材,2006,29(2):169.
[4] 张政,王转花,刘凤艳,等.苦荞蛋白复合物的营养成分及其抗衰老作用的研究[J].营养学报,1999,21(2):159.
[5] 王敏,魏益民,高锦明.苦荞麦总黄酮对高脂血大鼠血脂和抗氧化作用的影响[J].营养学报,2006,28(6):502.
[6] 刘三才,李为喜,刘方.等.苦荞麦种质资源总黄酮和蛋白质含量的测定与评价[J].植物遗传资源学报,2007,8(3):317.
[7] 张琪,刘慧灵,朱瑞,等.苦荞麦中总黄酮和芦丁的含量测定方法的研究[J].食品科学,2003,24(7):113.
[8] 兰蓉,杨国伟,马越.吸附法纯化苦荞麦总黄酮的工艺研究[J].天然产物研究与开发,2006,l8:125.

