电解锰废水处理及锰回收研究
董 俊,刘鲁建,王 琦,彭峰莉,王 芳
(1.武汉长江工商学院科亮生物研究院,湖北武汉 430065;2.湖北科亮生物工程有限公司,湖北武汉 430065)
0 前言
电解锰生产中产生的废水成分较复杂,污染负荷重,含有锰、氨氮、六价铬、总铬、悬浮物等多种污染物,这些物质既是一种污染物,也是一种资源。尤其是其中会产生大量的Mn2+,废水中Mn2+的浓度远远超过国家排放标准,需处理后才能达标排放。锰是动植物必需的营养元素,但过量的锰亦会对环境造成不良影响。低浓度的锰会影响水的色、臭、味性状;目前对于该废水的处理方法主要是石灰乳絮凝沉淀法,该法处理成本高,出水水质不稳定,并且在处理过程中会产生大量的含锰废渣,既容易形成二次污染,又浪费了资源。离子交换法已经广泛应用于含铬废水、含汞废水、电镀废水等重金属废水的处理,不但处理效果好并且能够回收废水中的重金属,而用于电解锰废水方面研究还未见详细报道。
本研究采用离子交换法处理含Mn2+废水,当进水Mn2+浓度为410 mg/L时,处理后出水中Mn2+浓度远低于国家排放标准可回用,吸附饱和的树脂用Na2SO4再生,再生废液可以回收利用,再生后的树脂能够重复使用。试验考察了主要因素对锰的吸附和树脂再生效果,为离子交换技术应用于电解锰的废水处理与工艺参数控制提供依据。
1 试验部分
1.1 试验水质
试验原水取自西部某电解锰厂车间,废水水样清澈色度小,悬浮物较少。废水水质见表1。

表1 电解锰废水水质指标
1.2 试验装置与测定方法
试验装置:强酸性阳离子交换树脂、离子交换柱、磁力搅拌器、分析天平、紫外—可见分光光度计等。本次采用高碘酸钾分光光度法(GB 11906-89)测定锰,纳氏试剂分光光度法(HJ 535-2009)测定氨氮。
1.3 试验主要原理
离子交换的实质是离子交换剂上的可交换离子与溶液中的其他同性离子的交换反应,一般是可逆的。离子交换树脂吸附和再生Mn2+、NH+4的过程如下:

式中:R——树脂母体。
再生是交换反应的逆过程,借助较高浓度的再生液流过树脂层,把已吸附的离子置换出来,使树脂恢复交换能力。
1.4 试验方法
①加碱沉淀法,加入NaOH溶液使水样中Mn2+沉淀形成Mn(OH)2,静置澄清后取上层清液测定锰浓度,计算去除效率。②碳酸锰沉淀法,加入碳酸钠使水样中Mn2+形成MnCO3沉淀,静置澄清后取上层清液测定锰浓度,计算去除效率。③离子交换法:加入离子交换树脂,搅拌一段时间后使Mn2+与离子交换树脂中Na+离子交换而吸附在树脂中,取上层清液测定锰和氨浓度,计算去除效率。再生时,取再生液测锰离子浓度,计算解脱率。试验考察了不同温度、pH值、时间等因素对吸附的影响,再生浓度、体积、时间对解脱率的影响。
2 结果与讨论
2.1 不同回收方法的比较
2.1.1 加碱沉淀法
根据水样的pH值和氨的浓度,通过理论计算50 mL水样当加入1 mol/L的NaOH溶液1.6 mL时,pH值为10,试验取1.00、1.20、1.40、1.60、1.80、2.00、2.20、2.30、2.40 mL 不同梯度的体积,根据上清液锰的浓度,可理论推导出pH值。图1为加碱量对锰的去除效果及理论计算加碱后上清液的pH值。
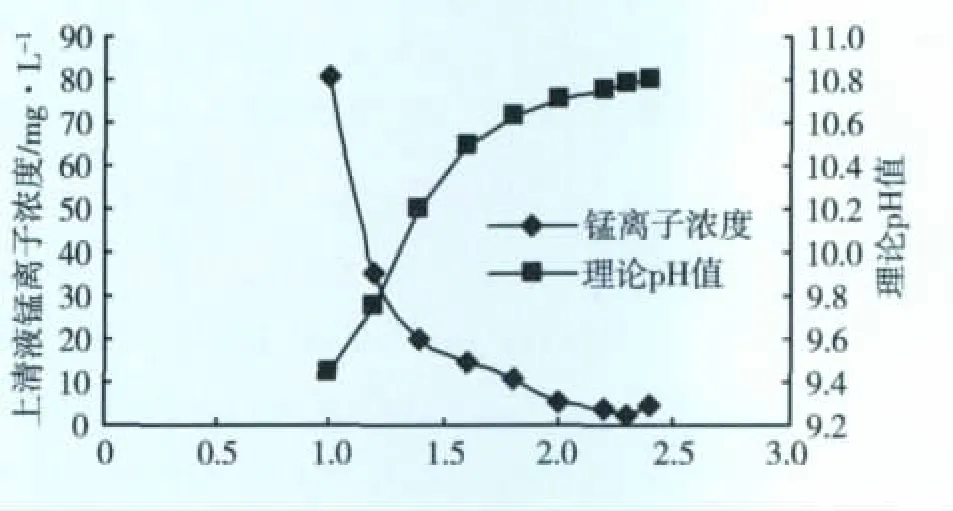
图1 加碱量对锰的去除效果
根据公式:lg[Mn2+]=lg Ksp+2 ×14-2pH,锰的溶度积Ksp=1.1×10-13,Mn2+浓度随水中pH值的改变,在大于8.3的时候开始有Mn(OH)2沉淀,沉淀基本完成在pH值11左右,可理论计算在pH值为10的时候废水中锰会降低到2 mg/L以下。由图1所示Mn2+最低值为2.5 mg/L,说明50 mL水样投加碱1 mol/L的NaOH 2.3 mL即1.84 g/L水样,pH值为10.8左右,可使废水处理后浓度接近排放标准限值。
试验还观察到:搅拌后废水先出现白色沉淀,过一段时间白色沉淀变成红色,说明生产Mn(OH)2的被水中的溶解氧氧化成为红色的MnO(OH)2,价态升为4价不利于后续锰的电解回收。
2.1.2 加碳酸钠沉淀法
试验取50 mL水样,加入1 mol/L的Na2CO3溶液,1.00、1.20、1.40、1.60、1.80、2.00、2.20、2.30、2.40 mL不同梯度的体积。搅拌,沉淀后测上清液锰离子浓度。图2中为未加碱消除铵根氨子干扰,而直接加入碳酸钠的上清液锰离子浓度。图3为加入0.5 mL的1 mol/L NaOH溶液调整至碱性条件下的上清液锰离子浓度。

图2 直接加入碳酸钠后的锰离子浓度变化
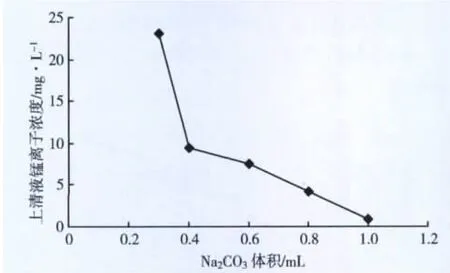
图3 调节pH值后的锰离子浓度变化
由图2可知,仅加碳酸钠时清液浓度在94.4 mg/L,去除效果很差。图3结果表明,相同碳酸钠投加量补加碱液后,清液中Mn2+浓度可降至0.8 mg/L,说明溶液中 NH+4对废水有缓冲性,减少了浓度,增加了HCO3-浓度,从而减少了向碳酸锰沉淀进行的量。
考虑碳酸锰的溶度积Ksp=1.8×10-11,可根据锰达标浓度,反推达标后浓度,再根据不同pH值条件下碳酸的水解常数及比例,推出需要投加的量约为0.6 mL,废水样若要达到排放标准,投入的量1 mL左右,也就是每升水样中2.12 g NaCO3和0.4 g NaOH。
2.1.3 离子交换法
试验取200 mL浓度为150 mg/L锰的模拟水样,加入2.5 g湿树脂,使用磁力搅拌器搅拌,不同时间内取样测水中锰离子的浓度。图4中为锰离子浓度随时间变化的情况。
由图4可知,处理的模拟废水中锰离子总量比50 mL锰离子总量要高,加入2.5 g树脂后,树脂对锰的吸附呈现幂函数关系,且在40 min时就能达到排放标准,50 min后锰的浓度降至1.1 mg/L。试验结果显示了很好的处理效果,树脂对锰的吸附能力较强,可以将废水处理到排放标准。同时进行动态交换吸附试验,自制小型离子交换器装填100 g离子交换树脂,处理5 L废水,废水处理后出水未检出锰离子,显示出了离子交换树脂的吸附能力。

图4 离子交换吸附后锰离子浓度变化
2.1.4 饱和吸附量的测定
取湿树脂10 g(湿视密度1.25 kg/m3,湿真密度0.82 kg/m3),含水率49%,加入500 mL,Mn2+浓度为5 000 mg/L的溶液中,磁力搅拌器搅拌12 h,取样后测定锰离子浓度。结果见表1。
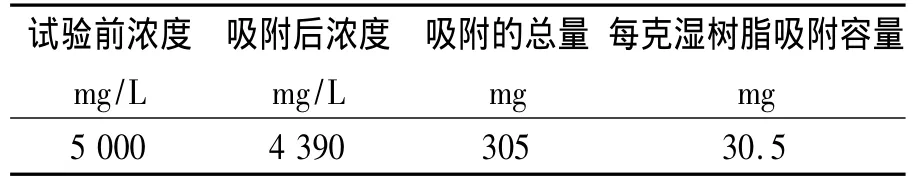
表2 饱和吸附量试验结果
由试验结果表明,树脂对锰的吸附能力的饱和量为每克树脂0.03 g锰,小试结果处理1 L废水最少树脂量为13 g/L。
通过这三种方法的比较,基本上都能做到达标排放,加碱和加碳酸钠沉淀法加药量需要过量,同时沉淀物比较细小,不容易澄清,废水中氨氮溶液超标,且pH值也会大于9。而离子交换法则显示出了很好的处理效果,工艺简单,没有了沉淀分离过程,处理起来灵活性好,且占地面积小,是最有优势的方法。
2.2 时间对离子交换饱和吸附量的影响
取100 mL浓度2 050 mg/L的模拟水样,加入5 g树脂,磁力搅拌,转速150 r/min,0~90 min内每隔15 min时间测定吸附后水样的浓度,确定吸附量的变化。结果见图5。
由图5可见,15 min时25 mg锰/L,吸附容量就接近83%。30 min后趋于稳定,根据图4和图5的试验结果,30~60 min范围内吸附可以达到平衡,浓度高时,相应平衡时间会缩短。
2.3 温度对离子交换的影响
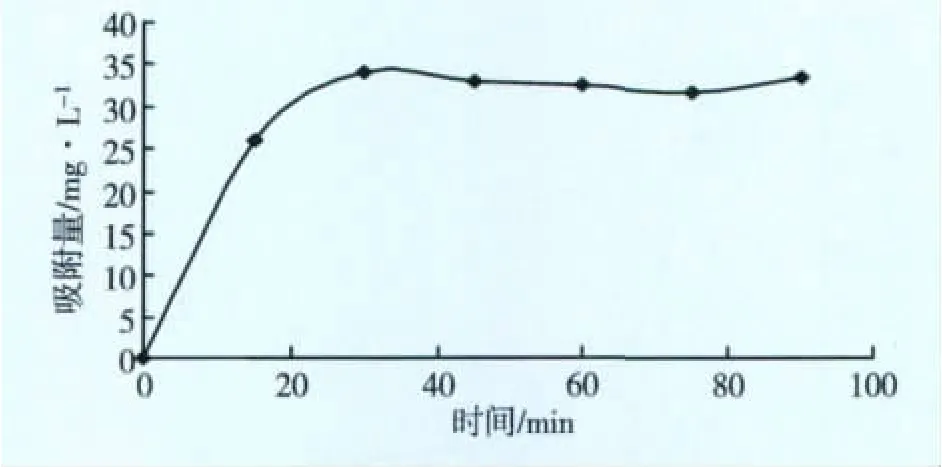
图5 吸附时间与树脂饱和吸附量的关系图
取100 mL浓度2 050 mg/L的模拟水样,加入5 g树脂,磁力搅拌,转速150 r/min,采用水浴加热,控制水温从10℃到50℃,温度稳定后20 min取0.1 mL水样测定水中锰离子的浓度变化,计算吸附量的变化趋势。

图6 不同温度下的饱和吸附量
从图6可以看出,离子交换树脂对锰的饱和吸附量,温度低时吸附量稍高,25℃下最小;继续升温后,吸附量稍升,总体变化范围不是很大,在每克树脂32~34.5 mg锰之间,说明离子交换树脂有很强的温度适宜性。
2.4 pH值对离子交换的影响
采用NaOH和盐酸溶液调整100 mL水样至不同pH值,测定吸附量的变化。不同pH值下的饱和吸附量见图7。

图7 不同pH值下的饱和吸附量
pH值的升高不利于离子交换树脂的吸附,尤其是碱性条件下,树脂的吸附容量容易减少。说明在正常的废水pH值为6时比较合适的,废水处理不需调节pH值。
2.5 再生试验
试验研究了不同的再生剂、浓度、体积对再生效果的影响。试验在室温的条件下进行,用磁力搅拌器搅拌混匀。
2.5.1 NaCl再生试验
树脂的预处理:5 g树脂经过2 g/L锰溶液60 min吸附饱和后,进行再生试验,树脂用纯水冲洗干净,吸干水分。再进行浓度、再生液体积、再生时间的单因素试验。不同浓度试验:10 mL不同质量分数的NaCl溶液,再生40 min,分析并计算锰解吸率。不同体积试验:8%不同体积的NaCl溶液,再生40 min,分析并计算锰解吸率。不同时间试验:12%,15 mL的NaCl溶液,不同时间取样,分析并计算锰解吸率。

图8 不同质量分数NaCl对锰解吸率的影响

图9 不同体积NaCl对锰解吸率的影响
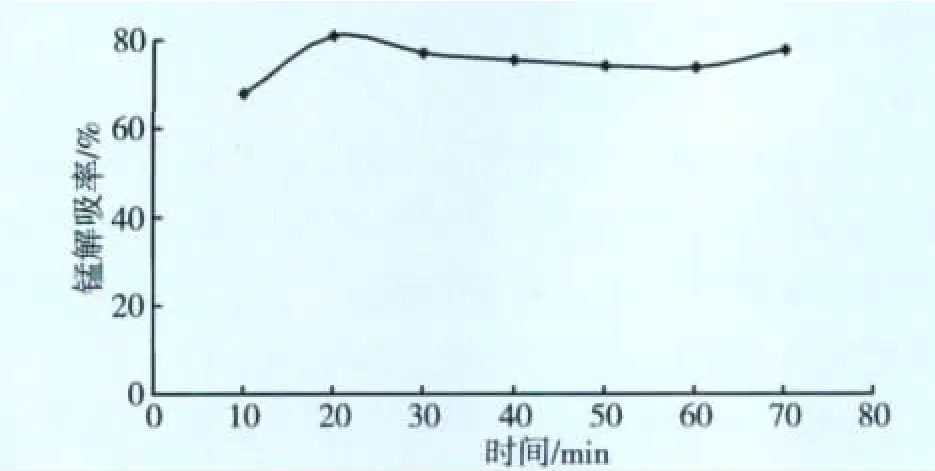
图10 不同时间(NaCl12%)对锰解吸率的影响
由图8~10可知,NaCl的浓度对锰的解吸率影响最大,并随着浓度增大而提高;体积增大,Na+增多、Mn2+减少,之间会形成一个浓度平衡。Na+浓度高而竞争取代了Mn2+的位置,而使Mn2+解吸出来。
2.5.2 硫酸钠解吸试验
不同浓度试验:同氯化钠再生剂。不同体积试验:同氯化钠再生剂。不同时间试验:将预处理后的树脂加入12%、15mL的Na2SO4溶液,不同时间取样,测量再生后的水样中锰的浓度,计算解吸率。
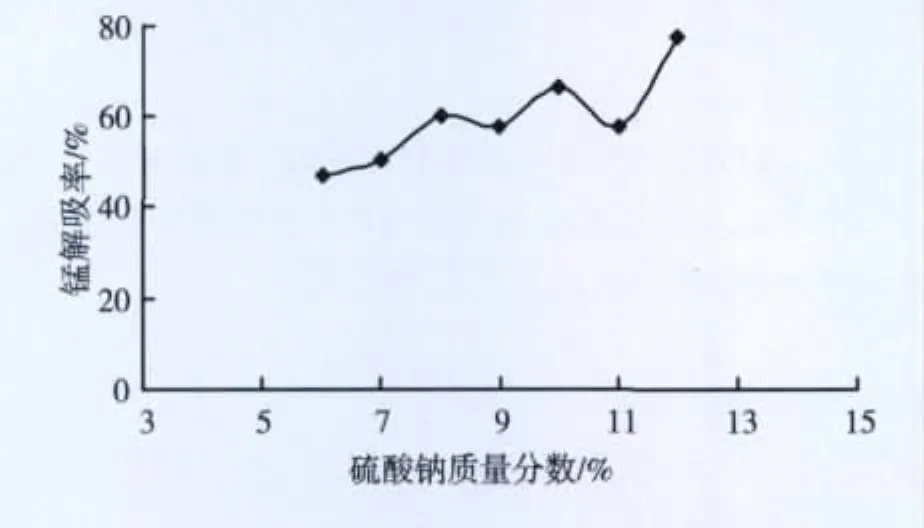
图11 不同浓度Na2SO4对锰解吸率影响

图12 不同体积Na2SO4(8%)对锰解吸率的影响

图13 不同作用时间(Na2SO412%)对锰解吸率的影响
由图11~13可以发现,提高Na2SO4浓度,锰的解吸率上升,在12%时接近80%,效果同NaCl类似。由图13发现再生速率快,时间在15 min内已达到平衡,解吸后锰离子浓度在6~7 g/L范围内。由再生试验,可以得出小型试验效果较好,单次解吸效率很高,在60% ~70%之间,且再生液中Mn2+浓度很高,达到了6 g/L以上,再生容易。
2.5.3 树脂使用次数对交换容量的影响
树脂的交换容量随使用次数的变化见表3。结果表明:采用10%的Na2SO4做再生剂,经过25个周期的吸附和再生,树脂的交换容量没有明显减少。

表3 树脂吸附Mn2+总量随使用次数的变化
2.5.4 离子交换柱模拟试验
试验采用50 g离子交换树脂,填入直径2.2 cm长15 cm交换柱中,采用试验配制的含氨和锰的模拟废水,以9 mL/min流量进行交换,结果见图14。
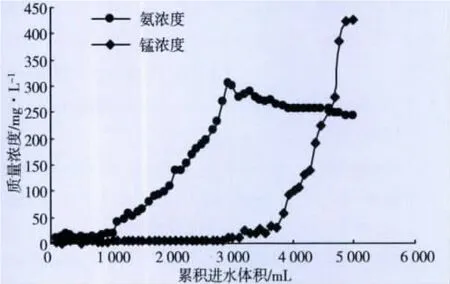
图14 模拟废水不同体积时锰、氨浓度
结果表明,前2 800 mL出水Mn2+含量均低于2 mg/L,前3 L出水树脂吸附Mn2+总量为1 148 mg,穿透在4 800 mL时;铵根离子的吸附较少,但前期也能吸附大部分,后期随着废水的加入,锰离子逐渐取代前期吸附的铵根离子,使出水氨氮的质量浓度逐步提高至300 mg/L。由于离子交换柱交换时有一部分树脂没有完全饱和,所以采用双柱串联的方式可提高树脂利用率。
再生试验:采用顺流再生方式,再生液为10%Na2SO4150 mL,加入到上一步吸附饱和的树脂中(根据计算已吸附锰1 742 mg,氨89 mg),当再生液出水体积达到25 mL时测定其中锰的浓度,计算再生的效率。结果如表4所示。

表4 树脂再生时锰的出水浓度及再生效率
由离子交换柱动态试验,表4表明该树脂对Mn2+有较好的交换吸附性能,再生效率达到总交换容量的84.8%,符合工业应用的50% ~90%的范围内。
3 结论
①离子交换法是比加碱中和沉淀法、碳酸锰沉淀法更具有优势的方法,具有达标可靠、工艺简单、操作灵活和回收率较高的优点。②树脂对废水中的Mn2+有较强的交换能力,pH值为6的静态条件下,树脂的平衡交换容量约为每克湿树脂33 mg Mn2+。③时间、温度、pH值等影响因素较易控制,电解锰废水处理的工艺稳定性高。④再生试验表明,单次再生的效率高,可达60% ~70%,锰浓度达到6 g/L,满足回用电解槽的要求。⑤该技术不同于现有的还原曝气中和沉淀法等废水处理末端处理技术,提高锰资源利用水平,减少了锰和氨的排放,缓解地表水环境压力,且投资较低,回收率高,处理工艺可靠实用,是电解锰废水处理一条新路径。
[1]钟 琼,廖德祥,李小明,等.电解金属锰生产废水处理技术的研究进展[J].中国锰业,2005,23(4):7-9.
[2]姚 俊,田宗平,姚祖风,等.电解金属锰废水处理的研究[J].中国锰业,2000,18(3):25-27.
[3]兰文艺,邵 刚.实用环境工程手册[M].北京:化学工业出版社,2002.
[4]梁志冉,涂 勇,田爱军,等.离子交换树脂及其在废水处应用[J].污染防治技术,2006,19(3):34-36.
[5]李红艳,李亚新,李尚明.离子交换技术在重金属工业理中的应用[J].水处理技术,2008,34(2):12-15.
[6]金明柏.水处理系统设计实务[M].北京:中国电力出版社,2009:171.

