pcDNA3.1/Cx43真核表达质粒的构建及其在人神经胶质瘤U251细胞中的稳定过表达
李嘉杰,闻海兵,邹树峰,严 剑,洪 涛
(1.南昌大学医学院研究生院 330000;2.南昌大学第一附属医院神经外科 330006)
缝隙连接蛋白(connexin,Cx)可能与体内肿瘤的发生、发展过程有着密切的联系,Cx43作为Cx家族最常见的一种,其表达量的改变直接影响缝隙连接的功能,导致体内肿瘤的发生。前期体外研究发现,转染Cx43cDNA的C6细胞缝隙连接功能增强,化疗的旁观者效应明显放大。然而,Cx43在体内是否也有同样的作用还不得而知,为此本研究通过构建Cx43真核表达质粒,并将其转染到人神经胶质瘤U251细胞中稳定过表达,从体内观察Cx43对脑胶质瘤侵袭性的影响。
1 材料与方法
1.1 细胞、主要试剂与仪器 人神经胶质瘤U251细胞由杭州生物技术公司提供。主要试剂:pcDNA3.1载体、LipofectamineTM-2000、TRIzol试剂购自美国Invitrogen公司,感受态细胞DH5α、TaqDNA聚合酶、限制性内切酶、T4连接酶,凝胶回收试剂盒、B型小提质粒试剂盒及G418购自上海天根生化科技有限公司,逆转录试剂盒为美国Promega公司产品,兔抗Cx43Total购自美国Zymed公司,兔抗β-actin为美国Chemicon公司产品,羊抗兔第二抗体购自美国Santa Cruz公司,胎牛血清(fetal bovine serum,FBS)和青链霉素混合液为美国HyClone公司产品。主要仪器:倒置相差显微镜(日本Olympus)、聚合酶链反应(polymerase chain reaction,PCR)仪(美国Bio-rad)、紫外分光光度计(美国 Bio-rad)、凝胶成像仪(美国Bio-rad)。
1.2 pcDNA3.1/Cx43真核表达质粒的构建
1.2.1 U251细胞总RNA的提取 按RNeasy Mini Kit(德国QIAGEN)说明书提取总RNA。
1.2.2 逆转录 PCR(reverse transcriptase-PCR,RT-PCR)扩增人Cx43基因蛋白编码序列子 根据GenBank数据库人Cx43基因序列(CR541660),利用Vector NTI Advance 10软件自行设计Cx43基因的全长引物(上游:5′-GTG CTA GCT TAT GGG TGA CTG GAG CGC C-3′;下 游:5′-GCG GGT ACC CAG GAT CTC CAG GTC AT-3′,分别带有 NheⅠ和KpnⅠ酶切位点,扩增产物长1 168bp)。β-actin引物采用上海闪晶分子生物技术研究所的β-actin序列(上游:5′-CCC ATC TAT GAG GGT TAC GC-3′,下游:5′-TTT AAT GTC ACG CAC GAT TTC-3′,扩增产物长150bp)。两对引物均由上海捷瑞生物工程有限公司合成。以提取的总RNA为模板,用ReverTra Ace-αTMKit(天根生化科技有限公司)反转录合成cDNA第一条链。取反转录产物2μL,PCR扩增Cx43编码序列,PCR反应条件为:94℃预变性3min,94℃变性60s,58℃退火30s,72℃延伸1min,共33个循环,最后72℃延伸5min。PCR扩增产物行1%琼脂糖凝胶电泳,用凝胶图像仪分析并进行照相。用DNA凝胶回收试剂盒(安徽U-GENE公司)切胶回收Cx43PCR产物。
1.2.3 pCMV-Cx43cDNA重组质粒的构建 NheⅠ和KpnⅠ限制性内切酶对Cx43RT-PCR扩增产物及pcDNA3.1质粒进行双酶切,酶切产物切胶回收后用高效DNA连接酶,16℃连接16h;将连接产物转化至E.coli DH5α感受态细菌,G418平板筛选。挑取阳性克隆,摇菌过夜,提取质粒。将构建的重组质粒命名为pcDNA3.1/Cx43。
1.2.4 pCMV-Cx43cDNA重组质粒鉴定 NheⅠ和KpnⅠ限制性内切酶对重组质粒进行单酶切及双酶切,并送天根生化科技有限公司(北京)进行测序鉴定。
1.3 pcDNA3.1/Cx43重组质粒转染U251细胞及G418筛选稳定转染细胞系
1.3.1 U251细胞的培养 U251细胞在含10%FBS,37℃、95%湿度、5%CO2的 Dulbecco′s改良 Eagle培养基(Dulbecco′s modified Eagle′medium,DMEM)中常规培养,每周传代3次。
1.3.2 U251细胞的转染与筛选 将处于对数生长期的U251细胞用0.25%胰蛋白酶-乙二胺四乙酸(美国Gibco公司)消化后吹打成单细胞悬液,转染24h前将4×105个细胞接种至6孔板中,使转染时细胞密度达到90%~95%。将LipofectamineTM-2000 10μL加入240μL无血清DMEM中混匀,室温放置5min;取pcDNA3.1/Cx431重组质粒4μg加入无血清DMEM中混匀(总量250μL),将上述2种液体混匀制成质粒-脂质体混合物,室温放置20min。用无血清DMEM洗涤细胞3次,将质粒-脂质体混合物逐滴滴加至6孔板中,轻轻混匀,置37℃、5%CO2细胞培养箱中培养。5h后更换为完全培养基(含10%FBS);24h后按1∶6传代;24h后,待细胞贴壁,换为含800μg/mL G418的完全培养基筛选3周,得到抗性克隆,用无菌移液器枪头挑取单克隆继续培养2周以上,以获得稳定细胞系。
1.4 RT-PCR检测稳定转染U251细胞及未转染U251细胞中Cx43的基因表达水平 用TRIzol试剂提取细胞总RNA,逆转录后行PCR检测,PCR反应条件为:94℃预变性3min,94℃变性60s,58℃退火30s,72℃延伸1min,共33个循环,最后72℃延伸5min。同时,内参β-actin以等量的RNA为模板,同时进行PCR扩增,PCR反应条件为:94℃预变性3min,94℃变性30s,55℃退火30s,72℃延伸30s,共28个循环,最后72℃延伸5min。
1.5 Weston blot检测稳定转染U251细胞及未转染U251细胞中Cx43蛋白的表达水平 用蛋白提取试剂盒提取细胞总蛋白,取20μL体积上样,积层胶电泳15min,电压120V;分离胶电泳45min,电压180V;转膜90min,电流350mA;5%的含吐温-20的 Tris缓冲液(Tris-buffered saline with Tween-20,TBST)脱脂奶粉室温下封闭2h;加入兔抗Cx43抗体4℃孵育过夜;然后用TBST液洗涤3次,每次10min,加入第二抗体室温下孵育4h,再用TBST液洗涤3次,每次10min,曝光。
2 结 果
2.1 PCR扩增获取Cx43序列 PCR扩增产物经琼脂糖凝胶电泳分离后得到大小约1 168bp的特异性单一条带,经比对与基因库公布的基因大小相同,见图1。
2.2 质粒pcDNA3.1(+)单酶切鉴定 鉴定结果显示出现大小约5 400bp条带,与预期相符,见图2。
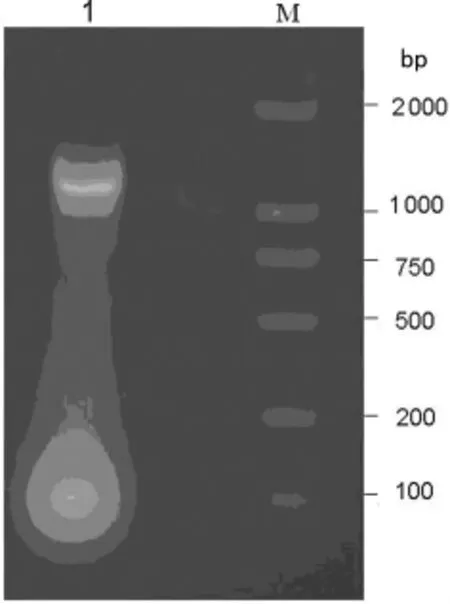
图1 PCR扩增的Cx43
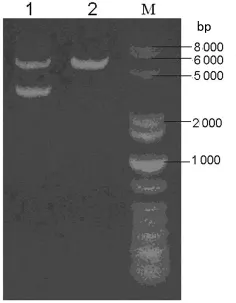
图2 质粒pcDNA3.1(+)的单酶切鉴定
2.3 pcDNA3.1/Cx43重组质粒的双酶切鉴定 用NheⅠ、KpnⅠ双酶切pcDNA3.1/Cx43重组质粒,经PCR鉴定,单酶切重组质粒大小约6 000bp,而双酶切后出现1条大小约5 000bp及1条大小约1 000bp条带,且双酶切后出现的大小约1 000bp条带与重组质粒目的基因Cx43的PCR结果在同一水平线上,其大小与基因库所提供的基本符合,酶切重组质粒酶切结果与预期结果相同,见图3。
2.4 pcDNA3.1/Cx43重组质粒测序报告 结果显示与基因库序列一致。序列如下(斜体为Cx43cDNA全序列):AGC AGA GCT CTC TGG CTA CTA GAG AAC CCA CTG CTT ACT GGC TTA TCG AAA TTA ATA CGA CTC ACT ATA GGG AGA CCC AAG CTG GCT AGC ATG GGT GAC TGG AGC GCC TTA GGC AAA CTC CTT GAC AAG GTT CAA GCC TAC TCA ACT GCT GGA GGG AAG GTG TGG CTG TCA GTA CTT TTC ATT TTC CGA ATC CTG CTG CTG GGG ACA GCG GTT GAG TCA GCC TGG GGA GAT GAG CAG TCT GCC TTT CGT TGT AAC ACT CAG CAA CCT GGT TGT GAA AAT GTC TGC TAT GAC AAG TCT TTC CCA ATC TCT CAT GTG CGC TTC TGG GTC CTG CAG ATC ATA TTT GTG TCT GTA CCC ACA CTC TTG TAC CTG GCT CAT GTG TTC TAT GTG ATG CGA AGG GAA GAG AAA CTG AAC AAG AAA GAG GAA GAA CTC AAG GTT GCC CAA ACT GAT GGT GTC AAT GTG GAC ATG CAC TTG AAG CAG ATT GAG ATA AAG AAG TTC AAG TAC GGT ATT GAA GAG CAT GGT AAG GTG AAA ATG CGA GGG GGG TTG CTG CGA ACC TAC ATC ATC AGT ATC CTC TTC AAG TCT ATC TTT GAG GTG GCC TTC TTG CTG ATC CAG TGG TAC ATC TAT GGA TTC AGC TTG AGT GCT GTT TAC ACT TGC AAA AGA GAT CCC TGC CCA CAT CAG GTG GAC TGT TTC CTC TCT CGC CCC ACG GAG AAA ACC ATC TTC ATC ATC TTC ATG CTG GTG GTG TCC TTG GTG TCC CTG GCC TTG AAT ATC ATT GAA CTC TTC TAT GTT TTC TTC AAG GGC GTT AAG GAT CGG GTT AAG GGA AAG AGC GAC CCT TAC CAT GCG ACC AGT GGT GCG CTG AGC CCT GTC AAA GAC TGT GGG TCT CAA AAA TAT GCT TAT TTC AAT GGC TGC TCC TCA CCA ACC GCT CCC CTC TCG CCT ATG TCT CCT CCT GGG TAC AAG CTG GTT ACT GGC GAC AGA AAC AAT TCT TCT TGC CGC AAT TAC AAC AAG CAA GCA AGT GAG CAA AAC TGG GCT AAT TAC AGT GCA GAA CAA AAT CGA ATG GGG CAG GCG GGA AGC ACC ATC TCT AAC TCC CAT GCA CAG CCT TTT GAT TTC CCC GAT GAT AAC CAG AAT TCT AAA AAA CTA GCT GCT GGA CAT GAA TTA CAG CCA CTA GCC ATT GTG GAC CAG CGA CCT TCA AGC AGA GCC AGC AGT CGT GCC AGC AGC AGA CCT CGG CCT GAT GAC CTG GAG ATC CTG GGT ACC GAG CTC GGA TCC ACT AGT CCA GTG TGG TGG AAT TCT GCA GAT ATC CAG CAC AGT GGC GGC CGC TCG AGT CTA GAG CCC C。

图3 pcDNA3.1/Cx43重组质粒的双酶切鉴定
2.5 稳定转染及未转染U251细胞中Cx43的表达水平 RTPCR结果显示未转染及转染空质粒的U251细胞中Cx43表达较低且无明显差异,而稳定转染重组质粒的U251细胞则高表达Cx43,见图4。
2.6 稳定转染U251细胞中Cx43蛋白的表达水平 Weston blot结果显示在过表达的U251细胞内Cx43蛋白表达水平明显高于未转染阴性对照组,见图5。

图4 稳定转染及未转染U251细胞中Cx43基因的表达水平

图5 稳定转染U251细胞中Cx43蛋白的表达水平
3 讨 论
缝隙连接蛋白是构成缝隙连接通道的基本单位,目前在哺乳动物体内发现的缝隙连接蛋白已有20余种[1],其相对分子质量为20 000~56 000,根据其相对分子质量的不同分为Cx26、Cx43及Cx56等。在不同的组织中缝隙连接蛋白的表达并不相同,如在肾组织中以Cx26的表达为主,而在脑组织中则以Cx43的表达最为广泛[2-3]。Cx43是含有1 146bp的cDNA开放读码框所编码的含有382个氨基酸残基的单肽[4],Cx43由核糖体合成后被转运至高尔基体,最后聚集在细胞膜上形成缝隙连接[5],在此过程中Cx43修饰状态及表达量的改变都会影响到缝隙连接的功能,最后导致疾病的发生。
近年来研究发现,Cx43在维持神经系统正常功能中发挥重要作用,其表达的改变可能与多种神经系统疾病的发生有关;有研究提示Cx43可能参与蛛网膜下腔出血后脑血管痉挛的发生[6-7];张永明等[8]研究发现颅脑损伤后 Cx43的表达上升,提示其可能参与了颅脑损伤的病理形成过程,并且可能与继发性脑损伤的加重有关;Garbelli等[9]研究表明在难治性癫痫患者的脑组织中Cx43的表达升高,提示Cx43表达的改变可能与难治性癫痫的发病有关。有研究提示Cx43也参与了其他脑血管疾病的发生与发展过程,如帕金森病、脑动脉粥样硬化等[10-11]。
神经胶质瘤来自神经系统支持组织,属神经外胚叶肿瘤,占颅内肿瘤的35.26%~60.96%,是颅内肿瘤中最常见的一种[12-13],其发病机制复杂。人们对其发病机制存在不同看法:Ding等[14]发现水通道蛋白4(aquaporin 4,AQP4)在调控神经胶质瘤细胞的迁移和侵袭性方面发挥着重要作用,认为AQP4可能与神经胶质瘤的发展有着密切的联系;Xie等[15]发现,在不同病理类型和分级的神经胶质瘤中结缔组织生长因子(connective tissue growth factor,CTGF)mRNA的表达不同,在神经胶质瘤Ⅰ~Ⅱ级中的表达明显低于在神经胶质瘤Ⅲ~Ⅳ级中的表达,因此认为CTGF可能在神经胶质瘤的发生、发展过程中发挥一定作用。而近年Caltabiano等[16]的研究却发现级别越高的星型神经胶质瘤中Cx43的表达越高,可见Cx43在神经胶质瘤的发展过程中具有重要的作用。作者希望通过构建重组过表达Cx43质粒,将其转染到神经胶质瘤细胞,改变其Cx43的表达,为下一步进行神经胶质瘤体内的侵袭性研究奠定实验基础。
[1] Liao Y,Day KH,Damon DN,et al.Endothelial cell-specific knockout of connexin 43causes hypotension and bradycardia in mice[J].Proc Natl Acad Sci USA,2001,98(17):9989-9994.
[2] Sõhl G,Willecke K.Gap junctions and the connexin protein family[J].Cardiovasc Res,2004,62(2):228-232.
[3]van Veen AA,van Rijen HV,Opthof T.Cardiac gap junction channels:modulation of expression and channel properties[J].Cardiovasc Res,2001,51(2):217-229.
[4] Yancey SB,John SA,Lal R,et al.The 43-kD polypeptide of heart gap junctions:immunolocalization,topology,and functional domains[J].J Cell Biol,1989,108(6):2241-2254.
[5] Saez JC,Berthoud VM,Branes MC,et al.Plasma membrane channels formed by connexins:their regulation and functions[J].Physiol Rev,2003,83(4):1359-1400.
[6] Wang H,Hong T,Wang H,et al.Altered expression of connexin43and its possible role in endothelin-1-induced contraction in rabbit basilar artery[J].Neurol Res,2009,31(1):67-73.
[7] Hong T,Wang H,Wang Y,et al.Effects of gap junctional blockers on cerebral vasospasm after subarachnoid hemorrhage in rabbits[J].Neurol Res,2009,31(3):238-244.
[8] 张永明,漆松涛,黄广龙,等.缝隙连接蛋白Cx43在爆炸伤兔脑组织中的表达[J].中国微侵袭神经外科杂志,2010,6(15):279-281.
[9] Garbelli R,Frassoni C,Condorelli DF,et al.Expression of connexin 43in the human epileptic and drug-resistant cerebral cortex[J].Neurology,2011,76(10):895-902.
[10]Johnstone SR,Ross J,Rizzo MJ,et al.Oxidized phospholipid species promote in vivo differential cx43phosphorylation and vascular smooth muscle cell proliferation[J].Am J Pathol,2009,175(2):916-924.
[11]Kawasaki A,Hayashi T,Nakachi K,et al.Modulation of connexin 43in rotenone-induced model of Parkinson′s disease[J].Neuroscience,2009,160(1):61-68.
[12]张纪.深入开展胶质瘤综合治疗及其基础研究[J].中华神经外科杂志,2003,19(1):1-2.
[13]朱丽丽.王忠诚院士解读脑胶质瘤[J].抗癌之窗,2010(1):17-18.
[14]Ding T,Ma Y,Li W,et al.Role of aquaporin-4in the regulation of migration and invasion of human glioma cells[J].Int J Oncol,2011,38(6):1521-1531.
[15]Xie D,Yin D,Wang HJ,et al.Levels of expression of CYR61and CTGF are prognostic for tumor progression and survival of individuals with gliomas[J].Clin Cancer Res,2004,10(6):2072-2081.
[16]Caltabiano R,Torrisi A,Condorelli D,et al.High levels of connexin 43mRNA in high grade astrocytomas.Study of 32cases with in situ hybridization[J].Acta Histochem,2010,112(6):529-535.

