采用铅黄铁矾去除硫酸体系中的铁
何 静,罗 超,唐谟堂,鲁君乐,王小能,王 涛
(中南大学 冶金科学与工程学院,长沙 410083 )
采用铅黄铁矾去除硫酸体系中的铁
何 静,罗 超,唐谟堂,鲁君乐,王小能,王 涛
(中南大学 冶金科学与工程学院,长沙 410083 )
研究硫酸体系中铅黄铁矾的形成条件,考察pH值、温度、PbSO4用量、时间和晶种浓度对铅黄铁矾形成及除铁率的影响。结果表明:当pH>0.7,温度大于75 ℃时,形成铅黄铁矾;在维持溶液pH为1.3、温度95 ℃、硫酸铅的加入量为理论量的1.2倍、晶种浓度为8 g/L、时间2.5 h的最优条件下,平均除铁率高于95%;得到的铅黄铁矾渣平均含Pb 22.47%、Fe 23.74%、Zn 1.96%;经硫酸化焙烧−水浸或直接用锌废电解液浸出锌和铁后,浸出渣含Pb均大于60%,可返回作沉矾剂,亦可作为炼铅的原料。
铅黄铁矾;形成条件;硫酸铅;晶种
目前,世界金属锌年产量的80%以上采用“焙烧−浸出−电积”的湿法工艺生产。在焙烧过程中,闪锌矿中的锌大部分生成ZnO,采用废电解液即可溶解,浸出液净化除杂后进行电积产出电锌并再生硫酸,但还有相当部分锌与精矿中的铁结合生成铁酸锌,必须在高温高酸的条件下才能浸出其中的锌,铁也同时进入浸出液。目前,湿法炼锌中常用的几种主要除铁方法有氢氧化铁沉淀法、黄钾铁矾法、针铁矿法和赤铁矿法等[1−4]。氢氧化铁沉淀法,铁以氢氧化铁胶体析出,其缺点是固液分离作业困难,特别是当溶液含铁太高时,甚至可能导致生产过程无法进行;针铁矿法主要缺点是稀散金属随铁渣损失量大,且中和剂耗量多[5−7]。赤铁矿法要缺点是:由于需要昂贵的钛材制造高压设备和附设SO2液化工厂,投资费用高;需要一个用SO2单独还原铁的阶段;酸平衡问题用石灰中和解决,石膏渣的销售在日本之外一般都存在市场问题[8]。黄钾铁矾法主要缺点是渣量大,铁矾渣稳定性差,堆存性不好,不但占用宝贵的土地资源,而且铁矾渣中的重金属在自然堆存条件下会不断溶出从而污染地下水和土壤[9−11]。由此,如何经济环保地除铁成为当今有色冶金工业面临的严峻挑战。作者认为研究铅黄铁矾的形成是解决湿法冶金过程中除铁问题的又一重要途径。
硫酸体系中铅黄铁矾形成的关键在于将Pb2+加入到硫酸铁溶液中时,有效地控制条件,使得PbFe6(SO4)4(OH)12优先于PbSO4生成;或者是将PbSO4加入到硫酸铁溶液中时,有效地控制条件,使得PbSO4转化成PbFe6(SO4)4(OH)12。DUTRIZAC等[12−16]率先于1980年用可溶性铅盐(硝酸铅、乙酸铅等)在硫酸体系和氯盐体系合成铅黄铁矾,但是合成时间长达20 h。DUTRIZAC等[12−16]还研究了在高压釜中用硫酸铅合成铅黄铁矾,但时间较长(24 h),温度高达150 ℃,设备昂贵。为此,本文作者研究用硫酸铅作沉矾剂除铁,考察了pH、温度、时间、硫酸铅用量、晶种浓度对铅黄铁矾的形成及除铁率的影响,取得了较好的试验结果。
1 实验
1.1 试剂
试验用试剂有硫酸(工业硫酸98%)、硫酸铁(分析纯)、硫酸铅(分析纯)、氧化锌(分析纯)。
本研究采用日本Rigaku公司所产D/max−2500型X射线衍射仪对沉铁试验所得铅黄铁矾渣的晶体结构进行表征。衍射条件为:Cu Kα1靶(λ=1.540 6 Å),石墨单色器滤波片,管电流100 mA,管电压50 kV,扫描速度1 (°)/min,起始扫描角度2θ=5°,终止扫描角2θ=80°。采用日本JEOF公司所产JSM−5600LV型扫描电子显微镜对矾渣微观形貌和粒径进行表征。
1.2 试验方法
实验在500 mL的三口平底烧瓶中进行,试验装置示意图如图1所示。
首先配制含Fe3+10 g/L的酸性硫酸铁溶液,量取150 mL的硫酸铁溶液,将其加入三口烧瓶中,在DF-2集热式磁力加热搅拌器上油浴加热并搅拌,开启冷却水,使挥发出来的水蒸气冷凝回流。待温度恒定于预定值后,加入一定量的硫酸铅,并开始计时,每15 min测溶液的pH,加氧化锌中和,保持溶液酸度不变,达到预定时间后,过滤、洗涤,量取滤液体积,分析其中Fe3+的含量。矾渣在FN101-2A型鼓风干燥箱中干燥脱水后(温度50 ℃),称取质量,取样做XRD和SEM等分析。
铁的浓度用重铬酸钾法测定,用pHS-818-S酸度计测定溶液pH值。除铁率以液计为准,液计沉铁率R的计算式如下:

式中:mL(Fe)是沉铁后溶液中铁的含量;mT(Fe)是原液中铁的含量。

图1 锌渣浸出试验装置示意图Fig. 1 Schematic diagram of two counter- current acid leaching set-up of zinc residue: 1—Condenser pipe; 2—Florence flask; 3—Thermostat with water bath; 4—Thermometer; 5—Iron support; 6—Magnetic stir bar
2 铅黄铁矾形成原理
50 ℃时Fe2O3-SO3-H2O三元系相平衡如图2所示[17−20]。按照平衡固相来分类,相图大致可分成以下3类区域:
1) 平衡固相是氧化铁的水化物,即三角形1。此区域远离组分SO3,表示系统酸度非常低,高铁以氢氧化铁和针铁矿的形态从溶液中析出需要符合这种情况。铅黄铁矾除铁必须偏离这个区域,即必须使溶液保持一定酸度。
2) 平衡固相是碱式盐或碱式盐和氧化铁水合物的混合物(三角形2-7)。在此区域内除三角形7外,随着体系中SO3含量的增加,平衡母液相的铁含量均随之不断增加,一直达到液相线顶点为止。
3) 平衡固相是正盐、酸式盐或它们的混合物(三角形9~13)。本区域内的平衡液相具有较高的SO3含量,且随着体系中SO3含量的增加,平衡母液相的铁含量急剧下降。
铅黄铁矾法除铁的操作条件主要位于图2的三角形2和3,与它们相应的平衡固相草黄铁矾([H3O]2O·3Fe2O3·4SO3·6H2O)不论在成分上还是物理化学性质上都和铅黄铁矾(PbO·3Fe2O3·4SO3·6H2O)非常相近。在此区域内,随着溶液酸度的减小,草黄铁矾趋于不稳定,并将转化为含水氧化铁。为使高铁以铁矾析出,必须使溶液保持一定酸度。

图2 Fe2O3-SO3-H2O三元体系相平衡Fig. 2 Phase equilibrium of Fe2O3-SO3-H2O ternary system at 50 ℃
从硫酸铁溶液中沉淀铁矾的反应如下[21]:
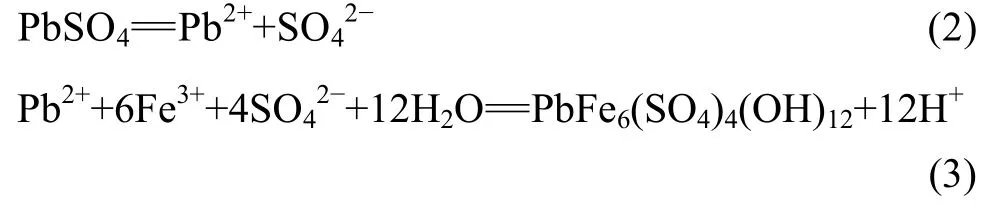
铅黄铁矾形成时,产生硫酸。必须将酸中和,反应才能继续进行。
根据DUTRIZAC[22]对铁矾种类对黄钠铁矾形成影响的研究表明:铅黄铁矾比黄钾铁矾更易形成,更稳定。
3 结果与讨论
3.1 除铁条件试验
采用单因素试验方法,考察了pH、温度、时间、硫酸铅的用量、晶种浓度5个条件对铅黄铁矾的形成及除铁率的影响。
3.1.1 pH的影响
在温度95 ℃、反应时间3 h、10 g/L Fe3+、硫酸铅用量为1.4倍理论量、不加晶种、ZnO作中和剂的固定条件下,改变pH以考察其对铅黄铁矾的形成及除铁率的影响,结果如图3所示。
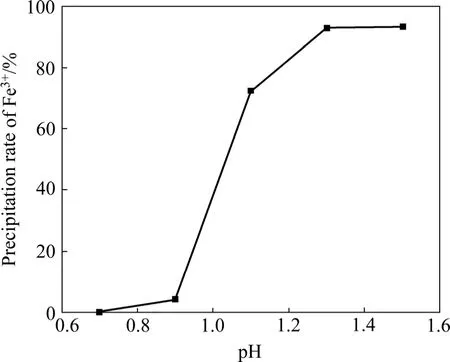
图3 pH值对除铁率的影响Fig. 3 Effect of pH on precipitation rate of Fe3+
由图3可知,pH对沉矾过程影响较为显著。pH在0.7以下不能形成铅黄铁矾,pH的增大有利于铅黄铁矾的形成;除铁率随着pH的增大而显著升高,当pH由0.9提高到1.3时,除铁率由4.17%上升至92.72%,此后继续增大pH,除铁率基本保持恒定。从除铁率、Fe3+的水解pH等方面综合考虑,选择最优pH为1.3。
3.1.2 温度的影响
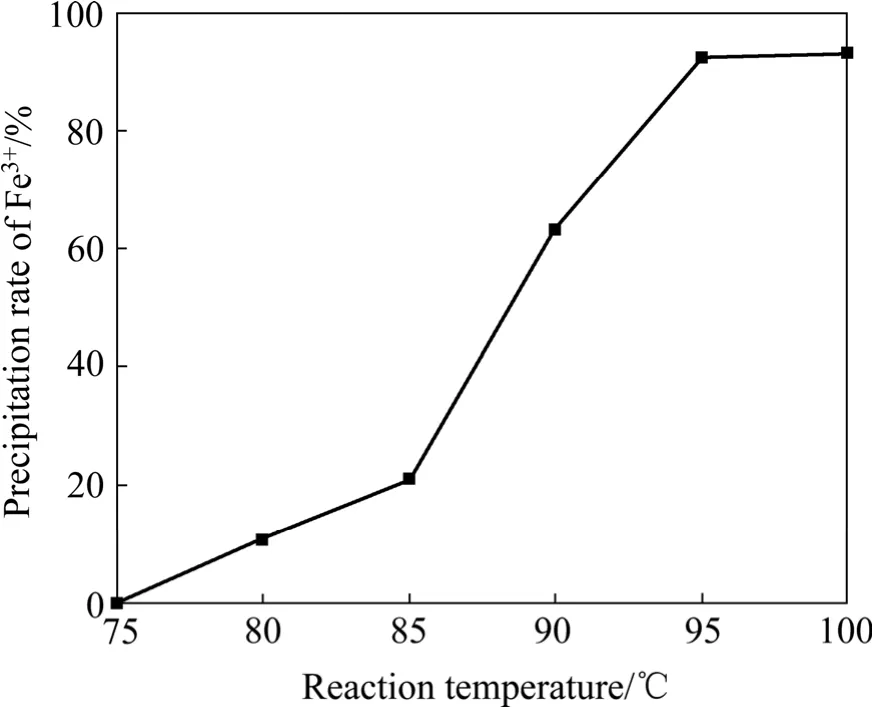
图4 温度对除铁率的影响Fig. 4 Effect of reaction temperature on precipitation rate of Fe3+
在pH=1.3、反应时间3 h、10 g/L Fe3+、硫酸铅用量为1.4倍理论量、不加晶种、ZnO作中和剂的固定条件下,改变温度以考察其对铅黄铁矾的形成及除铁率的影响,其结果如图4所示。由图4可以看出,温度在75 ℃下,不能形成铅黄铁矾,温度的升高有利于铅黄铁矾的形成;温度从75℃升高到95℃时,除铁率从0上升到92.72%,此后继续提高温度,除铁率基本保持恒定,从除铁率和节能降耗等方面综合考虑,选择最佳沉矾温度为95 ℃。
3.1.3 硫酸铅用量的影响
在pH=1.3、温度95 ℃、反应时间3 h、10 g/L Fe3+、不加晶种、ZnO作中和剂的固定条件下,改变硫酸铅用量以考察其对铅黄铁矾的形成及除铁率的影响,其结果如图5所示。

图5 硫酸铅用量对除铁率的影响Fig. 5 Effect of PbSO4stoichiometric on precipitation rate of Fe3+
由图5可知,随着硫酸铅用量的增加,除铁率随之快速上升,硫酸铅加入量由1.0倍增至1.2倍时,除铁率则由76.35%上升至92.18%,此后继续增大硫酸铅的用量,除铁率趋于稳定。因此,选择最佳硫酸铅用量为1.2倍的理论量。
3.1.4 晶种用量的影响
在pH=1.3、温度95 ℃、反应时间3 h、10 g/L Fe3+、硫酸铅用量为1.4倍理论量、ZnO作中和剂的固定条件下,改变晶种用量以考察其对铅黄铁矾的形成及除铁率的影响,结果如图6所示。由图6可知,随着晶种浓度的增加,除铁率不断增加。晶种加入量由0增至8 g/L时,除铁率则由71.61%上升至89.87%,此后继续增大晶种的用量,除铁率趋于稳定。因此,选择最佳晶种用量为8 g/L。
3.1.5 时间的影响
在pH=1.3、温度95 ℃、10 g/L Fe3+、硫酸铅用量为1.4倍理论量、ZnO作中和剂的固定条件下,改变反应时间以考察其对铅黄铁矾的形成及除铁率的影响,其结果如图7所示。由图7可知,随着反应时间的延长,除铁率不断增加;晶种的加入加速了铅黄铁矾的形成,2.5 h时,除铁率达到95.69%,此后继续延长反应时间,除铁率趋于平稳。因此,选择最佳反应时间为2.5 h。
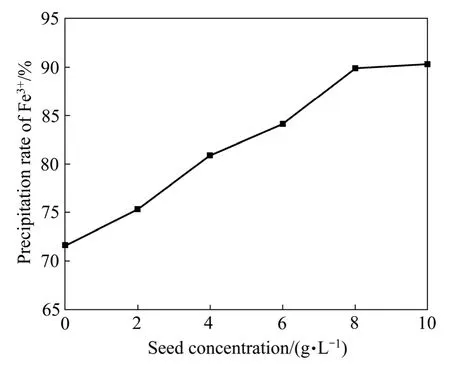
图6 晶种浓度对除铁率的影响Fig. 6 Effect of seed concentration on precipitation rate of Fe3+

图7 不同晶种浓度时时间对除铁率的影响Fig. 7 Effect of reaction time on precipitation rate of Fe3+at different seed concentrations
3.2 最佳除铁条件
根据单因素条件试验结果,确定沉铁的最佳条件为pH=1.3、沉矾温度95 ℃、硫酸铅的加入量为理论量的1.2倍、晶种浓度为8 g/L、反应时间2.5 h、ZnO作中和剂。在此最优条件下,进行4次重复除铁试验,其结果如表1所列。由表1可知,沉铁后溶液含Fe3+在1 g/L以下,平均除铁率高于95%;铅黄铁矾渣平均含Pb 22.47%、Fe 23.74%、Zn 1.96%。

表1 最佳沉铁试验结果Table 1 Results of Fe precipitation by PbSO4under optimum conditions
3.3 铅黄铁矾渣的XRD谱和扫描电镜图
在pH=1.3、温度95 ℃、硫酸铅的加入量为理论量的1.2倍、晶种浓度为8 g/L、反应时间2.5 h、ZnO作中和剂的最优条下件得到的铅黄铁矾渣呈橘黄色,在60 ℃下干燥24 h,对其进行XRD和SEM分析,其结果如图8和9所示。

图8 铅黄铁矾渣的XRD谱Fig. 8 XRD pattern of lead jarosite residue

图9 铅黄铁矾渣的SEM像Fig. 9 SEM image of lead jarosite residue
由图8可知,矾渣物相主要是铅黄铁矾和少量的硫酸铅。硫酸铅包括过量的硫酸铅和被铅黄铁矾包裹的硫酸铅两部分。
图9所示为铅黄铁矾渣的SEM像。由图9 可知,矾渣形貌为斜六面体粒子,是共生晶体,直径为0.5~2.0 μm。
4 结论
1) 铅黄铁矾形成的条件为初始pH>0.7,温度大于75 ℃。时间的延长、硫酸铅含量的增加和晶种的加入都有利于铅黄铁矾的形成。
2) 除铁的最佳条件为pH=1.3、温度95 ℃、硫酸铅的加入量为理论量的1.2倍、晶种浓度为8 g/L、时间2.5 h。在此最优条件下,平均除铁率高于95%。
3) 得到的铅黄铁矾渣平均含Pb 22.47%、Fe 23.74%、Zn 1.96%,经硫酸化焙烧−水浸浸出锌、铁后,浸出渣含Pb大于60%,可返回作沉矾剂,亦可作为炼铅的原料。
4) 用硫酸铅作沉矾剂,即不带入K+或Na+等新的杂质,且可循环使用。
REFERENCE
[1]徐采栋, 林 蓉, 汪大成. 锌冶金物理化学[M]. 上海: 上海科学技术出版社, 1979. XU Cai-dong, LIN Rong, WANG Da-cheng. Physical chemistry of zinc metallurgy[M]. Shanghai: Shanghai Scientific & Technical Press, 1979.
[2]梅光贵, 王德润, 周敬元, 王 辉. 湿法炼锌学[M]. 长沙: 中南大学出版社, 2001. MEI Guang-gui, WANG De-run, ZHOU Jin-yuan, WANG Hui. Hydrometallurgy of zinc[M]. Changsha: Central SouthUniversity Press, 2001.
[3]陈国发. 重金属冶金学[M]. 北京: 北京工业出版社, 2000. CHEN Guo-fa. Heavy metals metallurgy[M]. Beijing: Metallurgical Industry Press, 2000.
[4]陈 阳. 湿法炼锌中铁的行为、作用及控制[J]. 湖南有色金属, 2006, 22(3): 30−32. CHEN Yang. Iron’s acts, role and control methods in the zinc hydrometallurgy[J]. Hunan Nonferrous Metals, 2006, 22(3): 30−32.
[5]CHENG T C, DEMOPOULOS G P, SHIBACHI Y, MASUDA H. The precipitation chemistry and performance of the akita hematite process-An integrated laboratory and industrial scale study[C]// Proceedings of the TMS Fall Extraction and Processing Conference. Vancouver BC: TMS, 2003: 1657−1674.
[6]CLAASSEN J O, MEYER E H O, RENNIE J, SANDENBERGH R F. Iron precipitation from zinc-rich solutions: Defining the zincor process[J]. Hydrometallurgy, 2002, 67(1/3): 87−108.
[7]LOAN M, NEWMAN O M G, COOPER R M G, FARROW J B,PARKINSON G M. Defining the Paragoethite process for iron removal in zinc hydrometallurgy[J]. Hydrometallurgy, 2006, 81(2): 104−129.
[8]Van Niekerk, CHRISTOFFEL J. Thermal precipitation of iron from sulphate solutions[J]. Mining & Metallurgical Inst of Japan, 1985, 33(10): 691−706.
[9]DUTRIZAC J E. Effect of seeding on the rate of precipitation of ammonium jarosite and sodium jarosite[J]. Hydrometallurgy, 1996, 42(3): 293−312.
[10]ELGERSMA F, WITKAMP G J, Van ROSMALEN G M. Incorporation of zinc in continuous jarosite precipitation[J]. Hydrometallurgy, 1993, 33(3): 313−339.
[11]KENDALL D S. Toxicity characteristic leaching procedure and iron treatment of brass foundry waste[J]. Environmental Science and Technology, 2003, 37(2): 361−371.
[12]DUTRIZAC J E, KAIMAN S. Synthesis and properties of jarosite-type compounds[J]. Can Mineral, 1976, 14: 151−158.
[13]DUTRIZAC J E, DINARDO O, KAIMAN S. Factors affecting lead jarosite formation[J]. Hydrometallurgy, 1980, 5(4): 305−324.
[14]DUTRIZAC J E, DINARDO O. The co-precipitation of copper and zinc with lead jarosite[J]. Hydrometallurgy, 1983, 1(1): 61−78.
[15]DUTRIZAC J E, JAMBOR J L. Formation and characterization of argentojarosite and plumbojarosite and their relevance to metallurgical processing[J]. In Applied Mineralogy, 1985: 507−530.
[16]DUTRIZAC J E. The precipitation of lead jarosite from chloride media[J]. Hydrometallurgy, 1991, 26(3): 327−346.
[17]陈家镛, 余淑秋, 伍志春. 湿法冶金中铁的分离与利用[M].北京: 冶金工业出版社, 1991. CHEN Jia-yong, YU Shu-qiu, WU Zhi-chun. Separation and utilization of iron in hydrometallurgy[M]. Beijing:Metallurgical Industry Press, 1991.
[18]马荣骏. 湿法冶金原理[M]. 北京: 冶金工业出版社, 2007. MA Rong-jun. Principle on hydrometallurgy[M]. Beijing: Metallurgical Industry Press, 2007.
[19]马 莹, 何 静, 马荣骏. 三价铁离子在酸性水溶液中的行为[J]. 湖南有色金属, 2005, 21(1): 36−39. MA Ying, HE Jing, MA Rong-jun. Fe(Ⅲ) behaviores in acid solution[J]. Hunan Nonferrous Metals, 2005, 21(1): 36−39.
[20]CASAS J M, CRISÓSTOMO G, CIFUENTES L. Speciation of the Fe(Ⅱ)-Fe(Ⅲ)-H2SO4-H2O system at 25 and 50 ℃[J]. Hydrometallurgy, 2005, 80(4): 254−264.
[21]FORRAY F L, SMITH A M L, NAVROTSKY A, WRIGHT K, HUDSON-EDWARDS K A, DUBBIN W E. Synthesis, characterization and themochemistry of a Pb-jarosite[J]. Geochimica et Cosmochimica Acta, 2010, 74(1): 215−224.
[22]DUTRIZAC J E. The effectiveness of jarosite species for precipitating sodium jarosite[J]. JOM, 1999, 51(12): 30−32.
(编辑 李艳红)
Technique of ferrum-removal by lead jarosite from sulfuric acid solution
HE Jing, LUO Chao, TANG Mo-tang, LU Jun-yue, WANG Xiao-neng, WANG Tao
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
The formation condition of lead jarosite was studied, the effects of pH, temperature, PbSO4dosage, time and seed concentration on the formation condition of lead jarosite and the precipitation rate of Fe were investigated. The results show that lead jarosite form under the following conditions, as pH>0.7, temperature larger than 75 ℃. The precipitation rate of Fe is larger than 95% under the following optimum conditions, as maintaining pH range 1.3, temperature 95 ℃, 1.2 times of theoretical fraction of PbSO4, seed concentration 8 g/L. The contents of Pb, Fe and Zn in lead jarosite are 22.47%, 23.74% and 1.96%, respectively, after leaching of Zn and Fe with sulfation roasting before water leaching or zinc waste electrolyte directly, the lead content in the leaching residue is larger than 60%, can be returned to remove iron and used as raw material for lead smelting.
lead jarosite; formation condition; lead sulphate; seed
TF813
A
国家自然科学基金资助项目(51174240);广东省产学研资助项目(20100908)
2011-09-26;
2012-03-15
何 静,副教授,博士;电话:0731-88830470;E-mail: he6213@163.com
1004-0609(2012)10-2890-06

