盐酸戊乙奎醚预先给药对盐酸所致大鼠急性肺损伤时LXR-α表达的影响
李昌达 高东艳
吸入性肺炎是临床常见的一种疾病,反流性胃内容物可引发急性肺损伤(acute lung injury, ALI),严重者会发展为急性呼吸窘迫综合征[1]。在人体内广泛分布的神经性乙酰胆碱系统和非神经性乙酰胆碱系统具有重要的生理学和病理学意义。近年来,运用作用于胆碱能系统药物作为治疗急性肺损伤的辅助手段已经开始应用于临床,并取得了一定进展。盐酸戊乙奎醚(PHC)是我国自主研发的新型选择性胆碱能受体阻断剂,能选择性的拮抗M1、M3和N1、N2受体,对中枢和外周均有很强的抗胆碱作用,而对M2受体无明显作用,且无加快心率的作用,临床上应用可有效避免莨菪碱类药物因缺乏选择性所致的副作用。本研究参照Nader等[2]的方法采用盐酸吸入引起大鼠急性肺损伤,模拟临床胃内容物误吸模型,观察PHC对模型肺组织中肝脏X受体-α(LXR-α)和肿瘤坏死因子-α(TNF-α)的影响,以此探讨预先给予PHC治疗盐酸吸入性肺损伤的作用机制,为临床治疗胃内容物误吸所致的急性肺损伤提供理论依据。
1 资料与方法
1.1 资料 健康成年SD大鼠32只(山西医科大学生理实验室动物中心提供),平均体重(220±10)g。PHC(成都力思特制药股份有限公司),肝脏X受体-α,肿瘤坏死因子-α试剂盒(武汉博士德生物工程有限公司)。随机将大鼠分为4组,每组8只:(1)正常对照组(N组);(2)盐酸致(急性肺损)伤组(ALI组);(3)盐酸致伤前1h给予PHC1.0mg/kg组(P1组);(4)盐酸致伤后1h给予PHC1.0mg/kg组(P2组)。按照Nader等[2]的方法制备大鼠急性肺损伤模型。
1.2 标本采集和测定 造模成功后4h腹腔注射水合氯醛麻醉,经主动脉抽取动脉血,测定动脉血气指标。处死动物后,取右上肺组织按照1:9的比例加入生理盐水,制成10%组织匀浆,按照试剂盒说明采用双抗夹心酶联免疫吸附法(ELISA法)测定匀浆中TNF-α的浓度。10%福尔马林固定右下肺2周内行脱水、石蜡包埋,制成切片、HE染色,通过免疫组化的方法测定组织中LXR-α的表达程度。
1.3 统计学方法 应用SPSS13.0软件进行统计学分析,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
本实验在盐酸致伤后,PaO2下降,光镜下,于ALI组大鼠肺泡腔内可见大量渗出液,肺泡间质增厚,大量炎性细胞浸润,提示肺组织受到严重损伤,符合大鼠ALI的诊断标准。
2.1 PHC能减缓血氧分压下降 与N组相比,ALI、P1、P2组的血氧分压均降低(P<0.05),与ALI组比较,P1、P2两组的血氧分压均升高(P<0.05),且与P1组比较,P2组血氧分压降低(P<0.05)。见表1。
2.2 各组肺组织LXR-α和TNF-α含量变化 与N组相比,ALI、P1、P2组LXR-α蛋白含量降低,TNF-α蛋白分泌量升高(P<0.05);与ALI组比较,P1、P2两组LXR-α表达明显升高,TNF-α显著下降(P<0.05);与P1组比较,P2组LXR-α含量降低,而TNF-α含量增高(P<0.05)。见表1。ALI组大鼠肺组织中LXR-α表达低于正常组,而用应用PHC后,LXR-α表达水平明显升高,且肺间质的水肿程度和蛋白表达水平都表明P1组治疗效果明显优于P2组。见图1。

表1 大鼠肺组织PaO2、LXR-α和TNF-α的检测结果
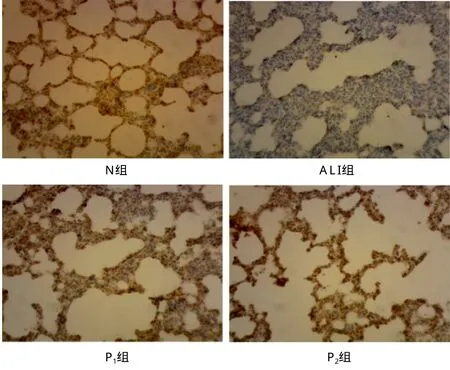
图1 各组大鼠肺组织LXR-免疫组化结果图(250×)
3 讨论
急性肺损伤是由心源性以外的各种肺内、外致病因素导致的急性、进行性呼吸衰竭[3],在临床麻醉过程中主要是由于胃内容物误吸入肺引起。其发病率为每年79/100000,死亡率更高达50%左右[4]。近年来研究认为其发病的主要机制可能与体内炎症因子和抗炎因子的失平衡有关,因此寻找合适药物调控炎症因子的表达,减轻炎症反应,成为临床的主要治疗措施之一。基于这一理论提出了多种抗炎症因子治疗方法,LXR-α即是其中可能的一种关键因子。
肝脏X受体最初是由Willy等于1995年从人类肝脏cDNA文库中分离得到,因在肝脏表达丰富而得名,随着研究的深入发现其在脾、肺、肠、肾以及到平滑肌中均有丰富表达[5]。有研究表明,LXR-α具有抗炎活性,能够抑制组织巨噬细胞凋亡,负向调节促炎症因子的活化表达[6],其作用机制可能是LXR-α可以抑制NF-κB的信号转导通路,从而抑制NF-κB及其下游炎症因子的活化表达[7-8]。而NF-κB被认为是多种炎症介质和炎症蛋白的信号转导中心通道之一[9]。应用LXR-α激动剂能够抑制NF-κB的活性并调节其诱导的炎性因子基因的表达[10]。本研究发现,损伤组中LXR-α含量较对照组有明显的下降,而在应用了PHC之后,LXR-α的水平较ALI组有了一定的提高,且预先给药组效果明显优于损伤后给药组,表明PHC预先给药可以在一定程度上上调LXR-α的活化表达。
TNF-α是一种具有代表性的炎性因子,与ALI的发病有着密切关系,其水平的高低可以直接反映肺损伤的严重程度。多项研究报道,抑制TNF-α的活化表达可以有效地阻止肺损伤时炎症反应的发生过程[11]。临床上,胃内容物误吸可以引起NF-κB活性增强,进而引起炎症因子TNF-α、IL-1、IL-6和IL-8的表达增高,引起体内炎症因子和抗炎因子失衡,同时再次激活NF-κB,形成正反馈调节,造成炎症因子的“瀑布式”释放,导致ALI。因此,我们选择TNF-α作为观察指标之一。在本次试验中,ALI组肺组织中TNF-α含量明显增高,而应用PHC后能够显著降低TNF-α的浓度,且其浓度的改变与LXR-α的含量程负相关。
在本实验中,盐酸致伤后,ALI组肺组织中LXR-α的表达较正常对照组下降,而肺组织中TNF-α表达明显升高,并呈现出负相关的关系,表明两者之间的失衡可能引起机体的炎症失控,从而参与ALI的起病过程。在损伤前一小时给予PHC能够显著提高组织中LXR-α的活化表达,并且降低TNF-α浓度,实现对肺组织的保护作用。其效果明显优于损伤后给药组。
综上所述,预先给予PHC能有效缓解胃内容物误吸所致的肺损伤,为疾病的治疗争取宝贵的时间。其机制可能与增强LXR-α表达,抑制NF-κB通路激活,降低炎症因子生成有关。
[1]Hudson LD, MilBerg JA, Anardi D, et al. Clinical risks for development of the acute respiratory distress syndrome [J].Am J Respir Crit Care Med,1995,151(2):293-301.
[2]Nader-Djialal N,Knight PR 3rd, Thusu K, et al. Reactive oxygen species contributed to oxygen-related lung injury after acid aspiration [J].Anesth Analg, 1998,87(2):127-133.
[3]张莉,陈丽,胡博.盐酸戊乙奎醚对盐酸致大鼠急性肺损伤的保护作用[J].当代医学,2012,18(4):25-26.
[4]Hopkins RO, Weaver LK, Collingridge D, et al. Two-year cognitive, emotional, and quality-of-life outcomes in acute respiratory distress syndrome[J]. Am J Respir Crit Care Med, 2005, 171(4):340-7.
[5]Chen M,Beaven S,Tontonoz P. Identification and characterization of two alternatively spliced transcript variants of human liver X receptor alpha[J]. Lipid Res,2005,46(12):2570-2579.
[5]Castrillo A, Joseph SB, Marathe C, et a1.Liver X receptordependent repression of matrix metalloproteinase-9 expression in macrophage[J]. J Biol Chem,2003,278(12):10443-10449.
[7]Yasuda T, Kanno M, Kawamoto M, et al. Suppression of inducible nitric oxide synthase and cyclooxygenase-2 gene expression by 22(R)-hydroxycholesterol requires de novo protein synthesis in activated macrophages[J]. J Steroid Biochem Mol Biol 2005, 97(4):376-383.
[8]Ogawa S, Lozach J, Benner C, et al. Molecular determinants of crosstalk between nuclear receptors and toll-like receptors[J]. Cell,2005,122(5):707-721.
[9]Zhang G, Ghosh S. Molecular mechanisms of NF-kappa B activation induced by bacterial lipopolysaccharide through Toll-like receptors[J]. J Endotoxin Res,2000,6:453-457.
[10]徐静,肖波,何春林,等.T0901317对急性肺损伤大鼠肺组织LXRα表达的影响及其抗炎作用[J].中国呼吸与危重病监护杂志,2011,10,(3):247-251.
[11]Mukherjee P, Yang SY, Wu B, et al. Tumour necrosis factor receptor gene therapy affects cellular immune responses in collagen induced arthritis in mice[J]. Ann Rheum Dis,2005, 64(11):1550-1556.