肝脏局灶性结节增生影像表现及研究进展
阎洁羽(综述) 刘凤永 王茂强(审校)
肝脏局灶性结节增生影像表现及研究进展
阎洁羽(综述) 刘凤永 王茂强(审校)
肝疾病;局限性结节状增生;超声检查,多普勒,彩色;体层摄影术,X线计算机;磁共振成像
【中国图书资料分类法分类号】R735.7;R730.42
肝脏局灶性结节增生(focal nodular hyperplasia, FNH)由Edmondson[1]于1958年首次报道。1995年,相关国际组织(International Working Party)将FNH定义为独立的肝脏再生性病变,以强调与肝脏腺瘤(即真性肿瘤)有本质区别[2]。FNH的定义是:由组织学结构正常或接近正常的良性肝细胞所组成的结节[2]。FNH多为体检时偶然发现,超声检查和CT对鉴别FNH与肝脏其他实性占位有一定难度,而MRI能够反映病变的组织学特性,因此诊断准确性较高。绝大多数FNH患者无临床症状,这些患者多无需治疗。对于有临床症状或诊断不明的患者,可考虑行动脉栓塞或手术切除治疗。
1 FNH的病因及分类
FNH的发病机制尚未完全阐明。肝脏血管异常和血管损伤曾被认为是FNH的发病因素[3];FNH与激素类药物无明确相关性,是仅次于血管瘤的第二位肝内常见良性肿瘤样病变,发病率约为0.9%[4],好发于青年女性,男女之比为1∶8。约有20%的患者为多发性FNH,当多发性FNH与多发性血管瘤同时存在时,称多灶性FNH综合征[5]。
FNH分为2类:典型FNH(80%)和非典型FNH(20%)。非典型FNH又分3个亚型:血管扩张型FNH(15%)、细胞发育不良型FNH(3%)、肝细胞增生和腺瘤样改变混合型FNH(2%)。
2 FNH的病理特点
肉眼观典型的FNH为分叶状肿块,切面中央可见星状的瘢痕纤维组织,向四周放射形成间隔而分割肿块,中央瘢痕为异常的血管结构。典型FNH病例中,绝大多数存在1个或多个肉眼可见的瘢痕结构。在组织学检查中,FNH表现为增生的实性结节,这些结节被环状或条状纤维完全或部分性包绕,肝板中度增厚(2~3层肝细胞),肝细胞形态接近正常。中央瘢痕由纤维结缔组织、增生的小胆管伴周围炎症细胞浸润以及粗细不一的异常血管组成,后者包括管壁增厚迂曲扩张的动脉、毛细血管、静脉和不定型的管腔结构等成分[6]。与肝腺瘤的供血动脉相反,供应FNH的异常动脉是从中央向周边分布,层层分级。50%的FNH病灶内有不同程度的脂肪浸润。无论是典型还是非典型FNH,均含有数量不等的Kupffer细胞[7,8]。
非典型FNH肉眼所见为非均质球形肿块,类似腺瘤,肿块分叶明显,绝大多数病例无肉眼可见的中央瘢痕。组织学观察见血管扩张型FNH由单层肝细胞肝板组成,肝板被异常扩张的肝窦所分隔,常见细胞萎缩,且存在不同程度的小胆管增生,可见少许短条形纤维间隔;混合型FNH既有血管扩张型的表现,又有腺瘤的征象;细胞发育不良型FNH包含大片细胞发育异常区域,其他表现与典型FNH相同。
概括起来,典型FNH表现为:肝脏内异常结节、异常血管结构及小胆管增生,且三者同时存在。非典型FNH表现为:存在异常结节或异常的血管结构,但均伴有小胆管增生[9]。
3 FNH的影像学表现
依据形态学、病灶与周围肝组织的差别、富血管特征及整个肝脏背景等,影像学检查对典型FNH不难作出诊断,其中CT和MRI的诊断正确性较高[10]。不典型FNH可以表现为巨大肿块、多发多灶、增强扫描强化不显著、中央瘢痕不强化、延迟扫描显示假包膜等,需与良性肿瘤和恶性肿瘤鉴别(如腺瘤、原发性肝细胞癌、纤维板层肝癌、富血供性转移瘤等)。
3.1 超声检查 病灶可为轻度低回声、等回声或轻度高回声。有些病灶周围有低回声晕,这个晕环可能为受压迫的正常肝组织或包绕病灶的血管结构所致,当病灶周围有脂肪浸润时,晕征会更加明显,因为肿块压迫正常肝实质造成肝细胞脂肪变性,因此回声比邻近正常肝组织低。超声检查可以显示肿块内较大的瘢痕结构,彩色多普勒超声和超声造影多能显示肿块内的异常血管。但总体而言,超声对FNH的定性诊断仍有一定难度。
3.2 CT扫描 多层螺旋CT可显示注入对比剂后三时相甚至多时相形态和密度改变。从满足诊断和减少辐射考虑,平扫期、动脉期、门静脉期和肝静脉期可显示FNH的特征性表现。典型FNH有分叶状的轮廓[11,12],平扫期显示病灶与周围的肝组织对比呈略低密度(合并肝脏脂肪变性时)或等密度;约33%的病例可在肿块中央见到低密度的星状瘢痕。增强扫描动脉期,除中央瘢痕外,整个病灶均匀显著强化,在门脉期和增强晚期,病灶呈均匀等密度,而中央瘢痕则出现强化。
3.3 MRI检查 MRI诊断FNH的敏感性达70%,特异性达98%,高于超声和CT的敏感性和特异性[12];MRI显示病灶内中央瘢痕的阳性率(78%)高于CT(60%)。MRI的优点为有良好的组织学、尤其是血管结构的分辨能力、成像速度快、对比剂用量少、无辐射等。FNH病灶的典型表现为T1WI呈等或轻度低信号(94%~100%),T2WI呈稍高或等信号(94%~100%),中央瘢痕在T1WI上为低信号,T2WI上为高信号(84%)[12]。FNH病灶在增强扫描的动脉期显著均匀强化,中央瘢痕在延迟期(门静脉期、肝静脉期)强化[13,14]。
MRI的特异性对比剂如超顺磁性氧化铁、锰,可分别被Kupffer细胞和肝细胞所摄取,这些对比剂可以用来检测病变肝细胞的起源。在用超顺磁性氧化铁增强时,FNH病灶内的Kupffer细胞摄取铁粒子,使病灶的T2WI信号显著降低,而原发性肝癌、转移瘤等恶性肿瘤内部缺乏Kupffer细胞,增强后信号不降低,从而明显提高了恶性肿瘤与正常肝组织的对比噪声比。中心瘢痕不摄取铁粒子,信号不降低,增强后中心瘢痕显示突出。
多灶性FNH在FNH患者中占20%~25%[5]。多灶性FNH病灶更接近于非典型FNH,因此影像学可呈不典型表现。此外,多灶性FNH可合并其他良性病变,如囊肿、血管瘤和腺瘤。有时区分多发性肝腺瘤和多灶性肝细胞癌,特别是在非肝硬化背景上的肝细胞癌,会比较困难。
FNH不具有肿瘤的真性包膜。尽管有些病例有相当明显的假包膜,那是由被FNH挤压的周围肝组织、周围血管与炎症反应等组成。假包膜通常厚数毫米,在T2WI上呈现高信号,在增强扫描的延迟期(门静脉期、肝静脉期)也有所强化。而真性肿瘤包膜发生率为60%~80%,主要由纤维构成,在T1WI和T2WI上呈低信号,延迟扫描期则持续强化。
绝大多数FNH病灶内存在中央瘢痕[12],但瘢痕组织的含量、大小差别较大。典型的FNH中央瘢痕在T2WI上为高信号、T1WI上为低信号,在增强扫描延迟期呈强化表现。中央瘢痕在T2WI上为高信号可能与瘢痕和间隔内丰富的血管、小胆管增生及其周围的炎症反应有关。中央瘢痕不是FNH的特有表现,还可见于巨大血管瘤和肝细胞癌。典型巨大血管瘤的中央瘢痕在T2WI上通常呈更大、更高信号,血管瘤本身亦为高信号,增强扫描期绝大多数病灶周边呈结节样强化。肝细胞癌虽然可有中央瘢痕,但组成多为纤维组织、钙化、坏死等成分,因此T1WI和T2WI均为低信号,增强扫描瘢痕无显著强化;另外,肝细胞癌多有肝硬化背景,信号混杂不均。
不典型FNH的MRI表现有:病灶在T2WI上为高信号并伴有分层结构,中央瘢痕在T2WI上为低信号,呈现假包膜、不均匀性强化等。在这些情况下,使用特异性对比剂(如超顺磁性氧化铁)可显示病变的来源,为鉴别诊断提供帮助。如果病灶内呈均匀吸收氧化铁或锰粒子、血清甲胎蛋白不增高、血清肝炎病毒学检测为阴性,则患者可随访复查。如果仍有疑问,则应考虑做穿刺活检,以鉴别纤维板层肝癌、无肝硬化背景的肝细胞癌。
3.4 血管造影检查 典型FNH的血管造影表现为动脉血供异常丰富的结节,界限清楚,与恶性肿瘤(肝细胞癌、转移瘤等)的主要差别有:FNH的供血动脉分支粗细比较均一、实质期强化明显但密度均匀(除瘢痕结构外)、无血管湖、无动静脉瘘(肝动脉-门静脉瘘/肝动脉-肝静脉瘘)表现、无血管侵蚀或癌栓征象。
选择性肝动脉造影示FNH由1条或多条供血动脉由病灶中心向周围呈辐射状分布。有1/3的病例肝动脉造影有典型的表现,即动脉期可见肿块中央血管呈放射状走行,供血动脉多增粗,实质期病灶染色均匀,边界清楚,可见纤维分隔呈放射状排列(图1)。
4 FNH的治疗
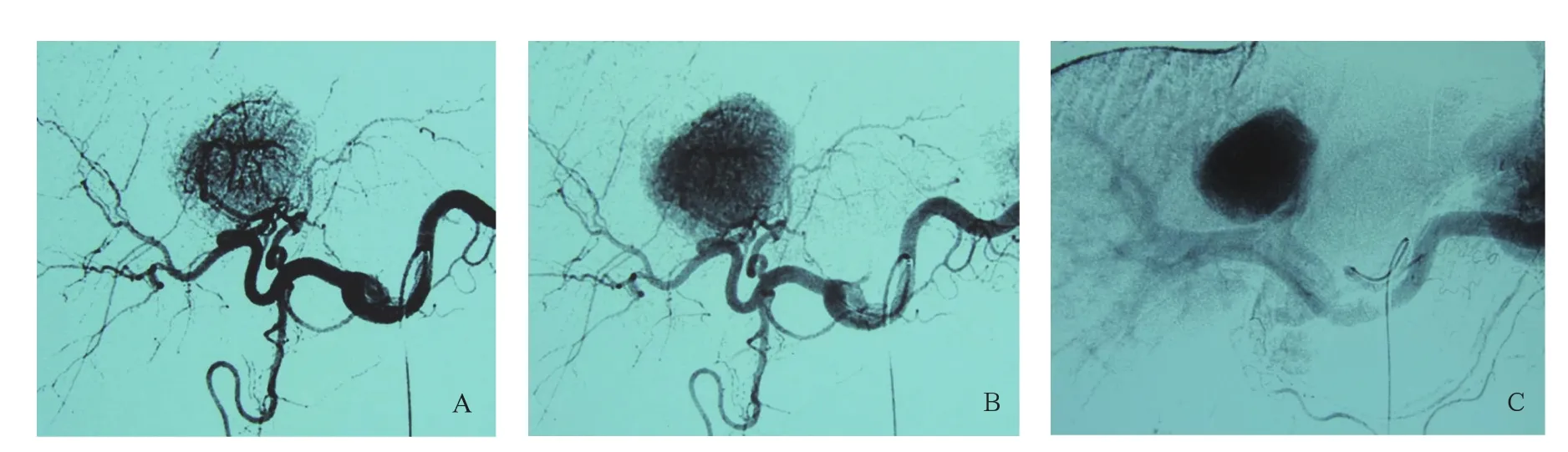
图1 FNH血管造影表现。A.选择性肝动脉造影动脉期显示供血动脉由病灶中心向周围呈辐射状分布;B.实质期病灶染色明显但密度均匀(除中央瘢痕结构外),界限清楚;C.静脉期门静脉显影清楚,无明显受压、侵蚀征象
对影像学表现典型或者明确诊断的无症状FNH患者,可定期随诊复查,无需干预治疗。对有压迫症状、病灶有明确增长趋势者可以考虑治疗。外科切除手术或者腹腔镜下切除术曾是治疗FNH的首选方法[15]。近年,血管内介入治疗——经导管选择性动脉栓塞术已经成为治疗肝脏良性血管性疾病(血管畸形、血管瘤等)的首选方法,经导管选择性动脉栓塞术对FNH亦能获得治愈效果,对病灶直径大于5cm、有压迫或其他相关症状、随访中增长较快者,可选择经导管选择性动脉栓塞术[16-18]。
5 结束语
典型FNH由异常肝细胞结节、异常血管结构及增生的小胆管组成。非典型FNH包含上述3种结构中的2种成分,但其中均包括小胆管增生。FNH的典型血管构型包括:1支或多支管壁增厚的肝动脉分支穿行于纤维间隔内,由其发出许多微小分支供应肝窦;由较大的静脉肝窦血液引流至肝静脉。大多数FNH可用影像学检查确诊、无需做有创性检查(活检)。典型FNH可间隔6~12个月复查,不典型者需要用特异性对比剂做增强扫描或超声引导下穿刺活检。大多数FNH无需治疗,对于有压迫症状、病灶有明确增长趋势者可以考虑治疗,首选经导管选择性动脉栓塞术。
[1] Edmondson HA. Tumors of the liver and intrahepatic bile ducts: atlas of tumors pathology. Washington DC: Armed Forces Institute of Pathology, 1958: 24-28.
[2] International Working Party. Terminology of nodular hepatocellular lesions. Hepatology, 1995, 22: 983-993.
[3] Wanless IR, Sapp H, Guindi M, et al. The pathogenesis of focal nodular hyperplasia: an hypothesis based on histologic review of 20 lesions including 3 occurring in early biliary cirrhosis. Hepatology, 2006, 44(4): 491A.
[4] Vilgrain V. Focal nodular hyperplasia. Eur J Radiol, 2006, 58(2): 236-245.
[5] Nguyen BN, Flejou JF, Terris B, et al. Focal nodular hyperplasia of the liver: a comprehensive pathologic study of 305 lesions and recognition of new histologic forms. Am J Surg Pathol, 1999, 23(12): 1441-1454.
[6] Sato Y, Harada K, Ikeda H, et al. Hepatic stellate cells are activated around central scars of focal nodular hyperplasia of the liver—a potential mechanism of central scar formation. Hum Pathol, 2009, 40(2): 181-188.
[7] Shanbhogue AK, Prasad SR, Takahashi N, et al. Recent advances in cytogenetics and molecular biology of adult hepatocellular tumors: implications for imaging and management. Radiology, 2011, 258(3): 673-693.
[8] Rebouissou S, Bioulac-Sage P, Zucman-Rossi J. Molecular pathogenesis of focal nodular hyperplasia and hepatocellular adenoma. J Hepatol, 2008, 48(1): 163-170.
[9] Wasif N, Sasu S, Conway WC, et al. Focal nodular hyperplasia: report of an unusual case and review of the literature. Am Surg, 2008, 74(11): 1100-1103.
[10] Hussain SM, Terkivatan T, Zondervan PE, et al. Focal nodular hyperplasia: findings at state-of-the-art MR imaging, US, CT, and pathologic analysis. Radiographics, 2004, 24(1): 3-17.
[11] Carlson SK, Johnson CD, Bender CE, et al. CT of focal nodular hyperplasia of the liver. Am J Roentgenol, 2000, 174(3): 705-712.
[12] Mortelé KJ, Praet M, Van Vlierberghe H, et al. CT and MR imaging fndings in focal nodular hyperplasia of the liver: radiologic-pathologic correlation. Am J Roentgenol, 2000, 175(3): 687-692.
[13] Zech CJ, Grazioli L, Breuer J, et al. Diagnostic performance and description of morphological features of focal nodular hyperplasia in Gd-EOB-DTPA-enhanced liver magnetic resonance imaging: results of a multicenter trial. Invest Radiol, 2008,43(7): 504-511.
[14] 杜静波, 张爱莲, 叶慧义, 等. MRI诊断肝脏多发局灶结节性增生的价值. 中国医学影像学杂志, 2008, 16(6): 443-446.
[15] Bonney GK, Gomez D, Al-Mukhtar A, et al. Indication for treatment and long-term outcome of focal nodular hyperplasia. HPB (Oxford), 2007, 9(5): 368-372.
[16] Vogl TJ, Own A, Hammerstingl R, et al. Transarterial embolizationas atherapeutic option for focal nodular hyperplasia in four patients. Eur Radiol, 2006, 16(3): 670-675.
[17] Amesur N, Hammond JS, Zajko AB, et al. Management of unresectable symptomatic focal nodular hyperplasia with arterial embolization. J Vasc Interv Radiol, 2009, 20(4): 543-547.
[18] Gussick SD, Quebbeman EJ, Rilling WS. Bland embolization of telangiectatic subtype of hepatic focal nodular hyperplasia. J Vasc Interv Radiol, 2005, 16(11): 1535-1538.
2011-09-08
2012-06-08
(责任编辑 张春辉)
10.3969/j.issn.1005-5185.2012.08.023
解放军总医院介入放射科 北京 100853
王茂强 E-mail: wangmq@vip.sina.com

