海藻酸钠微球联合碘化油栓塞治疗原发性肝癌的疗效分析
孙 伟SUN Wei
王永涛2WANG Yongtao
史仲华1SHI Zhonghua
李忱瑞1LI Chenrui
作者单位
1. 中国医学科学院肿瘤医院北京协和医学院影像诊断科 北京 100021
2. 淄博市临淄区人民医院肿瘤科 山东淄博 255400
论著 Original Research
海藻酸钠微球联合碘化油栓塞治疗原发性肝癌的疗效分析
孙 伟1SUN Wei
王永涛2WANG Yongtao
史仲华1SHI Zhonghua
李忱瑞1LI Chenrui
作者单位
1. 中国医学科学院肿瘤医院北京协和医学院影像诊断科 北京 100021
2. 淄博市临淄区人民医院肿瘤科 山东淄博 255400
Department of Diagnostic Radiology, Cancer Hospital, Chinese Academy of Medical Sciences, Peking Union Medical College, Beijing 100021, China
Address Correspondence to: LI Chenrui E-mail: lcr0009@163.com
中国图书资料分类法分类号
R735.7;R730.49
中国医学影像学杂志
2012年 第20卷 第8期:631-634
Chinese Journal of Medical Imaging 2012 Volume 20(8): 631-634
目的 探讨海藻酸钠微球(KMG)作为栓塞剂,联合经导管肝动脉化疗栓塞术(TACE)治疗原发性肝癌的应用价值。资料与方法 2008-01~2010-03行介入治疗并经病理或实验室检查确诊的206例原发性肝癌患者,按治疗方法分为对照组和KMG组,其中对照组128例接受常规TACE治疗,KMG组78例接受常规TACE治疗+KMG栓塞,比较两组患者介入治疗后肿瘤缩小及坏死程度以及术后3个月、6个月、9个月、1年的累计生存率。结果 对照组和KMG组之间的临床和病理资料差异无统计学意义(P>0.05)。206例患者中60例病变缩小30%以上,其中KMG组36例,对照组24例,两组差异有统计学意义(χ2=4.107, P<0.05)。KMG组患者治疗3个月、6个月累计生存率分别为96.1%和92.3%,而对照组分别为89.8%和87.5%,两组累计生存率差异无统计学意义(P>0.05);KMG组患者治疗9个月、1年累计生存率分别为89.7%和80.8%,而对照组分别为73.4%和57.8%,两组累计生存率差异有统计学意义(P<0.05)。结论 海藻酸钠微球联合TACE栓塞治疗原发性肝癌能够增强血管栓塞效应,提高生存率,可作为肝癌介入治疗的新选择。
肝肿瘤;藻酸盐;微球体;碘化油;化学栓塞,治疗性
原发性肝癌(hepatocellular carcinoma, HCC)发病率占我国恶性肿瘤第3位。目前,中晚期肝癌首选治疗方法是经导管肝动脉化疗栓塞术(transcatheter hepatic artery chemoembolization, TACE),其在延长患者生存期方面发挥重要作用,但其治疗效果与血管栓塞剂的选择密切相关[1-3]。海藻酸钠微球(kelp microgelation, KMG)作为新型栓塞剂可提高肿瘤疗效[4,5]。本研究拟采用TACE联合KMG和碘化油治疗原发性肝癌,并与传统TACE治疗进行比较,以探讨KMG的临床应用价值。
1 资料与方法
1.1 研究对象 收集2008-01~2010-03肿瘤医院收治的206例原发性肝癌患者,年龄30~75岁,中位年龄57.5岁,均行TACE。所有患者均签署知情同意书。纳入标准:经CT或MR检查发现肝内病灶,穿刺活检或临床和实验室检查诊断为肝癌;无肺转移及其他肝外转移;治疗前检查无介入手术禁忌证;无TACE治疗史;肝功能Child-Pugh分级A级或B级,无腹水、出血,肿瘤灶≤3个;全部完成所需治疗后复查;初次治疗后12个月随诊结束。206例患者按是否联合KMG栓塞治疗分成对照组(n=128)和KMG组(n=78),分别接受化疗药物灌注+碘化油栓塞及化疗药物灌注+碘化油栓塞+KMG栓塞。
1.2 方法 采用Seldinger技术经股动脉插管,超选至靶血管。对照组经导管灌注化疗药物(吡喃阿霉素或羟基喜树碱20~30mg)和碘化油,KMG组先常规经导管灌注化疗药物,再加用少量碘化油栓塞部分肿瘤毛细血管,最后补充KMG栓塞剩余毛细血管及末梢小动脉。治疗后造影确定肿瘤染色消失。
KMG的使用方法:选择直径为100~300μm或150~450μm的微球,以200ml生理盐水分3次漂洗去除KMG表面的固定液后,再加入10ml生理盐水及适量造影剂,制成混悬液,在透视下进行缓慢栓塞。
1.3 术后处理及随访 介入治疗后常规给予保肝、预防性抗感染治疗,有不良反应者给予对症处理,本组均无严重并发症。术后1~1.5个月复查CT或MRI平扫及增强检查,评价治疗效果。随访日期截止至2011-03-31。
1.4 统计学方法 采用SPSS 13.0软件,计数资料比较采用χ2检验,各组累计生存率采用Kaplan-Meier曲线,并利用log-rank检验各组生存率曲线分布是否相同,P<0.05表示差异有统计学意义。
2 结果
2.1 两组基本资料比较 KMG组与对照组患者性别构成、肝功能分级、肿瘤大小、有无子灶、有无门脉瘤栓之间差异均无统计学意义(P>0.05),两组资料具有可比性(表1)。
2.2 两组治疗前后肿瘤大小变化 治疗后1~1.5个月,60例患者肿瘤缩小≥30%(图1),其中对照组24例(18.8%),KMG组36例(46.2%)。两组比较,差异有统计学意义(χ2=4.107, P<0.05)。

表1 KMG组与对照组患者基本资料比较
2.3 两组术后生存率比较 至随访结束时,69例死亡,137例存活,死亡原因包括肿瘤进展和转移、与肝病相关的并发症。KMG组患者治疗3个月、6个月累计生存率分别为96.1%和92.3%,而对照组分别为89.8%和87.5%,两组累计生存率差异无统计学意义(P>0.05);KMG组患者治疗9个月、1年累计生存率分别为89.7%和80.8%,而对照组分别为73.4%和57.8%,两组累计生存率差异有统计学意义(χ2=11.102, P<0.05),KMG组9个月与1年累计生存率优于对照组,见图2。
3 讨论
TACE在中晚期肝癌治疗中应用广泛,目前短期疗效显著,而中长期疗效差。多数学者认为多支供血、栓塞不完全及术后侧支循环形成等导致肿瘤不能完全坏死,完全坏死率仅为5%,造成复发[6]。鉴于此,术中栓塞完全、防止或降低侧支循环的形成是提高单次介入疗效的直接方法。肝动脉的末梢栓塞能有效防止肿瘤供血的侧支循环形成,血流阻断相对完全和持久,防止肝内动脉循环的重建[7,8]。因此,能够完全充填不同直径的血管管腔且降解时间较长的栓塞剂最适宜于栓塞治疗[9]。
KMG是一种新型的末梢血管栓塞剂,直径100~300μm或150~450μm的微球可以栓塞至肝动脉末梢小动脉水平,其栓塞后不会产生潜在侧支循环血管两端的压力差,不易形成继发性侧支循环;并且即使堵塞在较大管径血管内的微球,经自身降解及血流冲击作用,可迁移到更细小的分支内;直径合适的微球还可以阻断肿瘤周边的动静脉瘘,从而提高TACE的疗效[10]。另外,KMG在人体内降解时间为3~6个月,既防止了肿瘤血管很快再通,又防止侧支循环的出现,可更长久地阻断靶血管[11]。KMG与碘化油、抗癌药物混合使用具有协同作用,即碘化油进入肿瘤细胞内外,KMG位于末梢小动脉,阻断肿瘤细胞的营养供血,使肿瘤坏死,同时使碘化油能够持续存留,带药栓塞剂在切断肿瘤血管的同时,阻断血流对药物的冲刷作用,使药物在肿瘤组织内保持较高的浓度和较长的时间,可提高抗肿瘤药物的疗效,降低其全身毒副作用,具有化疗与栓塞双重作用[12]。

图1 海藻酸钠微球栓塞治疗原发性肝癌前后CT及数字减影血管造影(DSA)表现。患者男,56岁,原发性肝癌。A、B.横断面增强CT示术前肝右叶低血供病变,边界欠清;C、D. DSA造影示肿瘤血管稀少,染色浅淡;E、F. KMG栓塞治疗1次后,DSA造影示肿瘤血管进一步减少;G~J. KMG栓塞治疗后6个月,CT示病变明显缩小,边界清楚,无明显强化(G、H);DSA造影未见明确肿瘤染色(I、J)
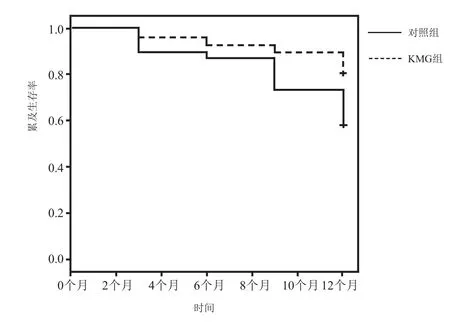
图2 原发性肝癌患者生存曲线
本研究联合应用碘化油和KMG,首先利用碘化油流动性好的特性,栓塞肿瘤部分毛细血管,再联合应用KMG,栓塞剩余毛细血管及末梢小动脉,利用KMG生物相容性好、降解时间长的特点,使肿瘤靶血管血流中断时间加长,减少血流对碘化油的冲刷作用,阻塞更彻底。本研究证实,KMG组复查肿瘤大小、坏死范围的测定,以及治疗后患者9个月、1年累计生存率均优于传统碘化油栓塞剂的治疗效果,表明KMG作为一种新型的栓塞剂,有望改善不能手术治疗的原发性肝癌患者的生存预后。同时,因KMG降解时间长,提高单次TACE治疗效果,使得TACE治疗间隔延长,最大程度地保护了患者的肝功能,又减轻了其经济负担。在复查过程中还发现,KMG组肿瘤坏死明显,血管造影显示肿瘤供血血管分支减少,即使血供不太丰富的肿瘤,栓塞治疗后也有较好的治疗效果。这可能与KMG具有较好的血管管腔适形能力的特性有关,能够在细小动脉水平上最大限度地阻断肿瘤供血血管。
总之,KMG作为一种新型的栓塞剂,其联合碘化油栓塞治疗肝癌的疗效明显优于单纯应用碘化油的栓塞治疗[13],能够减少碘化油的流失,增强栓塞血管的效应,使肿瘤坏死更彻底,提高原发性肝癌患者的TACE治疗效果,可以延长患者的生存时间,在肝癌的TACE中具有良好的应用前景。
[1] Choi JW, Park JY, Ahn SH, et al. Efficacy and safety of transarterial chemoembolization in recurrent hepatocellular carcinoma after curative surgical resection. Am J Clin Oncol, 2009, 32(6): 564-569.
[2] Zhong C, Guo RP, Li JQ, et al. A randomized controlled trial of hepatectomy with adjuvant transcatheter arterial chemoembolization versus hepatectomy alone for stageⅢA hepatocellular carcinoma. J Cancer Res Clin Oncol, 2009, 135(10): 1437-1445.
[3] Molinari M, Kachura JR, Dixon E, et al. Transarterial chemoembolisation for advanced hepatocellular carcinoma: results from a North American cancer centre. Clin Oncol, 2006, 18(9): 684-692.
[4] 刘兆玉, 单明, 卢再鸣, 等. 海藻酸钠微球颗粒子宫动脉栓塞治疗子宫肌瘤的疗效分析.中国临床医学影像杂志, 2006, 17(1): 12-14.
[5] 孙伟, 周纯武, 李忱瑞. 海藻酸钠微球栓塞剂在肿瘤治疗中的应用现状. 癌症进展, 2009, 7(1): 52-55.
[6] 樊代明, 韩国宏, 孟祥杰. 提高肝癌介入治疗的疗效. 中华消化杂志, 2006, 26(5): 289-290.
[7] 吴汉平, 冯敢生. 肝癌介入治疗的现状与展望. 临床放射学杂志, 2005, 24(3): 273-276.
[8] Doppman JL, Girton M, Kahn R. Proximal versus peripheral hepatica artery embolization experimentalstudy in monkeys. Radiology, 1978, 128(3): 577-588.
[9] Gomes AS, Rosove MH, Rosen PJ, et al. Triple drug transcatheter arterial chemoembolization in unresectable hepatocellular carcinoma: assessment of survival in 124 consecutive patients. Am J Roentgenol, 2009, 193(6): 1665-1671.
[10] 徐克, 于世平. 原发性肝癌的肝动脉化疗栓塞治疗. 中国实用外科杂志, 2004, 24(8): 463-465.
[11] Nitta N, Ohta S, Tanaka T, et al. Gelatin microspheres: initial clinical experience for the transcatheter arterial embolization. Eur J Radiol, 2008, 67(3): 536-540.
[12] Eroglu M, Kursaklioglu H, Misirli Y, et al. Chitosancoated alginate microspheres for embolization and/or chemoembolization: in vivo studies. J Microencapsul, 2006, 23(4): 367-376.
[13] 杨建东, 孔曼, 黄希芬, 等. 应用海藻酸钠微球联合碘化油经导管肝动脉化疗栓塞治疗肝癌. 中国介入影像与治疗学, 2010, 7(3): 225-227.
(责任编辑 张春辉)
Efficacy of Kelp Micro Gelation Combined with Lipiodol in the Treatment of Hepatocellular Carcinoma
Purpose To analyze the value of kelp micro gelation (KMG) combined with transcatheter hepatic artery chemoembolization (TACE) in the treatment of hepatocellular carcinoma (HCC).Materials and Methods 206 patients with HCC confrmed by pathology or laboratory tests and underwent TACE were divided into KMG group (n=78, TACE+KMG) and control group (n=128, TACE only). The changes in tumor size, necrosis and the cumulative survival rates in 3 months, 6 months, 9 months and 1 year after surgery were compared.Results There was no significant difference between control group and KMG group in clinical and pathological data (P>0.05). 60 of 206 tumors shrank more than 30%, in which 36 cases were in KMG group and 24 in control group, and tumor volume reduced greater in the KMG group (χ2=4.107, P<0.05). The cumulative survival rates in 3 months and 6 months were 96.1% and 92.3%, respectively in KMG group, 89.8% and 87.5% respectively in control group. There was no signifcant difference between KMG group and control group (P>0.05). The cumulative survival rates of KMG group in 9 months and 1 year were 89.7% and 80.8%, respectively, and those of control group were 73.4% and 57.8% respectively. There were signifcant differences between KMG group and control group (P< 0.05).Conclusion KMG combined with lipiodol in embolization therapy of HCC can enhance the effect of vascular thrombosis, and increase survival. KMG can be used as a new option of TACE.
Liver neoplasms; Alginates; Microspheres; Iodized oil; Chemoembolization, therapeutic
李忱瑞
2012-03-23
10.3969/j.issn.1005-5185.2012.08.022
2012-04-18

