高频超声评价颈动脉管壁形态对冠心病的预测价值
杨毓雯 YANG Yuwen
李沿江 LI Yanjiang
谢 天 XIE Tian
作者单位
南昌大学第二附属医院超声诊断科 江西
南昌 330006
论著 Original Research
高频超声评价颈动脉管壁形态对冠心病的预测价值
杨毓雯 YANG Yuwen
李沿江 LI Yanjiang
谢 天 XIE Tian
作者单位
南昌大学第二附属医院超声诊断科 江西
南昌 330006
Department of Medical Ultrasound, the Second Affliated Hospital of Nanchang University, Nanchang 330006, China
Address Correspondence to: LI Yanjiang E-mail: liyj-2000@163.com
中国图书资料分类法分类号
R541.4;R445.1
中国医学影像学杂志
2012年 第20卷 第8期:607-610
Chinese Journal of Medical Imaging 2012 Volume 20(8): 607-610
目的 应用高频超声观察临床疑诊为冠心病患者的颈动脉管壁形态,探讨其对冠状动脉病变的预测价值。资料与方法 191例疑诊为冠心病的住院患者行冠状动脉造影及颈动脉超声检查,根据颈动脉管壁形态分为颈动脉正常组、内-中膜增厚(IMT≥1.0mm)组、稳定性斑块组及不稳定斑块组,比较4组冠心病患病率,并评估颈动脉管壁形态对冠心病的预测价值及在冠心病危险因素中的作用。结果 4组冠心病患病率依次递增,组间比较,差异有统计学意义(P<0.01)。颈动脉管壁形态与冠心病呈正相关(r=0.404, P<0.01)。IMT≥1.0mm、稳定性斑块及不稳定斑块是冠心病患病的独立危险因子(P<0.01),三者对冠心病的阳性预测值分别为42.86%、61.76%、73.68%。结论 应用高频超声观察颈动脉管壁形态对冠心病有一定的预测价值。
超声检查,多普勒,彩色;颈动脉;动脉粥样硬化;冠心病
颈动脉粥样硬化与冠心病之间存在一定的相关性,内-中膜厚度(IMT)和斑块是评价颈动脉粥样硬化的主要超声指标,也是冠心病的独立预测因子[1,2]。然而,颈动脉粥样硬化病变的外在表现主要体现在其管壁形态的改变,但从颈动脉管壁形态特点的角度探讨颈动脉粥样硬化对冠心病的预测价值的研究较少。本研究旨在通过应用高频超声观察191例临床疑诊为冠心病患者的颈动脉管壁形态,探讨其对冠状动脉病变的预测价值。
1 资料与方法
1.1 研究对象 2010-01~06,南昌大学第二附属医院心血管内科疑诊为冠心病的191例住院患者,男135例,女56例;年龄37~85岁,平均(64.10±10.13)岁。排除标准:①既往有脑血管病意外或外周血管疾病史;②心脏瓣膜疾病;③免疫系统疾病;④正在服用降脂类药物等。
1.2 冠状动脉造影 经皮桡动脉或股动脉穿刺,采用Judkins法[3]对冠状动脉进行多体位投照,观察左主干、左前降支、回旋支以及右冠状动脉的病变情况。以至少1支冠状动脉主要分支内径狭窄≥50%定义为冠心病[4]。按照冠状动脉造影结果,将患者分为非冠心病组和冠心病组。
1.3 颈动脉超声检查 于冠状动脉造影术前或术后1周内行颈动脉超声检查。采用Philips HDI sonoCT 5000、Siemens Sequoia 512型彩色多普勒超声诊断仪,线阵探头,频率5~12MHz。受检者取仰卧位,头略向后仰,充分暴露颈部。从颈根部开始,按长轴和短轴两个方向依次显示颈总动脉(CCA)、颈总动脉分叉处(BIF)、颈内动脉(ICA)和颈外动脉(ECA)的形态结构。于颈总动脉分叉近心端1cm后壁处测量IMT(图1)。如有检出颈动脉斑块,则放弃测量该受检者的IMT,直接观察斑块的位置、大小、回声。IMT≥1.0mm定义为增厚,局部IMT≥1.5mm定义为斑块[5]。通过比较斑块与管壁回声强度将斑块分成3类:软斑,斑块回声低于管壁回声(低回声);硬斑,斑块回声接近管壁回声(等回声)或强于管壁回声(高回声);混合斑块,斑块内既有高回声又有低回声[6]。软斑和混合斑块归为不稳定斑块(图2),硬斑归为稳定性斑块(图3)。根据超声检查得到颈动脉管壁形态结果分为4组:颈动脉正常组(IMT<1.0mm,未检出斑块),内-中膜增厚组(IMT≥1.0mm,未检出斑块),稳定性斑块组,不稳定斑块组。若受检者同时检出稳定性斑块和不稳定斑块,则归入不稳定斑块组。
1.4 统计学方法 采用SPSS 13.0软件,计量资料数据以±s 表示,采用t检验;率的比较采用χ2检验;颈动脉管壁形态与冠心病的相关性采用Spearman相关分析;采用Logistic多元回归分析冠心病患病危险因素的危险程度,P<0.05表示差异有统计学意义。

图1 内-中膜厚度的超声声像图测量(箭)。图2 不稳定斑块(十字)的超声声像图。图3 稳定性斑块(箭)的超声声像图
2 结果
2.1 非冠心病组与冠心病组基础资料比较 非冠心病组与冠心病组性别比(男/女)、高血压病史、糖尿病病史、总胆固醇、三酰甘油、高密度脂蛋白、低密度脂蛋白比较,差异均无统计学意义(P>0.05);冠心病组年龄较非冠心病组大,差异有统计学意义(P<0.05)。见表1。
2.2 颈动脉管壁形态与冠心病的相关性 不同颈动脉管壁形态4组间冠心病患病率差异有统计学意义(χ2=32.378, P<0.01),见表2。颈动脉管壁形态与冠心病间呈正相关(r=0.404, P<0.01)。
2.3 颈动脉管壁形态对冠心病的预测价值 不同颈动脉管壁形态预测冠心病的敏感度、阳性预测值,在IMT≥1.0mm、稳定性斑块、不稳定斑块3种管壁形态中依次递增。见表3。
2.4 冠心病主要危险因素分析 IMT≥1.0mm、稳定性斑块、不稳定斑块为冠心病最重要的3个危险因素。冠心病主要危险因素的Logistic多元回归分析见表4。

表1 非冠心病组与冠心病组基础资料比较

表2 颈动脉不同管壁形态组间冠心病患病率比较 [n(%)]

表3 颈动脉不同管壁形态对冠心病的预测价值(%)
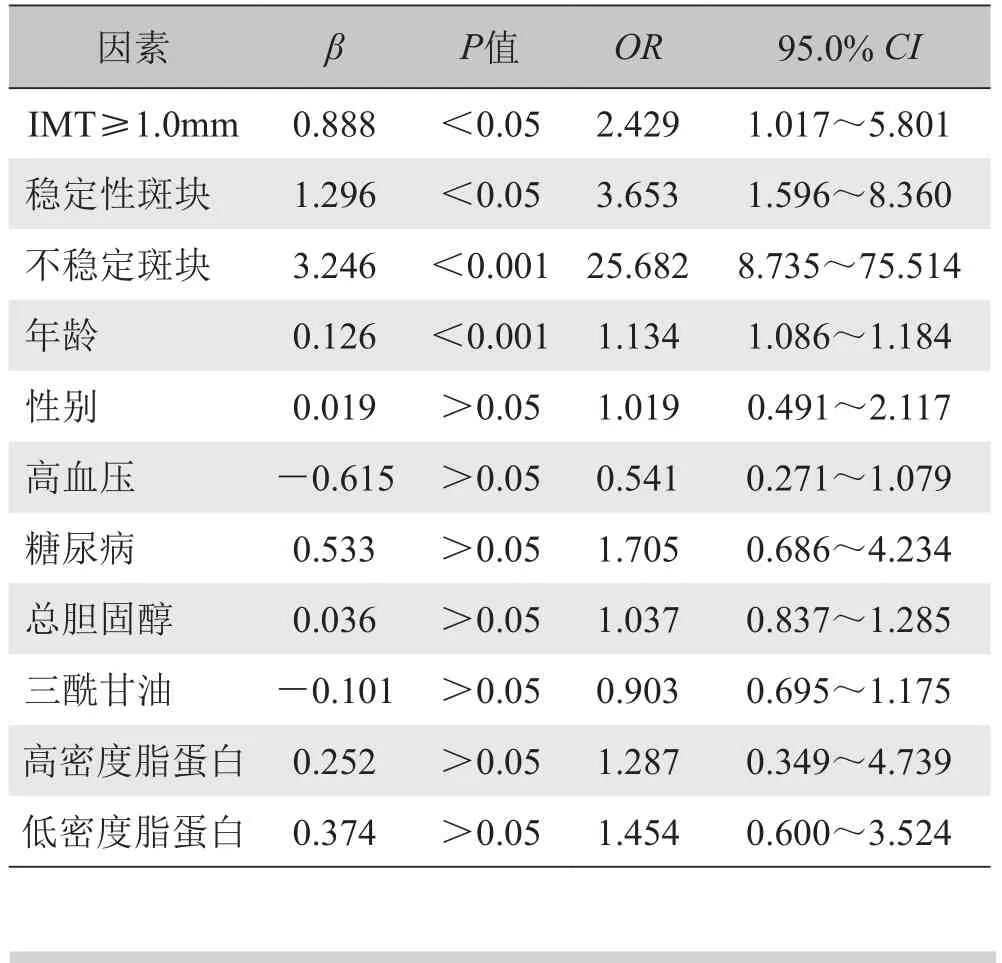
表4 冠心病主要危险因素Logistic多元回归分析
3 讨论
3.1 颈动脉粥样硬化与冠状动脉粥样硬化的关系 动脉粥样硬化是一种系统性疾病,主要累及大中动脉,基本病变为动脉内膜的脂质沉积、灶状纤维化和斑块形成。因此,动脉粥样硬化早期表现为IMT增厚,继而形成斑块,严重者可导致管腔狭窄。颈动脉粥样硬化与冠状动脉粥样硬化具有相同的病理基础[7]。而颈动脉位置表浅,易于探测,是反映冠状动脉粥样硬化的理想窗口。
3.2 颈动脉IMT厚度与冠心病患病的关系 IMT增厚与冠心病患病关系密切[1,2]。 Chamberless等[1]对12 841名45~64岁受检者(男5552名,女7289名)的颈动脉IMT进行测量并随访约4~7年,结果发现,290名受检者(其中女96名,男194名)发生了冠心病事件;并且随IMT增厚,冠心病患病率呈上升趋势。Lorenz等[8]的Meta分析显示,IMT每增加0.1mm,未来发生心肌梗死的危险性增加10%~15%,故认为颈动脉IMT能较好地预测未来发生心肌梗死的危险性。本研究中,与颈动脉正常组相比,内-中膜增厚组的冠心病患病率明显增高[(8/31)对(18/24), P<0.01]。IMT≥1.0mm对冠心病的阳性预测值为42.86%,特异性为72.72%。在Logistic回归模型中,IMT≥1.0mm的OR值为2.429 (95% CI 1.017~5. 801)(P<0.05),可见颈动脉IMT是早期间接反映冠状动脉粥样硬化进程的有效指标,通过超声测量颈动脉IMT有助于及早识别高危人群。
3.3 颈动脉斑块的稳定性与冠心病患病的关系 本研究中,2个斑块组冠心病患病率较高。稳定性斑块和不稳定斑块对冠心病的阳性预测值分别为61.76%和73.68%。Logistic回归显示,不稳定斑块的OR值比稳定性斑块大[25.682 (95% CI 8.735~75.514) (P<0.001)]对[3.653 (95% CI 1.596~8.360) (P<0.01)],说明稳定性斑块和不稳定斑块均为冠心病患病的危险因子,并对冠心病有一定的预测价值。此外,较之稳定性斑块,不稳定斑块与冠心病患病的联系更加密切,提示斑块稳定性与心血管事件紧密相关。影响斑块稳定性的主要因素有:斑块内脂质成分的含量、新生血管以及炎症反应等[9-12]。在二维超声中,不稳定斑块的回声类型主要为低回声和混合回声。低回声主要反映斑块内脂质成分的含量;混合回声则提示斑块成分复杂,可能由斑块内出血、脂类及钙化等多种成分构成[10]。脂质核心内富含胆固醇和胆固醇酯,质地较软,不仅自身承受压力的能力较低,还将不能承受的力量传递给附近的纤维帽,使纤维帽承受的压力增大,容易导致部分纤维帽较薄的斑块发生破裂[12]。55%~60%的急性冠脉综合征是由于冠状动脉斑块破裂所致,30%~35%的患者由于斑块表面溃疡并继发血栓形成,且大部分病变并不伴血管腔明显狭窄[12]。此外,黄品同等[13]通过超声造影技术证实了斑块回声特征与斑块内新生血管之间的联系,结果提示,软斑的新生血管检出率明显高于硬斑,但与混合斑比较差异无统计学意义,说明在一定程度上通过判断斑块回声能较准确地了解其内新生血管的含量。同时,新生血管仅由内皮细胞组成,没有基底膜,且周围缺乏支撑的结缔组织和平滑肌,故血管脆性大,容易破裂引起斑块内出血,继而引起局部炎症反应[9,11]。此外,因新生血管的通透性大,还可成为炎症细胞和脂质进入斑块的重要通道。炎症细胞可分泌蛋白酶或胶原酶,降解纤维帽,导致斑块溃疡、破裂。脂质可在纤维帽下继续沉积,进一步加重动脉粥样硬化的程度。由此可见,当检出颈动脉斑块时,应注意结合斑块声像特征初步评价其稳定性,并进一步预测冠心病的患病风险。
3.4 不同颈动脉管壁形态预示冠心病患病的危险性本研究提示,颈动脉管壁形态与冠心病之间呈正相关(r=0.404, P<0.01),Logistic回归OR值反映冠心病患病危险程度由大到小依次为:不稳定斑块>稳定性斑块>IMT增厚,与研究[14,15]结果基本一致。Cicorella等[14]回顾性分析了1337名患者的临床资料,建立了筛选冠心病危险因素的Logistic模型,结果显示,反映颈动脉粥样硬化的超声指标在该模型中的OR值依次为:内-中膜增厚(IMT≥0.9mm)[2.28 (95% CI 1.8~2.9) (P<0.0001)]<不稳定斑块[3.6 (95% CI 2.3~5.7) (P<0.001)]<颈动脉严重狭窄(≥70%)[4.2 (95% CI 2.0~8.7) (P<0.0001)]。由此可见,在预测冠心病的患病风险方面,IMT和斑块的作用有所差别。Finn等[16]认为这一差别可能与其各自的病理学特点有关。影响IMT的主要因素是年龄和高血压;但在动脉粥样硬化进程中,这些因素并未占主导作用。即使未受到其他动脉粥样硬化因素的影响,IMT亦随年龄增长而增厚。斑块的出现反映了动脉内膜的病理性增厚,是揭示动脉粥样硬化进程的重要标志,是较IMT更具代表意义的评估心血管风险的指标。因此,对疑诊冠心病患者行颈动脉超声检查时,应酌情考虑IMT和斑块所预示的患病危险性不同,可能有助于做好危险因素的分层,进行疾病预防。
综上所述,通过超声观察颈动脉管壁形态(测量颈动脉IMT及评价斑块性质),并利用IMT和斑块进行危险分层,能较好地预测冠心病。因此,对疑诊冠心病患者常规行颈动脉超声检查,可对临床早期干预提供有价值的参考信息,有助于改善预后。
[1] Chamberless LE, Heiss G, Folsom AR, et al. Association of coronary heart disease incidence with carotid arterial wall thickness and major risk factors: the Atherosclerosis Risk in Communities (ARIC) study 1987-1993. Am J Epidemiol, 1997,146(6): 483-494.
[2] Lorenz MW, von Kegler S, Steinmetz H, et al. Carotid intima-media thickening indicates a higher vascular urisk across a wide age range: prospective data from the Carotid Atherosclerosis Progression Study (CAPS). Stroke, 2006, 37(1): 87-92.
[3] Judkins MP, Abrams HL, Bristow JD, et al. Report of the inter-society commission for heart disease resources. Optimal resources for examination of the chest and cardiovascular system. A hospital planning and resource guideline. radiologic facilities for conventional x-ray examination of the heart and lungs. Catheterizationangiographic laboratories. Radiologic resources for cardiovascular surgical operating rooms and intensive care units. Circulation, 1976, 53(2): A1-A37.
[4] Wang Q, Zeng Y, Wang Y, et al. Comparison of carotid arterial morphology and plaque composition between patients with acute coronary syndrome and stable coronary artery disease: a high-resolution magnetic resonance imaging study. Int J Cardiovasc Imaging, 2011, 27(5): 715-726.
[5] 中国医师协会超声医师分会.血管超声检查指南.中华超声影像学杂志, 2009, 18(10): 911-920.
[6] Widder B, Paulat K, Hackspacher J, et al. Morphological characterization of carotid artery stenoses by ultrasound duplex scanning. Ultrasound Med Biol, 1990, 16(4): 349-354.
[7] Mancini GB, Dahlöf B, Díez J. Surrogate markers for cardiovascular disease structural markers. Circulation, 2004, 109(25 Suppl 1): IV22-IV30.
[8] Lorenz MW, Markus HS, Bots ML, et al. Prediction of clinical cardiovascular events with carotid intimamedia thickness: a systematic review and meta-analysis. Circulation, 2007, 115(4): 459-467.
[9] Möhlenkamp S, Lehmann N, Moebus S, et al. Quantifcation of coronary atherosclerosis and infammation to predict coronary events and all-cause mortality. J Am Coll Cardiol, 2011, 57(13): 1455-1464.
[10] Zwiebel WJ, Pellerito JS. 血管超声经典教程. 第5版. 温朝阳, 译. 北京:人民军医出版社, 2008: 96-98.
[11] Virmani R, Kolodgie FD, Burke AP, et al. Atherosclerotic plaque progression and vulnerability to rupture: angiogenesis as a source of intraplaque hemorrhage. Arterioscler Thromb Vasc Biol, 2005, 25(10): 2054-2061.
[12] Virmani R, Burke AP, Farb A, et al. Pathology of the vulnerable plaque. J Am Coll Cardiol, 2006, 47(8 Suppl): C13- C18.
[13] 黄品同, 田新桥, 孙海燕, 等. 不同类型颈动脉斑块与新生血管关系的超声造影研究. 中华超声影像学杂志, 2008, 17(2): 117-119.
[14] Cicorella N, Zanolla L, Franceschini L, et al. Usefulness of ultrasonographic markers of carotid atherosclerosis (intimamedia thickness, unstable carotid plaques and severe carotid stenosis) for predicting presence and extent of coronary artery disease. J Cardiovasc Med, 2009, 10(12): 906-912.
[15] Inaba Y, Chen JA, Bergmann SR. Carotid plaque, compared with carotid intima-media thickness, more accurately predicts coronary artery disease events: a meta-analysis. Atherosclerosis, 2012, 220(1): 128-133.
[16] Finn AV, Kolodgie FD, Virmani R. Correlation between carotid intimal/medial thickness and atherosclerosis: a point of view from pathology. Arterioscler Thromb Vasc Biol, 2010, 30(2): 177-181.
(责任编辑 张春辉)
Value of Carotid Artery Wall Morphology Evaluated by High-frequency Ultrasound in Predicting Coronary Artery Disease
Purpose To observe the carotid artery wall morphology of patients with clinically suspected coronary artery disease (CAD) by using high-frequency ultrasound, and to investigate its value of predicting the lesions of CAD.Materials and Methods 191 hospitalized patients with suspected CAD underwent both coronary angiography and carotid ultrasound, and then further divided into normal group, increased intima-media thickness (IMT≥ 1.0 mm) group, stable plaque group and unstable plaque group according to the carotid artery wall morphology. The prevalence of CAD among four groups was compared. The value of carotid artery wall morphology for predicting CAD and the role of that in the risk factors of CAD were also evaluated.Results The prevalence of CAD was gradually increased with statistical difference among four groups (P< 0.01). The carotid artery wall morphology was positively correlated with the prevalence of CAD (r=0.404, P<0.01). IMT≥ 1.0 mm, stable and unstable plaque were independent risk factors of CAD (P<0.01), which showed a positive predictive value of 42.86%, 61.76% and 73.68%, respectively.Conclusion Carotid artery wall morphology has a certain predictive value for CAD by using high-frequency ultrasound.
Ultrasonography, Doppler, color; Carotid arteries; Atherosclerosis; Coronary disease
李沿江
2011-10-12
10.3969/j.issn.1005-5185.2012.08.014
2012-07-20

