菩人丹超微粉对2型糖尿病大鼠血糖和血脂的影响
张 垒,董志军,张铁民△
(1.承德医学院,河北承德 067000;2.承德医学院附属医院)
我国糖尿病(diabetes mellitus, DM)患者大多通过服用西药控制血糖(blood glucose,BG),但DM的发生发展是一个多因素、多环节、多途径的过程,单纯应用降BG的西药,即使严格控制血糖也不能完全阻止DM的进展,并且不能逆转DM的并发症。在糖尿病及其并发症治疗方面,人们期望治疗药物具有疗效显著、安全无毒副作用的特点。菩人丹超微粉(Purendan superfine powder,PRD)由苦瓜、人参、丹参、制首乌、葛根、水蛭组成,具有益气养阴清热、活血化瘀通络的功效,具有多靶位、多途径的治疗效应[1]。本研究采用链脲佐菌素(STZ)致2型糖尿病大鼠模型,探讨PRD对2型糖尿病大鼠血糖和血脂的影响,为临床防治DM提供新思路。
1 材料与方法
1.1 药物及试剂 PRD,中央民族大学中国少数民族医学研究院提供;STZ,美国Sigma公司;BG检测试剂盒,保定长城临床试剂有限公司;甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白(HDL-C)和低密度脂蛋白(LDL-C)检测试剂盒,浙江伊利康生物技术有限公司。
1.2 实验动物分组及处理 36只雄性Wistar大鼠随机分为3组,正常对照组、糖尿病模型组和PRD治疗组每组12只。糖尿病模型组、PRD治疗组大鼠均采用2%STZ(25mg/kg/d,3d)连续腹腔注射建立糖尿病动物模型,以血糖≥16.7mmol/L作为成模标准[2]。模型成功建立后,PRD治疗组大鼠给予PRD(1.8g超微粉/kg/d)灌胃,PRD用蒸馏水配制成浓度为0.25kg超微粉/L的混悬液,按0.72ml/100g灌胃,连续3个月。正常对照组及糖尿病模型组大鼠按0.72ml/100g灌胃蒸馏水,时间同PRD治疗组。
1.3 指标检测 各组大鼠禁食12h以上,4%水合氯醛腹腔注射麻醉,经内眦于眶后静脉丛采血,京立LD4-2A离心机3000r/min离心20min,收集血清,应用日立公司全自动临床生化分析仪采用葡萄糖氧化酶法检测BG,酶法检测TG、TC,直接法检测HDL-C和LDL-C。
2 结果
2.1 各组大鼠的BG 正常对照组大鼠的BG为(4.56±0.27)mmol/L,模型组大鼠的BG为(21.52±2.52)mmol/L,明显高于正常对照组大鼠(P<0.05);PRD治疗组大鼠的BG为(13.23±1.98)mmol/L,明显低于模型组大鼠(P<0.05)。
2.2 各组大鼠的血脂 与正常对照组比较,糖尿病模型组大鼠的TG、TC、LDL-C明显升高(P<0.05),HDL-C明显降低(P<0.05);与糖尿病模型组比较,PRD治疗组疗组大鼠的TG、TC、LDL-C明显降低(P<0.05),HDLC明显升高(P<0.05)。见附表。
附表 各组大鼠的血脂(±s,n=12,单位 :mmol/L)
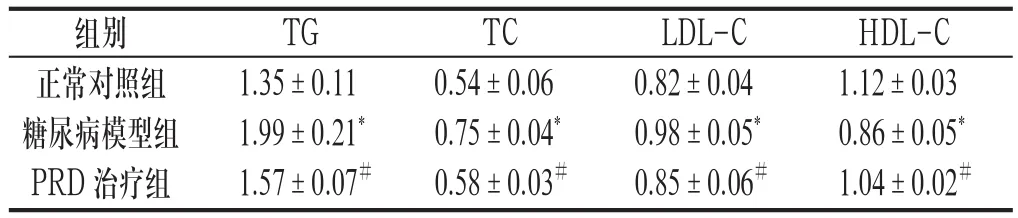
附表 各组大鼠的血脂(±s,n=12,单位 :mmol/L)
与正常对照组比较:*P<0.05,与模型组比较:#P<0.05
组别 TG TC LDL-C HDL-C正常对照组 1.35±0.11 0.54±0.06 0.82±0.04 1.12±0.03糖尿病模型组 1.99±0.21* 0.75±0.04* 0.98±0.05* 0.86±0.05*PRD治疗组 1.57±0.07# 0.58±0.03# 0.85±0.06# 1.04±0.02#
3 讨论
DM是由遗传和环境等多种因素共同作用所引起的以糖、脂肪和蛋白质代谢紊乱为基础的全身性内分泌代谢紊乱性疾病,高血糖为其主要特征,可引起多种急慢性并发症,导致多个器官系统功能障碍和衰竭。防治DM已成为代谢病研究领域的一个重要课题。目前认为胰岛β细胞功能受损和胰岛素抵抗是2型DM的致病机制,胰岛β细胞凋亡引起胰岛结构破坏和功能降低,导致血糖异常升高[3];另外,机体脂肪代谢紊乱与糖代谢密切相关,可促进胰岛素抵抗,并且对β细胞的损伤作用与血糖水平成正相关,两者共同促进DM及其并发症的发生发展[4]。
目前,STZ诱导的大鼠糖尿病模型广泛应用于糖尿病研究的各个领域,STZ的组织毒性小,动物存活率高,因此建立的模型稳定性好,操作方法简便[5]。STZ是一种含亚硝基的化合物,能特异性地破坏胰岛β细胞,其机制是诱导胰岛β细胞毒物质-一氧化氮(NO)的合成,NO参与许多自由基级联式反应,诱导胰岛β细胞凋亡;NO还能抑制线粒体的功能,降低β细胞代谢和胰岛素分泌,导致BG升高[6]。STZ腹腔注射建立糖尿病动物模型的注射剂量说法不一[7]。研究发现[8],采用小剂量多次注射STZ诱导糖尿病,能够有效地模拟糖尿病的自然病程,逐渐加重胰岛功能损伤,确切建立糖尿病动物模型,并且实验动物的死亡率较低。另外,有报道认为可能是因雌激素对血管具有保护作用,选用雄性鼠建立糖尿病动物模型的成模率明显高于雌性鼠。因此,本研究选用健康清洁级雄性Wistar大鼠作为实验研究对象,结合文献[2]、通过预实验确定25mg/kg作为STZ最佳实验剂量,连续腹腔注射3次建立DM动物模型。
PRD针对糖尿病病机关键“热、虚、瘀”,依据传统方,并结合临床研究及现代药理学研究成果,确立以苦瓜为君药,人参、丹参为臣药,葛根、何首乌、水蛭为佐使药的菩人丹中药组方。诸药协同,益气养阴,调畅气血,化瘀通络。现代药理研究证实PRD具有抑制氧化应激、对抗细胞凋亡和衰老、改善微循环、促进组织修复与再生等作用[7-8]。本研究发现,与正常对照组比较,糖尿病模型组大鼠BG、TG、TC、LDL-C明显升高,HDL-C明显降低,表明糖尿病高BG状态下,同时存在脂代谢紊乱;与糖尿病模型组比较,PRD治疗组大鼠的BG、TG、TC、LDL-C明显降低,HDL-C明显升高,表明PRD可明显降低糖尿病大鼠的BG、改善脂质代谢。由于PRD可发挥中药组方多环节、多靶位的治疗优势,且对人体无毒性,可避免化学合成药物的不良反应,因此可为临床治疗DM提供新方法。但关于PRD降BG及改善脂质代谢的机制有待于进一步的深入探讨。
[1]庞宗然,苏晓慧,刘祖涵,等.菩人丹超微粉对T2DM大血管病变大鼠骨骼肌组织IRS-1mRNA、GLUT4mRNA表达的影响[J].上海中医药杂志,2010,44(10):66-69.
[2]Xiang X, Wang Z, Zhu Y, et al. Dosage of streptozocin in inducing rat model of type 2 diabetes mellitus [J]. Wei Sheng Yan Jiu, 2010, 39(2): 138-142.
[3]Li C, Jones PM, Persaud SJ. Cannabinoid receptors are coupled to stimulation of insulin secretion from mouse MIN6 beca-cells[J]. Cell Physiol Biochem, 2010, 26(2): 187-196.
[4]EL-Assaad W, Buteau J, Peyot ML, et al. Saturated fatty acids synergize with elevated glucose to cause pancreatic beta-cell death[J]. Endocrinology, 2003,144(9): 4154-4163.
[5]Szkudelski T. The mechanism of alloxan and streptozotocin action in B cells of the rat pancreas [J].Physiol Res,2001,50(6):537-546.
[6]Grawel S,Wardas M,Niedworok E,et al.Malondialdehyde(MDA), as a lipid peroxidation marker[J].Wiad Lek,2004,57(10): 453-455.
[7]Okamoto T, Kanemoto N, Ohbuchi Y, et al. Characterization of STZ-induced type 2 diabetes in Zucker fatty rats[J]. Exp Anim,2008, 57(4): 335-345.
[8]万光明,孔晓路,王爽.糖尿病合并高度近视动物模型的制作[J].眼科研究,2009,27(6):511-513.

