基于滤膜法的空气微生物样品采集和元基因组DNA提取方法研究
谢 琼,辛冰牧,王 景,吕志堂,王 静,吴元亮
(1中国航天员科研训练中心,北京100094;2河北大学生命科学学院河北省微生物多样性研究与应用实验室,保定071002)
1 引言
如同在地球上一样,微生物在飞船上是广泛存在的。俄罗斯载人航天的经验证明随着飞行时间的延长,飞船中微生物的危害会越来越严重[1-3]。在太空中微生物的危害对人体而言主要是影响乘组健康,作为病原体引起感染、过敏[4];同时微生物能释放有害气体,成为间接的致病源;对飞船系统而言,一些生物降解类微生物能够降解飞船材料、腐蚀仪器仪表,影响飞船硬件设备稳定性致使仪器及系统失灵等[5]。因此微生物快速鉴定技术对于评估飞船环境意义重大。
目前,国际空间站主要使用传统培养法在轨进行菌落计数,而更细致的分类鉴定受到座舱条件的限制只能在地面进行。多年来NASA一直在寻求在轨免培养微生物快速鉴定方法[6]。一方面免培养法较培养法能快速、准确、灵敏地反映环境中微生物的多样性,在微生物检测和多样性研究研究中得到了广泛的应用[7];另一方面,培养法可能会低估微生物种群的数量,因为某些微生物具有非培养存活能力,或需要特殊培养条件[8,9]。尽管如此,免培养法在空气微生物多样性研究领域尚未得到广泛应用,其主要原因在于没有有效的适于免培养应用的空气微生物采样及元基因组DNA提取方法。
本文优化了微孔滤膜采集空气微生物条件,建立了元基因组DNA快速提取方法,并通过革兰氏阴性菌-大肠杆菌和革兰氏阳性菌-金黄色葡萄球菌验证,所得DNA满足PCR扩增需要,为空气微生物免培养快速鉴定奠定了基础。
2 材料和方法
2.1 材料
2.1.1 菌种
大肠杆菌(Escherichiacoli)和金黄色葡萄球菌(Staphylococcusaureus),两者均为实验室保藏菌种。
2.1.2 仪器
生物安全柜(BHC-1300IIA2)、台式高速冷冻离心机(CT14RD)、循环水多用真空泵(SHB-3,10L/min)、温度梯度PCR仪、智能蒸汽灭菌器(VPLA5032)、过滤式空气采样器、微孔滤膜(0.22μm 和0.45μm)。
2.1.3 试剂
TE(100mmol/L Tris.Cl,10mmol/L EDTA,pH8.0)、试剂盒1:土壤基因组DNA快速提取试剂盒(离心柱型)、试剂盒2:超纯土壤基因组DNA提取试剂盒、试剂盒3:细菌、真菌DNA快速提取试剂盒、DNA快速提取液(1%Triton X-100,0.5%Tween 20,10mM Tris·Cl(pH 8.0))、PCR扩增体系(2.5U/μL Taq DNA Polymerase、10×Taq Buffer、2.5mmol/L dNTPs、去离子双蒸水、20μmol/L引物)、溶葡萄球菌酶。
2.2 方法
2.2.1 空气样品元基因组DNA提取方法
(1)样品制备
采用掺菌法,以确保样品中含有一定数量的微生物。具体方法如下:抽滤250L空气,将先其中的悬浮物采集在0.22μm微孔滤膜上,用1mL TE缓冲液洗脱滤膜上采集的样品,121℃灭菌30min后加入1.3×107cfu的大肠杆菌和2.7×107cfu的金黄色葡萄球菌,10000rpm离心5min,弃上清,沉淀用于DNA提取。
(2)元基因组DNA提取
采用试剂盒1、试剂盒2、试剂盒3(提取方法参照说明书)和DNA快速提取液进行DNA提取。DNA快速提取液提取方法为:在样品中加入300μL的提取液,100℃煮沸5min,10000rpm离心5min,得上清为元基因组DNA,用0.7%琼脂糖凝胶电泳检测。
(3)元基因组DNA检验
得到的元基因组DNA采用紫外分光光度计测定OD260nm,计算得DNA得率,并分别用大肠杆菌特异引物 (Alr1:5’-CTGGAAGAGGCTAGCCTGGACGAG-3’和 Alr2:5’-AAAATCGGCACC GGTGGAGCGATC-3’)[10]和金黄色葡萄球菌特异引物(nucF:5'-GCGATTGAT GGTGATACGGTI-3'和nucR:5'-AGCCAAGCCTT GACGAACTAAAGC-3')[11]进 行PCR扩增,进一步比较不同实验方法提取DNA的效果。
2.2.2 空气样品采集方法
将过滤式空气采样器通过真空胶管链接于SHB-3循环水多用真空抽气泵(抽气量10L/min),根据滤膜孔径和抽滤时间设计如下采集方案(表1):
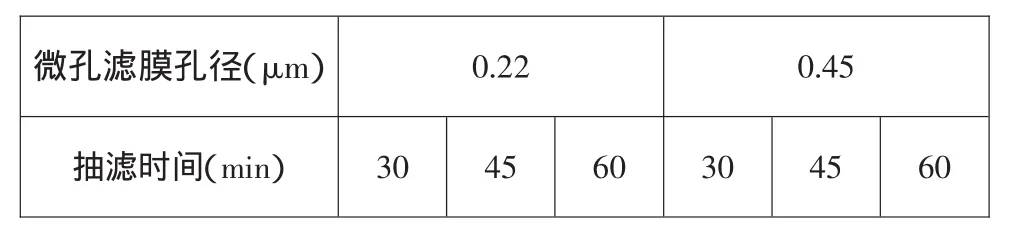
表1 空气样品采集条件的实验设计
样品采集结束后,用TE缓冲液将采集物从微孔滤膜上洗脱下来,然后用1.2.1.2确定的方法提取元基因组DNA,进行琼脂糖凝胶电泳检测,并采用细菌16S rDNA 通用引物 27F(5’-AGAGTTTGATCMTGGCTCAG-3’)和 1525R(5’-AGAAAGGAGGTGWTCCARCC-3’)[12]进行PCR扩增,检验提取DNA的质量。25μl扩增体系中加1μl DNA模板,2U Taq DNA聚合酶,其它为常规用量。扩增程序为:95℃预变性4min,95℃变性 45s,55℃退火 90s,72℃延伸 1min,72℃后延伸5min,30循环。扩增结束后,0.7%琼脂糖凝胶电泳进行检测。
3 结果
3.1 样品DNA提取方法的确定
根据OD260nm测定结果计算得到的采用掺菌法各方法提取DNA的得率见表2,结果表明:试剂盒1 DNA提取得率最高,且重现性好,试剂盒2和快速DNA提取液DNA得率明显低于试剂盒1,而试剂盒3 DNA得率最低。根据元基因组DNA琼脂糖凝胶电泳检测结果(图1):各方法提取得到的DNA分子量都在20kb以上,调带较为整齐。
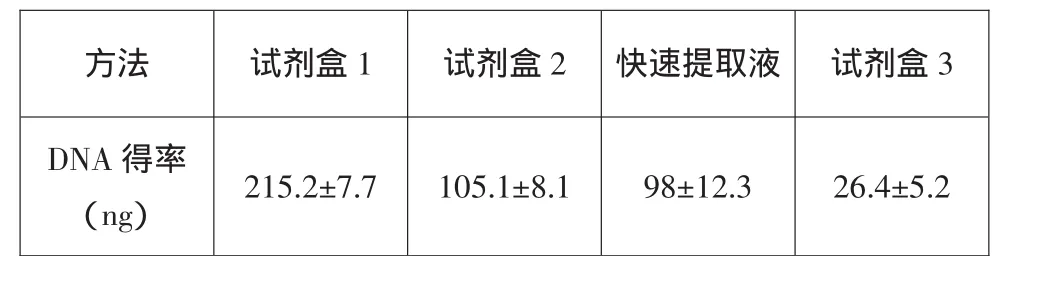
表2 不同方法提取样品元基因组DNA的得率比较
采用所提的元基因组DNA进行大肠杆菌和金黄色葡萄球菌特异引物扩增的结果如图2所示。
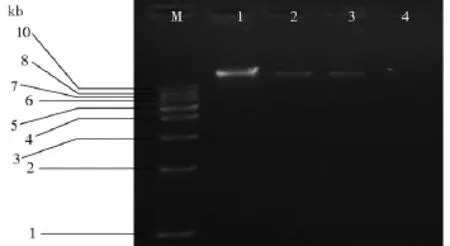
图1 不同方法提取样品元基因组结果比较
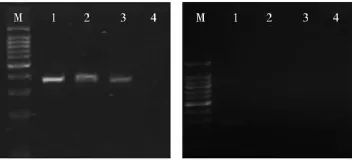
图2 大肠杆菌和金黄色葡萄球菌特异引物扩增不同方法提取的DNA检测结果
总体来看,除试剂盒3外,其它三种方法得到的DNA都得到了大肠杆菌的特异扩增产物片段(约370bp),且试剂盒1提取得到的DNA的扩增效果最好;虽然试剂盒1、试剂盒2提取的DNA样品得到了金黄色葡萄球菌特异扩增片段(约290bp),但是扩增效果较差。说明即使是试剂盒1,对金黄色葡萄球菌DNA的提取效果也较差。因此,以效果最好的试剂盒1提取法为基础,对实验方法进行了如下改进:
(1)在第2步37℃水浴时加入12U的溶葡萄球菌酶,并将水浴时间和第3步65℃水浴时间延长到30min~60min。
(2)将使用说明中第9步改为:加入二倍体积的冰乙醇,充分混匀,10000rpm离心10min,小心倒掉上层悬液;加入适量体积的70%乙醇,轻轻弹离心管的底部使DNA悬浮后,10000rpm离心10min,弃乙醇,晾干;最后用30μl洗脱缓冲液EB溶解沉淀即可。
实验方法改进前后DNA特异引物扩增结果比较见图3,显然改进提取方法后大肠杆菌和金黄色葡萄球菌特异扩增效率均有所提高,尤其是金黄色葡萄球菌的扩增效率改善明显。
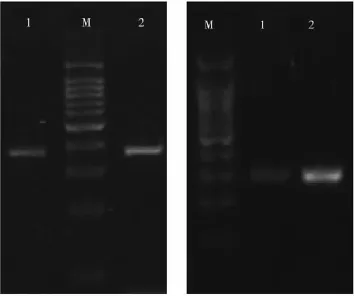
图3 DNA提取方法改进前后特异引物扩增效果对比
3.2 不同采样方法效果的比较
上述结果说明改进的提取方法对革兰氏阳性和革兰氏阴性细菌都适用,因此以改进的试剂盒1提取方法为标准,评价不同采样方法所得样品是否满足元基因组DNA提取及PCR扩增要求。检测结果如图4所示:
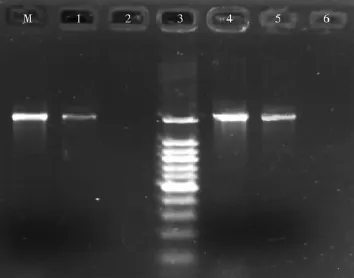
图4 不同条件采样后提取的DNA PCR扩增检测结果
结果显示:用两种孔径的微孔滤膜采集30min所得样品均不能提取得到满足普通PCR检测所需的DNA;而用两种孔径的微孔滤膜采集45min和60min所得样品均可提取得到满足普通PCR要求的DNA,但总体上0.22μm微孔滤膜采集所得样品提取DNA后扩增效果要比0.45μm微孔滤膜好,并且采集时间在60min时所得DNA扩增效率最高。说明采集30min时所得样品中微生物数量太少,尚不足以提取得到满足普通PCR检测的DNA,采集45min时所得样品中微生物数量虽已可提取得到满足普通PCR检测灵敏度要求量的DNA。但若适当延长采样时间,增加采集的空气体积,则对于分析空气中低丰度的微生物更合适些。
4 讨论
目前空气微生物样品采集多采用撞击法或自然沉降法,这两种方法均以培养为基础检测微生物[13]。在飞船上,环境微生物检测需快速、敏感,而传统的培养法无法满足此要求。免培养法能达到快速、高效、准确检测微生物的目的,已成为研究各类环境微生物多样性的重要方法,但是在空气微生物多样性研究领域尚未得到广泛应用,其主要原因在于没有有效的适于免培养应用的空气微生物采样及元基因组DNA提取方法[14-16]。
本研究发现与其他试剂比较,试剂盒1对于元基因组DNA的提取效率最高。对提取液的组成、原理和方法进行了分析,发现快速提取液法通过煮沸去除核酸内切酶,但有资料显示,有一些菌株含有的核酸内切酶靠煮沸是无法完全去除的,如含有endA+基因型的菌株;此外,试剂盒2和试剂盒3所采用的方法在细胞破壁后,DNA与核酸内切酶仍有充分接触时间,DNA有可能被降解;而离心柱分离通过吸附、快速漂洗和离心,减小了核酸内切酶与DNA作用的面积和时间,并能有效的去除细胞代谢产物、蛋白等杂质,最后所得到的洗脱的基因组DNA纯度较高。
使用提取模板扩增特异片段时发现即使是试剂盒1,对金黄色葡萄球菌DNA的扩增效果也较差。这可能与革兰氏阳性菌细胞壁结构影响提取效果有关。因此在改进方法中,加入了溶葡萄球菌酶和二倍体积的冰乙醇促进细菌壁的裂解,至此,改进的提取方法对革兰氏阳性和革兰氏阴性细菌均适用。
本研究建立了可用于免培养研究的室内空气微生物采集及DNA提取方法,所得DNA样品满足普通PCR检测需要,为空气样品微生物的免培养研究奠定了方法学基础。 ◇
[1]Novikova.N.D.Survey of the environmental biocontamination on board the International Space Station[J].Research in Microbiology,2006,157:5-12.
[2]Pierson,DL.Microbial contamination of spacecraft[J].Gravitational Space Biol Bull,2001,14:1-6.
[3]Novikova N.D..Review of the Knowledge of Microbial Contamination of the Russian Manned Spacecraft[J].Microbial Ecology,2004,47:127-132.
[4]Peter W.Taylor,Andrei P.Sommer.Towards rational treatment of bacterial infections during extended space travel[J].International Journal of Antimicrobial Agents,2005,26:183–187.
[5]Gus Ji-Dong,Monsi Romanb,Thomas Esselmanc et al.The role of microbial biofilms in deterioration of space station candidate materials[J].International Biodeterioration&Biodegradation,1998,41:25-33.
[6]Sandra P.van Tongeren,Janneke Krooneman,Gerwin C.Raangs et al.Microbial Detection and Monitoring in Advanced Life Support Systems like the International Space Station.[J] Microgravity sci.technol,2006,XVIII-3/4:219-222.
[7]Vaz-Moreiral I,Egas C,Nunes OC,et al.Culture-dependent and culture-independent diversity surveys target different bacteria:a case study in a freshwater sample[J].Antonie Van Leeuwenhoek,2011,publish online 08 May,DOI:10.1007/s10482-011-9583-0.
[8]LaDuc M.T.,Kern R.,Venkateswaran K..Microbial Monitoring of Spacecraft and Associated Environments [J].Microbial Ecology,2004,47:150–158.
[9]Grimes D.J,Mills A.L,Nealson K.H.The importance of viable but nonculturable bacteria in biogeochemistry.In:Colwell,RR,Grimes,DJ (Eds.) Nonculturable Microorganisms in the Environment[J].ASM Press,2000:209–227.
[10]马东,宋宏新,李明亮,等.PCR检测乳品中大肠杆菌的研究[J].食品科学,2009,30(4):260-263.
[11] Brakstad O.G, Aasbakk K, Maeland J.A.Detection of Staphylococcus aureus by polymerase chain reaction amplification of the nuc gene[J].J Clin Microbiol,1992,30(7):1654.
[12] SplettstoesserWD, Seibold E, Zeman E, etal.Rapid differentiation of Francisella species and subspecies by fluorescent in situ hybridization targeting the 23S rRNA [J].BMC Microbiology,2010,10:72.
[13]邱方,张丽.撞击法和沉降法采样对医院病房空气细菌总数检测结果比较[J].预防医学论坛,2006,12(5):581-582.
[14]James J.McDevitt,Peter S.J.Lees,William G.Merz ,et al.Development of a method to detect and quantify Aspergillus fumigatus conidia by quantitative PCR for environmental air samples[J].Mycopathologia,2004,158:325–335.
[15]Denina Hospodsky,Naomichi Yamamoto,and Jordan Peccia1.Accuracy,Precision,and Method Detection Limits of Quantitative PCR forAirborne Bacteria and Fungi [J].Applied and Environmental Microbiology,2010,76(21):7004–7012.
[16]Naomichi Yamamoto,Minoru Kimura,Hideaki Matsuki,et al.Optimization of a real-time PCR assay to quantitate airborne fungi collected on a gelatin filter [J].Journal of Bioscience and Bioengineering,2010,109(1):83–88.

