饲料蛋白质水平对尼罗罗非鱼幼鱼生长性能、体组成、血液学指标和肝脏非特异性免疫指标的影响
杨 弘 徐起群 乐贻荣 祝璟琳 肖 炜 李大宇 邹芝英
(1.中国水产科学研究院淡水渔业研究中心,农业部淡水渔业和种质资源利用重点实验室,无锡 214081;2.南京农业大学渔业学院,无锡 214081)
尼罗罗非鱼(Oreochromis niloticus)又称非洲鲫鱼,是隶属于鲈形目(Perciformes)丽鱼科(Cichlidae)罗非鱼属(Tilapia)的热带鱼类,具有生长快、产量高、繁殖力强、对环境适应性强等特点,已经成为我国南方地区(广东、海南、广西、福建)的主要养殖品种之一[1-2]。目前关于尼罗罗非鱼的蛋白质需求量已有一些文献报道。El-Sayed等[3]研究发现尼罗罗非鱼对蛋白质的需求量受鱼体规格的影响,尼罗罗非鱼鱼苗(初始体质量为15 mg)的蛋白质需求量为45%;Siddiqui等[4]报道初始体质量分别为0.8和40.0 g的尼罗罗非鱼,其蛋白质需求量分别为40%和30%;Abdel-Tawwab等[5]发现规格为0.4~0.5 g的尼罗罗非鱼的蛋白质需求量为45%,高于17~22 g和37~43 g这2种规格的蛋白质需求量(35%)。由于Hanley[6]研究发现尼罗罗非鱼对脂质的最低需求量为5.1%,上述尼罗罗非鱼对蛋白质的需求量研究结果都是建立在饲料配方中脂肪水平为5%左右时,此条件下得出的尼罗罗非鱼蛋白质需求量在30%~45%。
蛋白质是水产动物必需的核心营养物质[7],同时也是水产饲料中直接影响饲料成本价格的原料。饲料蛋白质水平能直接影响鱼类的生长,当饲料中蛋白质水平较低时,鱼类就难以达到其最佳的生长速率[5,8-9],同时还会影响鱼类的成活率[10-11]。然而,当饲料中蛋白质水平过高时,鱼类会通过氧化脱氨基作用把过量的蛋白质分解代谢用于能量消耗,会产生较多的氨氮排泄物,从而导致养殖水体污染加重,不利于鱼类的生长和生态环境的可持续发展[12-16]。因此,提高饲料中非蛋白质营养素如脂肪的水平,利用其对蛋白质的节约作用,在不影响鱼类生长的前提下降低饲料蛋白质水平和饲料成本,这对于提高鱼类养殖效益、减少环境胁迫和产业的可持续发展具有重要意义。
在对其他品系罗非鱼的研究中发现,饲料中的脂肪可以起到节约蛋白质的作用。Jauncey[17]对奥尼罗非鱼(Oreochromis niloticus♀×O.aureus)的研究得出,当把饲料中的脂肪水平提高到12%时,饲料中的蛋白质水平可以从40%降低到30%而不会对其生长和饲料利用产生负面影响。有鉴于此,本试验通过探讨高脂肪水平(9%)条件下尼罗罗非鱼幼鱼对蛋白质的需求量,以及蛋白质水平对尼罗罗非鱼幼鱼生长性能、体组成、血液学指标和肝脏非特异性免疫指标的影响,以期为生产上配制高能低氮的环保型尼罗罗非鱼全价配合饲料提供数据参考和科学依据。
1 材料与方法
1.1 试验饲料
试验饲料以鱼粉、棉籽粕、豆粕、菜籽粕、酪蛋白和明胶为蛋白质源,以酪蛋白和明胶的不同比例调整饲料蛋白质水平,配制成蛋白质水平分别为25%、30%、35%、40%和45%的5种等能饲料。各饲料原料粉碎过60目筛,微量成分采取逐级扩大法添加,与大宗原料混合均匀后,用制粒机挤压成粒径为2.0 mm的颗粒饲料,风干后放入-20℃冰箱中冷冻备用。试验饲料组成及营养水平见表1。
1.2 试验分组与饲养管理
试验所用尼罗罗非鱼选自国家罗非鱼产业技术体系研发中心试验基地,为1999年引进的埃及品系尼罗罗非鱼选育以后培育的子代。试验鱼放养在带有控温功能的室内循环水养殖系统中,水源为曝气自来水。将试验鱼[初始平均体质量为(4.70±0.01)g]随机分为5个组,分别饲喂不同蛋白质水平的饲料,每组3个重复,每个重复20尾鱼,每个桶为1个重复,共用15个桶,每个桶的有效体积为475 L。试验鱼适应环境2周后称重,开始投喂试验饲料,日投喂率为体质量的6%~8%,每天于08:00、12:30和18:00分3次投喂。每2周称重1次,调整投喂量。每天早上通过换水清除桶底部的粪便。试验期间水温为(28±1)℃,pH 7.2~7.8,氨氮含量小于0.05 mg/L,溶氧含量大于5.0 mg/L。饲养时间为10周。
1.3 测定指标与方法
1.3.1 生长指标
养殖试验结束后,记录每个桶试验鱼的数目和总体质量,然后每个桶随机抽取3尾鱼进行取样,测定鱼的体长、体质量、肝脏质量、内脏质量以及取出内脏后的鱼体质量,以计算生长指标。
增重率(WGR,%)=[(终末鱼体质量+死亡鱼体质量-初始鱼体质量)/初始鱼体质量]×100;
摄食量(FI,g/尾)=投喂量/鱼尾数;
蛋白质效率(PER,%)=[(终末鱼体质量+死亡鱼体质量-初始鱼体质量)/蛋白质摄入量]×100;
特定生长率(SGR,%/d)=[(ln终末鱼体质量-ln初始鱼体质量)/饲养天数]×100;
饲料系数(FCR)=摄食量/(终末鱼体质量+死亡鱼体质量-初始鱼体质量);
蛋白质沉积率(PDR,%)=[(终末鱼体蛋白质含量-初始鱼体蛋白质含量)/蛋白质摄入量]×100;
成活率(SR,%)=(终末鱼尾数/初始鱼尾数)×100;
肥满度(CF,g/cm3)=终末鱼体质量/终末鱼体长3;
肝体比(HSI,%)=(肝脏质量/鱼体质重)×100;
脏体比(VSI,%)=(内脏质量/鱼体质重)×100。

表1 试验饲料组成及营养水平(饲喂基础)Table1 Composition and nutrient levels of experimental diets(as-fed basis) %
1.3.2 体组成
养殖试验结束后,每桶随机取6尾鱼作为全鱼样品分析体组成。其中,水分含量的测定采用105℃烘干恒重法;灰分含量的测定采用马福炉550℃高温灼烧法;粗蛋白质含量的测定采用凯氏定氮法;粗脂肪含量的测定采用索氏抽提法。
1.3.3 血液学指标
养殖试验结束后,每桶随机取6尾鱼于尾静脉处采血,取全血样品和血清样品每重复各2份,送江苏省无锡市江原医院检测。全血样品检测白细胞计数、红细胞计数、血红蛋白含量以及红细胞压积,血清样品检测肌酐、总蛋白、白蛋白、球蛋白、甘油三酯、胆固醇含量以及碱性磷酸酶活性。
1.3.4 肝脏非特异性免疫指标
养殖试验结束后,每桶随机取6尾鱼的肝脏于-80℃冷冻,备测肝脏中溶菌酶(LZM)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性以及丙二醛(MDA)含量。上述指标的测定均采用生物素双抗体夹心酶联免疫吸附法(ELISA),所用试剂盒均购自美国Assay公司(上海朗顿生物技术有限公司代理)。
1.4 数据统计与分析
试验数据用平均值±标准差表示,采用SPSS 18.0统计软件的单因素方差分析(one-way ANOVA)进行方差分析,并采用Duncan氏法多重比较检验组间差异的显著性,P<0.05即认为有显著差异。
2 结果与分析
2.1 饲料蛋白质水平对尼罗罗非鱼幼鱼生长性能的影响
由表2可知,各组试验鱼的终末体质量、增重率、特定生长率随饲料蛋白质水平的增加呈现上升的趋势,但各组之间差异不显著(P>0.05)。各组试验鱼的饲料系数、成活率、肥满度、肝体比和内脏比无显著差异(P>0.05)。饲料蛋白质水平对尼罗罗非鱼幼鱼蛋白质效率和蛋白质沉积率有显著影响(P<0.05)。尼罗罗非鱼幼鱼的蛋白质效率随饲料蛋白质水平的增加而显著降低(P<0.05),以蛋白质水平为25%的组最高,蛋白质水平为45%的组最低。尼罗罗非鱼幼鱼的蛋白质沉积率随饲料蛋白质水平的增加呈现先升高后下降的趋势,蛋白质水平为30%的组显著高于蛋白质水平为35%、40%和45%的组(P<0.05),蛋白质水平为25%和35%的组显著高于蛋白质水平为40%和45%的组(P<0.05),但蛋白质水平为25%和30%的组之间差异不显著(P>0.05)。
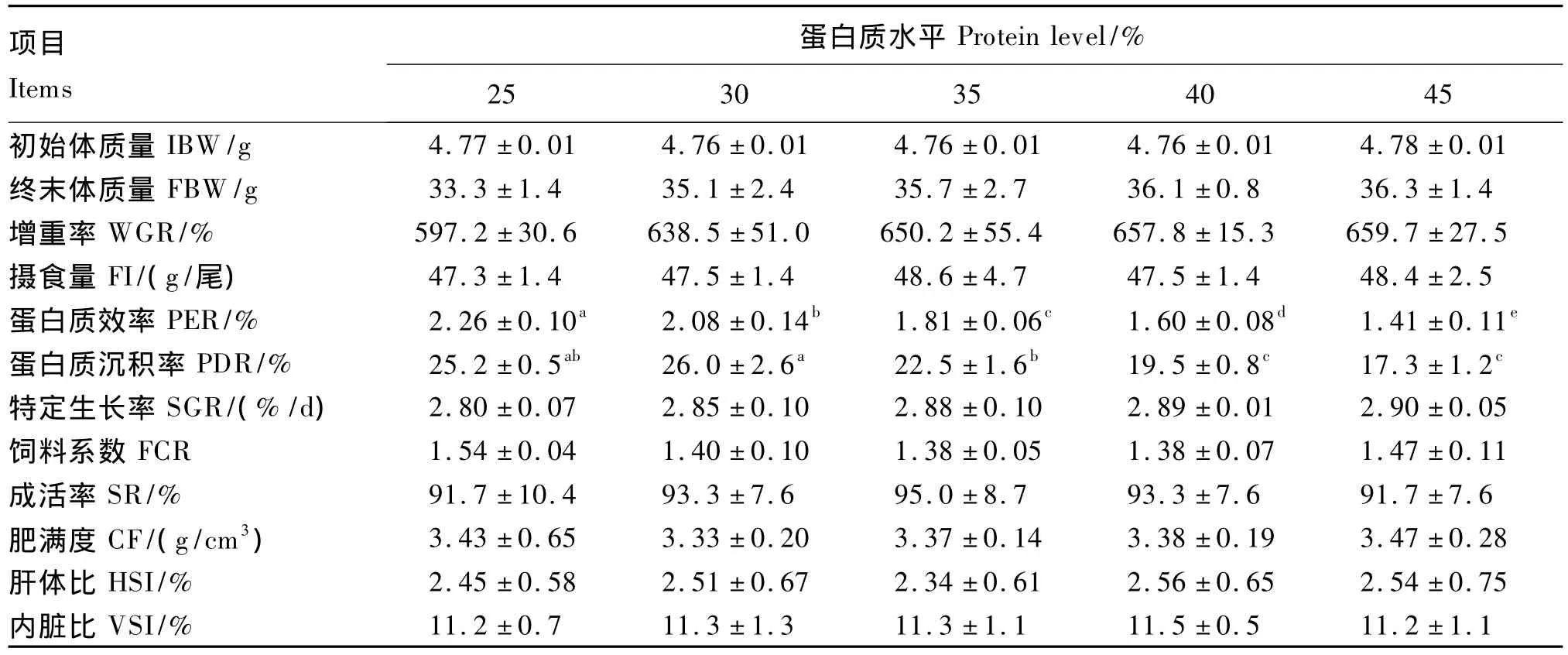
表2 饲料蛋白质水平对尼罗罗非鱼生长性能的影响Table2 Effects of dietary protein level on growth performance of juvenile Nile tilapia,Oreochromis niloticus
2.2 饲料蛋白质水平对尼罗罗非鱼幼鱼体组成的影响
由表3可知,饲料蛋白质水平对尼罗罗非鱼幼鱼全鱼粗脂肪含量有显著影响(P<0.05),而对全鱼水分、粗蛋白质和灰分含量无显著影响(P>0.05)。尼罗罗非鱼幼鱼全鱼粗脂肪含量随饲料蛋白质水平的增加变化趋势不明显,以蛋白质水平为25%的组最高,显著高于其他各组(P<0.05),其他各组之间差异不显著(P>0.05)。
2.3 饲料蛋白质水平对尼罗罗非鱼幼鱼血液学指标的影响
由表4可知,饲料蛋白质水平对尼罗罗非鱼幼鱼全血中血红蛋白含量有显著影响(P<0.05),而对全血中白细胞计数、红细胞计数以及红细胞压积无显著影响(P>0.05)。尼罗罗非鱼幼鱼全血中血红蛋白含量随饲料蛋白质水平的增加呈现先上升后下降的趋势,蛋白质水平为40%的组最高,蛋白质水平为25%的组最低,这2组之间差异显著(P<0.05),其他组之间差异不显著(P>0.05)。饲料蛋白质水平对尼罗罗非鱼幼鱼血清中肌酐、总蛋白、白蛋白、球蛋白、甘油三酯、胆固醇含量以及碱性磷酸酶活性均无显著影响(P>0.05)。
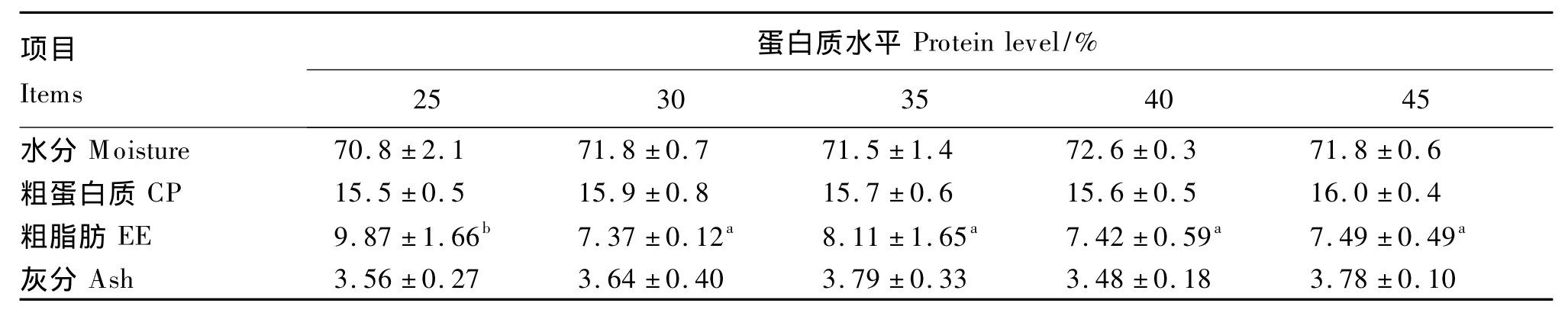
表3 饲料蛋白质水平对尼罗罗非鱼幼鱼体组成的影响(湿重基础)Tabe 3 Effects of dietary protein level on body composition of juvenile Nile tilapia,Oreochromis niloticus(wet weight basis)

表4 饲料蛋白质水平对尼罗罗非鱼幼鱼血液学指标的影响Table4 Effects of dietary protein level on hematological indexes of juvenile Nile tilapia,Oreochromis niloticus
2.4 饲料蛋白质水平对尼罗罗非鱼幼鱼肝脏非特异性免疫指标的影响
由表5可知,饲料蛋白质水平对尼罗罗非鱼幼鱼肝脏中溶菌酶、过氧化氢酶活性以及丙二醛含量有显著影响(P<0.05)。肝脏中溶菌酶活性以蛋白质水平为45%的组为最高,显著高于蛋白质水平为25%的组(P<0.05),但与蛋白质水平为30%、35%和40%的组相比无显著差异(P>0.05)。肝脏中过氧化氢酶活性随饲料蛋白质水平的增加呈现先上升后下降的趋势,以蛋白质水平为25%的组最低,显著低于蛋白质水平为35%和45%的组(P<0.05);以蛋白质水平为35%的组最高,显著高于其他各组(P<0.05)。肝脏中丙二醛含量随饲料蛋白质水平的增加呈现先下降后上升的趋势,蛋白质水平为30%的组最低,蛋白质水平为45%的组最高,显著高于其他各组(P<0.05),其他各组之间差异不显著(P>0.05)。饲料蛋白质水平对尼罗罗非鱼幼鱼肝脏中超氧化物歧化酶活性无显著影响(P>0.05),但随饲料蛋白质水平的增加肝脏中超氧化物歧化酶活性呈现先上升后下降的趋势,蛋白质水平为45%的组最低,蛋白质水平为30%的组最高。

表5 饲料蛋白质水平对尼罗罗非鱼幼鱼肝脏非特异性免疫指标的影响Table5 Effects of dietary protein level on hepatic non-specific immune indexes of juvenile Nile tilapia,Oreochromis niloticus
3 讨论
大量的研究表明鱼类的生长和对饲料的利用效率受饲料蛋白质水平影响[18-20]。然而,本试验结果表明,以增重率、特定生长率、成活率为指标,在本试验设计的饲料蛋白质水平范围(25%~45%)内,当饲料脂肪(鱼油和豆油的等量混合物)水平为9%(分析值为9.52%)时,尼罗罗非鱼幼鱼的生长性能不受饲料蛋白质水平的影响,饲料中蛋白质水平为25%(分析值为24.83%)即可满足尼罗罗非鱼幼鱼的生长需要,同时蛋白质效率和蛋白质沉积率均较高。本试验得出的尼罗罗非鱼幼鱼的蛋白质需求量低于 Hafedh[19]和 Abdel-Tawwab等[5]报道的结果(35% ~45%),这可能与本试验设计的饲料脂肪水平较高有关。本试验设计的饲料脂肪水平为9%(分析值为9.52%),高于尼罗罗非鱼对脂肪的最低需求量(5.1%),得出的蛋白质需求量相对较低,表明通过提高饲料中脂肪水平,可以在不影响生长的情况下起到降低尼罗罗非鱼幼鱼蛋白质需求量的作用。在大西洋鲑鱼[21-23]和鲶鱼[24]上的研究也得出提高饲料中脂肪水平可以降低鱼类对蛋白质的需求量,即脂肪可以对蛋白质起到节约作用。
本试验中,尼罗罗非鱼幼鱼全鱼粗脂肪含量受饲料蛋白质水平的影响显著,其中蛋白质水平为25%的组全鱼粗脂肪含量显著高于其他各组;而全鱼的水分、粗蛋白质和灰分含量各组间差异不显著。本试验设计的各试验饲料是保持等脂水平的,高蛋白质饲料含有较低的淀粉水平(表1);相反,低蛋白质饲料含有较高的淀粉水平。在对其他鱼类的研究中发现,饲料可消化淀粉水平较高会引起糖原在肝脏中积累,造成肝体比升高[25-27]。同时,Yang 等[28]对银鲈的研究发现,肠系膜脂肪含量和肝体比会伴随着饲料淀粉水平的减少而降低。然而,本试验中肝体比各组间不存在显著差异,由此推断摄食低蛋白质饲料的尼罗罗非鱼幼鱼能够有效利用过多的糖原转化成鱼体脂肪,即具有高效利用饲料中淀粉的能力。
本试验中,随着饲料蛋白质水平的增加,尼罗罗非鱼幼鱼全血中血红蛋白含量呈现先上升后下降的趋势,这与Kim等[29]报道的牙鲆全血中血红蛋白含量伴随着饲料蛋白质水平的增加呈现先上升后下降的趋势相同。本试验中,饲料蛋白质水平对尼罗罗非鱼幼鱼全血中白细胞计数、红细胞计数以及红细胞压积均无显著影响,这与Welker等[30]报道的相同规格健康罗非鱼血液学指标相似,由此可知,25%的饲料蛋白质水平已经可以满足血液细胞的形成和发育。由于血红蛋白含量、红细胞压积和红细胞计数同鱼类的非特异性免疫功能具有一定的相关性,能够反映鱼类健康状况,高含量的血红蛋白被认为是动物健康的表现[31]。因此,在本试验中,血红蛋白的上升趋势表明饲料蛋白质水平较高时对鱼类的健康具有促进作用。
正常情况下,鱼类血清生化成分含量受神经和内分泌调节保持相对稳定,可以作为机体健康状况的评价指标。本试验中,饲料蛋白质水平对尼罗罗非鱼幼鱼血清中肌酐、总蛋白、白蛋白、球蛋白、甘油三酯和胆固醇含量以及碱性磷酸酶活性均无显著影响,且这些血液生化指标的含量都在健康范围[32]之内。由此可见,25%的饲料蛋白质水平即可满足尼罗罗非鱼幼鱼机体正常的生理代谢需求。
鱼体中的溶菌酶是一类有溶菌活性的碱性蛋白,在水产动物抵抗病原微生物感染中具有重要作用[33-34],其活性的高低是衡量机体免疫状态的指标之一。丙二醛是脂质过氧化物的最终分解产物之一,具有很强的生物毒性,其含量能直接反映机体脂质过氧化程度,并间接反映机体抗氧化能力和细胞损伤程度。本试验中,蛋白质水平为25%的组试验鱼肝脏中溶菌酶活性显著低于其他各组,而在其他各组间不存在显著差异。同时,蛋白质水平为25%的组试验鱼肝脏中丙二醛含量较高,显著高于蛋白质水平为45%的组。超氧化物歧化酶是生物机体内重要的抗氧化酶之一,可以减弱活性氧自由基对机体的损伤。本试验中,饲料蛋白质水平对尼罗罗非鱼幼鱼肝脏中超氧化物歧化酶活性未产生显著影响。过氧化氢酶能催化H2O2等生成H2O和O2[35],防止自由基对细胞的毒害,是机体内活性氧自由基的天然清除剂。肝脏中过氧化氢酶活性随饲料蛋白质水平的增加呈现先上升后下降的趋势,其中蛋白质水平为25%的组试验鱼肝脏中过氧化氢酶活性显著低于蛋白质水平为35%和45%的组。上述结果说明尼罗罗非鱼幼鱼的非特异性免疫功能在一定程度上受到了饲料蛋白质水平的影响,适当提高饲料蛋白质水平可提高机体抗病能力。
4 结论
①当饲料脂肪水平为9%(分析值为9.52%)时,饲料蛋白质水平(25% ~45%)对尼罗罗非鱼幼鱼的生长性能、体组成和血液学指标影响不大,25%的饲料蛋白质水平即可满足体质量为(4.70±0.01)g的尼罗罗非鱼幼鱼的生长需求。
②适当提高饲料蛋白质水平可在一定程度上提高尼罗罗非鱼幼鱼的非特异性免疫功能,主要表现在提高肝脏溶菌酶和过氧化氢酶活性上。
[1]杨弘.我国罗非鱼产业现状及产业技术体系建设[J].中国水产,2010(9):6-10.
[2]杨弘,祝璟琳,单航宇.我国罗非鱼产业发展和思考[J].海洋与渔业,2011(11):47-50.
[3]EL-SAYED A F M,GARLING D L,Jr.Carbohydrate-to-lipid ratios in diets for tilapia fingerlings[J].Aquaculture,1988,73:157-163.
[4]SIDDIQUI A Q,HOWLANDER M S,ADAM A A.Effects of dietary protein levels on growth,diet conversion and protein utilization in fry and young Nile tilapia,Oreochromis niloticus[J].Aquaculture,1988,70:63-73.
[5]ABDEL-TAWWAB M,AHMAD M H,KHATTAB Y A E,et al.Effect of dietary protein level,initial body weight,and their interaction on the growth,feed utilization,and physiological alterations of Nile tilapia,Oreochromis niloticus(L.)[J].Aquaculture,2010,298:267-274.
[6]HANLEY F.Effects of feeding supplementary diets containing varying levels of lipid on growth,food conversion,and body composition of Nile tilapia,Oreochromis niloticus(L.)[J].Aquaculture,1991,93:323-334.
[7]NRC.Nutrient requirements of poultry[S].Washington,D.C.:National Academy Press,1993.
[8]BRECKA B J,KOHLER C C,WAHL D H.Effects of dietary protein concentration on growth,survival,and body composition of muskellunge Esox musquinongy and tiger muskellunge Esox masquinongy×E.luscius fingerlings[J].Journal of the World Aquaculture Society,1995,26:416-425.
[9]SHIAU S Y,LAN C W.Optimum dietary protein level and protein to energy ratio for growth of grouper(Epinephelus malabaricus)[J].Aquaculture,1996,145:259-266.
[10]PÉRES A,ZAMBONINO INFANTE J L,CAHU C L.Dietary regulation of activities and mRNA levels of trypsin and amylase in sea bass(Dicentrarchus labrax)larvae[J].Fish Physiology and Biochemistry,1998,19:145-152.
[11]EGUIA R V,KAMARUDIN M S,SANTIAGO C B.Growth and survival of river catfish Mystus nemurus(Cuvier and Valenciennes)larvae fed isocaloric diets with different protein levels during weaning[J].Journal of Applied Ichthyology,2000,16:104-109.
[12]CHAKRABORTY S C,ROSS L G,ROSS B.The effect of dietary protein level and ration level on excretion of ammonia in common carp,Cyprinus carpio[J].Comparative Biochemistry and Physiology Part A:Physiology,1992,103:801-808.
[13]ENGIN K,CARTER C G.Ammonia and urea excretion rates of juvenile Australian short-finned eel(Anguilla australis australis)as influenced by dietary protein level[J].Aquaculture,2001,194:123-136.
[14]SUN L,CHEN H,HUANG L.Growth,faecal production,nitrogenous excretion and energy budget of juvenile yellow grouper(Epinephelus awoara)relative to ration level[J].Aquaculture,2007,264:228-235.
[15]YANG S D,LIOU C H,LIU F G.Effects of dietary protein level on growth performance,carcass composition and ammonia excretion in juvenile silver perch(Bidyanus bidyanus)[J].Aquaculture,2002,213:363-372.
[16]TIBBETTS S,LALL S P,ANDERSON D M.Dietary protein requirement of juvenile American eel(Anguilla rostrata)fed practical diets[J].Aquaculture,2000,186:145-155.
[17]JAUNCEY K.Nutritional requirement[M]//BEVERIDGE M C M,MCANDREW B J.Tilapias:biology and exploitation.London:Kluwer Academic Press,2000:327-375.
[18]董晓慧,耿旭,郭云学,等.奥尼罗非鱼仔稚鱼饲料中适宜蛋白质水平的研究[J].中国饲料,2009(7):29-35.
[19]HAFEDH Y S A.Effects of dietary protein on growth and body composition of Nile tilapia,Oreochromis niloticus L.[J].Aquaculture Research,1999,30(5):385-393.
[20]CHOU R L,SU M S,CHEN H Y.Optimal dietary protein and lipid levels for juvenile cobia(Rachycentron canadum)[J].Aquaculture,2001,193:81-89.
[21]EINEN O,ROEM A J.Dietary protein/energy ratios for Atlantic salmon in relation to fish size:growth,feed utilization and slaughter quality[J].Aquaculture Nutrition,1997,3:115-126.
[22]REFSTIE S,STOREBAKKEN T,BAEVERFJORD G,et al.Long-term protein and lipid growth of Atlantic salmon(Salmo salar)fed diets with partial replacement of fish meal by soy proteins products at medium or high lipid level[J].Aquaculture,2001,193:91-106.
[23]GRISDALE-HELLAND B,SHEARER K D,GATLIN D M,et al.Effects of dietary protein and lipid levels on growth,protein digestibility,feed utilization and body composition of Atlantic cod(Cadus morhua)[J].Aquaculture,2008,283:156-162.
[24]KIM L O,LEE S M.Effects of the dietary protein and lipid levels on growth and body composition of bagrid catfish,Pseudobagrus fulvidraco[J].Aquaculture,2005,243:323-329.
[25]DANIELS W H,ROBINSON E H.Protein and energy requirements of juvenile red drum(Sciaenops ocellatus)[J].Aquaculture,1986,53:243-252.
[26]HIDALGO F,ALLIOT E.Influence of water temperature on protein requirement and protein utilization in juvenile sea bass,Dicentrachus labrax[J].Aquaculture,1988,72:115-129.
[27]BROWN M L,NEMATIPOUR G R,GATLIN D M.Dietary protein requirement of juvenile sunshine bass at different salinities[J].The Progressive Fish-Culturist,1992,54:148-156.
[28]YANG S D,LIOU C H,LIU F G.Effects of dietary protein level on growth performance,carcass composition and ammonia excretion in juvenile silver perch(Bidyanus bidyanus)[J].Aquaculture,2002,213:363-372.
[29]KIM K W,WANG X J,CHOI S M,et al.Evaluation of optimum dietary protein-to-energy ratio in juvenile olive flounder Paralichthys olivaceus(Temminck et Schlegel)[J].Aquaculture Research,2004,35(3):250-255.
[30]WELKER T L,LIM C,YILDIRIM-AKSOY M,et al.Growth,immune function,and disease and stress resistance of juvenile Nile tilapia(Oreochromis niloticus)fed graded levels of bovine lactoferrin[J].Aquaculture,2007,262(1):156-162.
[31]BALDI A,BONTEMPO V,DELL’ORTO V,et al.Effects of dietary chromium-yeast in weaning-stressed piglets[J].Canadian Journal of Animal Science,1999,79(3):369-374.
[32]聂国兴,明红,郑俊林,等.木聚糖酶对尼罗罗非鱼血液生理生化指标的影响[J].大连水产学院学报,2009,22(5):361-365.
[33]HIKIMA S,HIKIMA J,ROJTINNAKORN J,et al.Characterization and function of kuruma shrimp lysozyme possessing lytic activity against Vibrio species[J].Gene,2003,316:187-195.
[34]HOFFMANN J A,KAFATOS F C,JANEWAY C A,et al.Phylogenetic perspectives in innate immunity[J].Science,1999,284:1313-1318.
[35]REYES-BECERRIL M,TOVAR-RAMÍREZ D,ASCENCIO-VALLE F,et al.Effects of dietary live yeast Debaryomyces hansenii on the immune and antioxidant system in juvenile leopard grouper Mycteroperca rosacea exposed to stress[J].Aquaculture,2008,280(1/2/3/4):39-44.The results indicate that 25%dietary protein level can meet the requirement of growth for juvenile Nile tilapia in the condition of 9%dietary fat level,and properly increasing dietary protein level can improve the hepatic non-specific immune function to some extent.[Chinese Journal of Animal Nutrition,2012,24(12):2384-2392]

