加工番茄离区发育过程及有无离区相关生理特性分析
王傲雪,潘素丽,刘生财,李凤兰,王 旭,栾 杰
(1.东北农业大学园艺学院,哈尔滨 150030;2.福建农林大学园艺植物工程研究所,福州 350002)
器官或组织的脱落是植物界普遍发生的生理现象,是细胞结构、生理生化代谢和基因表达等过程共同作用的结果[1]。一般情况下,把器官或组织脱落的组织区域及其邻近部分称为“离区”(Abscission zone,AZ),而把此区域内仅发生组织与细胞分离的数层细胞叫“离层”(Abscission layer)[2]。早在 20世纪50年代,人们广泛应用菜豆进行离区解剖学研究,确定脱落一般发生在一个可预知的、由特殊形态细胞组成的离区部位[3]。有些植物的脱落部分在接受诱导前无法辨认离层细胞与其他细胞的差异[4],也有研究利用组织化学和其他技术辨认出离层细胞的特点[5]。
许多研究表明,纤维素酶、多聚半乳糖醛酸酶等细胞壁降解酶活性与离区脱落进程有着密切的关系[6-10]。国内对番茄的离层产生已进行一些研究,但其作用机制尚不十分明确,尤其是有、无离层间纤维素酶与多聚半乳糖醛酸酶等酶的活性变化报道更少,并且离层在农业生产与模式植物研究等方面具有重要价值。许多研究者对植物器官脱落进行深入研究,而对番茄花梗离区形成过程则关注较少。
因此,本试验通过对番茄花发育过程中离层形成的解剖观察,对离层的特性及其形成的解剖学过程进行研究,并以花完全开放时期的离区为生理生化研究对象,研究番茄花梗脱落区发育过程中相关细胞壁降解酶含量的变化,为进一步探讨离区发育机制奠定理论基础,也为生产中防止落花落果提供重要指导意义。
1 材料与方法
1.1 材料
试验于2009年2~7月在东北农业大学园艺站进行,以番茄离层品种“08052”、“09872”、“09874”和无离层品种“08003”、“08004”、“08016”为试材,由东北农业大学番茄课题组提供,日光温室栽培。当番茄开第2穗花时开始取样,于每天上午9:00左右剪取各株相同或相近位置花序上正常开放的花,放入盛有蒸馏水的烧杯中,立即带回实验室,先用自来水冲洗,再用蒸馏水冲洗3次。取有离层品种离区上下2 cm作为提取材料,无离层品种在相应部位2 cm处取材。
1.2 方法
1.2.1 离层发育过程解剖学研究
在6叶1心时取有离层品种“9872”(T)和对照无离层品种“08003”(CK),每7 d取其生长点,至花絮出现时取其花絮,待花完全开时取其花梗,均用FAA固定。利用石蜡切片技术处理所取样品(切片厚度为10 μm)经过番红-固绿滴染后封固[11],用Olympus-BMF光学显微镜观察并选择典型的结构进行拍照。
1.2.2 生理生化指标的测定
根据离层发育过程解剖学观察结果,在完全形成离层的时期(花完全开放时期)进行取材,测定相关的生理生化指标。
多聚半乳糖醛酸酶:0.6%柑橘果胶为反应底物,每克组织每小时内黏度下降1%作为一个Exo-PG酶活单位[12]。
纤维素酶:羧甲基纤维素钠为底物,采用3,5-二硝基水杨酸比色法[13]。以每小时生成1 mg的还原糖作为1个酶活单位。
果胶甲酯酶:0.5%果胶溶液为底物,采用吸光光度法测量,一个酶活力单位被定义为每分钟释放1 μmol的甲酯所需要的酶量。
可溶性蛋白含量采用考马斯亮兰法测定。
数据利用SPSS17.0软件进行统计和分析。
2 结果与分析
2.1 番茄花梗离区过程解剖学分析
番茄种子发芽后,继续保持营养生长,当长到7~8片真叶时,生长点就停止了叶的分化开始进入花芽分化。由图版Ⅰ-1和Ⅰ-2可以看出,这时期的芽还不能分辨出是花芽还是叶芽,且有离层品种与无离层品种间也无差别。
由于花芽芽体肥大饱满,顶端圆钝,而叶芽则芽体较小,顶端细长。由图版Ⅰ-3和Ⅰ-4可看出,此时的生长点呈圆锥形突起,且生长点顶部肥厚隆起,上端扁平,此时的芽原基开始形成花芽,植株进入花芽分化初期,开始从营养生长时期转入到生殖生长时期。在花芽分化初期离层分化不明显,基本上还未开始进行离层的分化。
当番茄花芽分化进入中期时,无离层品种的花芽梗和有离层品种的花芽梗在解剖学有一定差异。由图版Ⅰ-5和Ⅰ-6可以看出,无离层品种花芽梗中部发育平滑无任何断带,而有离层品种花芽梗中部有一条隐约可见的断带。
随着花的发育,当番茄花芽分化进入后期时,无离层品种花梗细胞排列都非常有序,并无断层出现(见图版Ⅰ-7);而有离层品种花梗中部的断带也变得清晰可见(见图版Ⅰ-8),这说明离层也是随着花的发育而逐步形成的。
当番茄花完全开放时(见图版Ⅰ-9和Ⅰ-10),无离层品种的花梗细胞排列紧密有序并无断层出现(见图版Ⅰ-11);而有离层品种的花梗发育膨大,离层凹陷变得更明显且断带更加清晰,断带是由比周围小而且密的细胞组成的,此断带就是我们所说的离层(见图版Ⅰ-12)。而且从植株外观上可以看出,有离层品种花梗上有膨大的结,中央有一圈凹陷,此区域就是离区(见图版Ⅰ-12),但无离层品种的花梗没有这种结(见图版Ⅰ-11)。
2.2 花梗离区部位生理指标的测定
2.2.1 有离层品种与无离层品种离区部位多聚半乳糖醛酸酶含量的差别
多聚半乳糖醛酸酶与离层的产生有着重要关系。由图1可知,不仅无离层品种(08003、08004、08016)间多聚半乳糖醛酸酶含量差异不显著,而且离层品种(08052、09872、09874)间多聚半乳糖醛酸酶含量差异也不显著。然而离层品种多聚半乳糖醛酸酶活性显著高于无离层品种,说明多聚半乳糖醛酸酶含量高可以促使离层的产生。
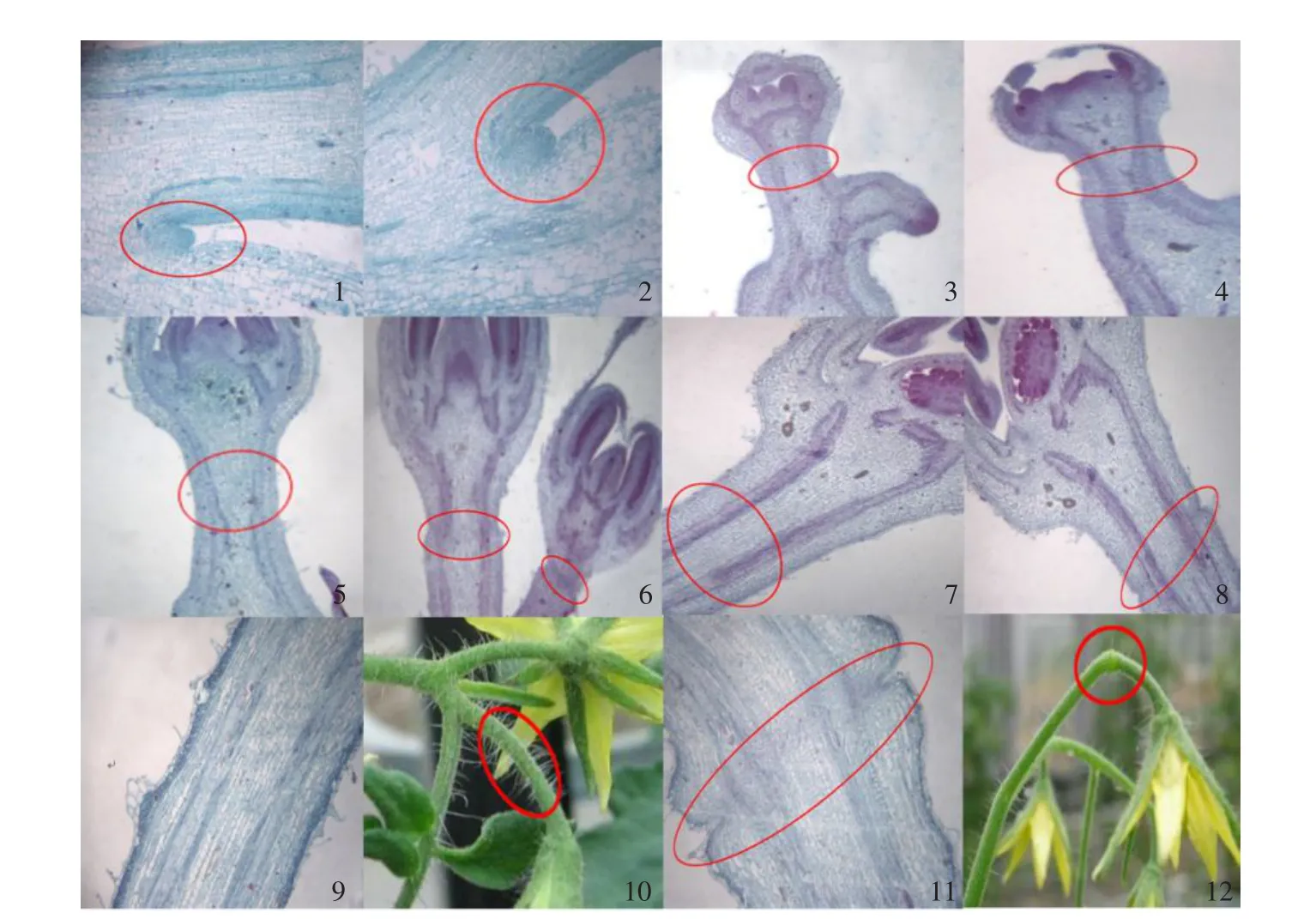
图版I 有离层品种与无离层品种离区解剖结构对比Plate I Abscission zone anatomy structural comparison between cultivars with and without abscission layers
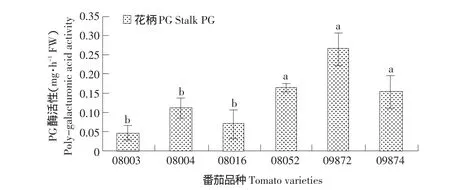
图1 有离层品种与无离层品种离区部位多聚半乳糖醛酸酶活性Fig.1 Poly-galacturonic acid activity in abascission zone of cultivars with and without abscission layers
2.2.2 有离层品种与无离层品种花梗的纤维素酶含量的差别
纤维素酶在细胞壁的酶解进程中起着重要作用,从而促使离层的产生。由图2可知,无论是无离层品种(08003、08004、08016),还是离层品种(08052、09872、09874),它们的纤维素酶活性差异均不显著。然而离层品种与无离层品种的纤维素酶活性差异显著,且离层品种花梗的纤维素酶活性显著高于无离层品种。
2.2.3 有离层品种与无离层品种离区部位果胶甲酯酶活性的差别
果胶甲酯酶的作用是去除果胶分子链上半乳糖醛酸基上的酯化基团,增加果胶在水中的溶解度,降解细胞壁。由图3可知,同花梗的纤维素酶活性一样,无离层品种(08003、08004、08016)间果胶甲酯酶活性差异不显著,离层品种(08052、09872、09874)间果胶甲酯酶活性差异显著。然而离层品种与无离层品种中的果胶甲酯酶活性呈差异显著,且其活性明显高于无离层品种。
2.2.4 有离层品种与无离层品种可溶性蛋白含量的差别
由图4可知,虽然无离层品种(08003、08004、08016)间可溶性蛋白含量差异显著,有离层品种(08052、09872、09874)间的可溶性蛋白含量差异不显著。但无离层品种可溶性蛋白含量要高于有离层品种。
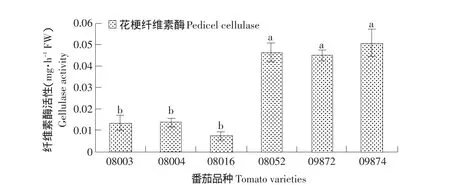
图2 有离层品种与无离层品种离区部位纤维素酶活性Fig.2 Ce11u1ase activity in the abascission zone of cultivars with and without abscission layers
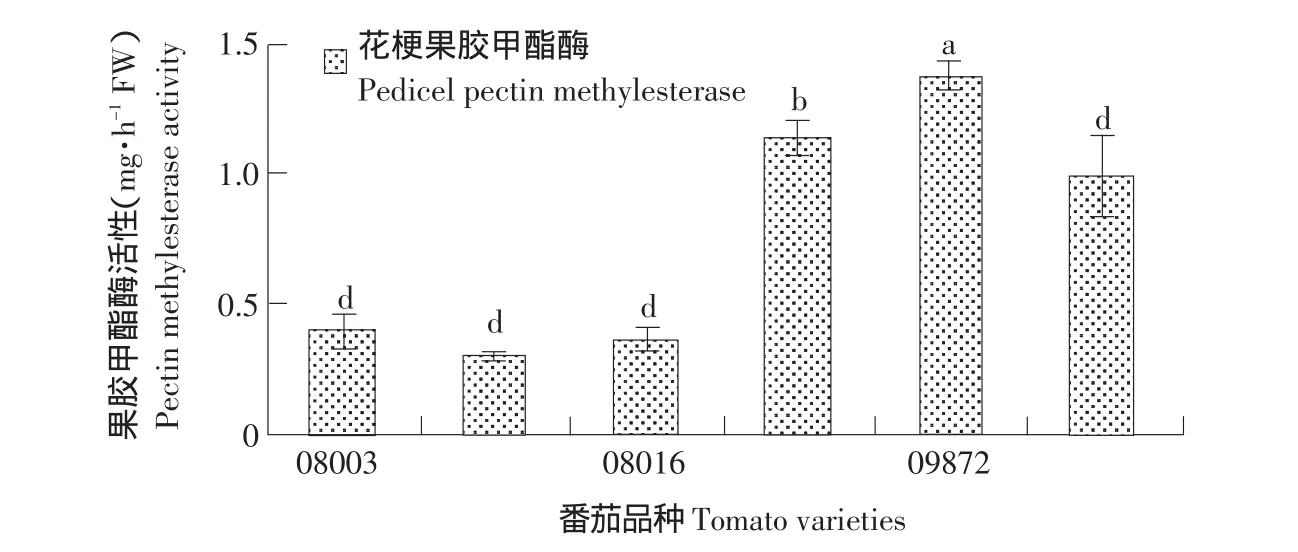
图3 有离层品种与无离层品种离区部位果胶甲酯酶活性Fig.3 Pectin methylesterase activity in the abscission zone of cultivars with and without abscission layers
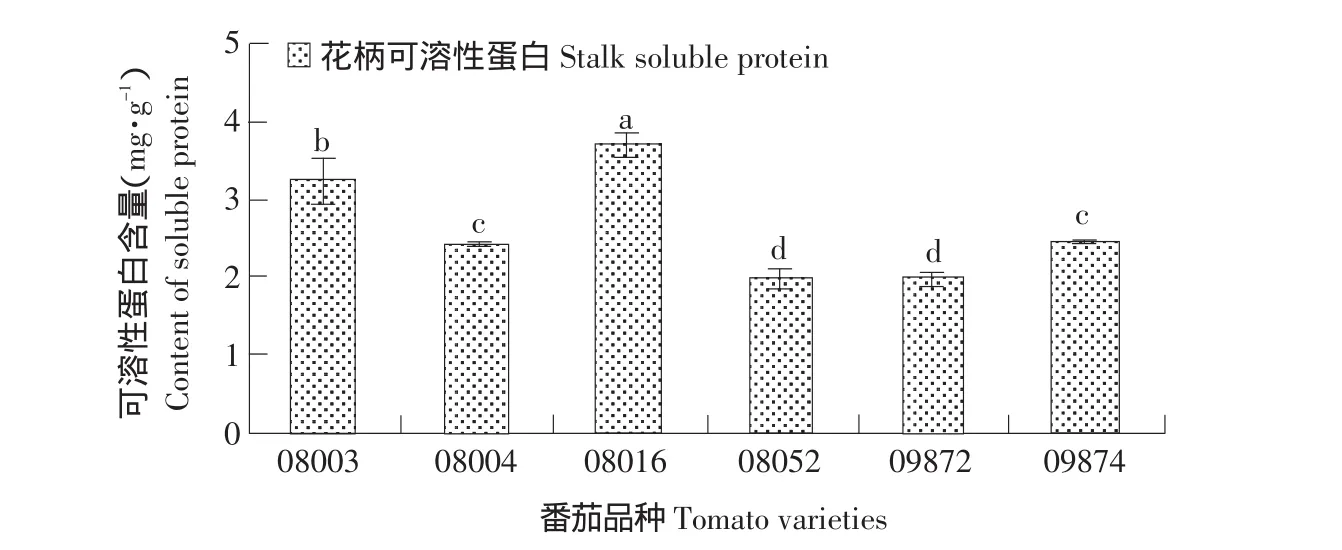
图4 有离层品种与无离层品种离区部位可溶性蛋白含量Fig.4 Content of soluble protein in the abscission zone in cultivars with and without abscission layers
3 讨论与结论
脱落与离层密切相关,器官的脱落必有离层的产生,但有离层的器官不一定会有脱落现象的发生。由本试验可以看出,离层始终是伴随着花的产生,花的开放乃至结果。分化程度作为一种重要的脱落前提存在[14-15]。
由解剖图片可知,离层是由数层小细胞组成的一个完整的贯穿整个花梗部位的细胞层。曾经有人认为离层就是原本脆弱的连接点,后来经过测定诱导初期脱落器官或组织的折断强度变化,发现事实并非如此[16]。在试验取材、处理材料的过程中,花梗的离层处基本上都不断裂,这点证明了离层并不是脆弱的连接点。对多种园艺植物花器离区的解剖显示,不同植物花器离层细胞大小有3种类型:①离层细胞比邻近细胞小,大多等径[17],②离层细胞比邻近细胞小,大多长方形;③离层细胞大小与相邻细胞近似[18]。不同植物细胞大小为何不同,到底有何作用尚需要进一步探讨。
本试验先通过解剖学来初步认识和了解离层的产生过程,通过测定加工番茄花期离层部位生理生化各指标的差异来进一步研究细胞壁降解酶及可溶性蛋白对离区的影响。由试验可知,无离层品种(08003、08004、08016)间的各细胞壁降解酶活性差异不显著,且其活性较低,说明无离层品种花梗部位该酶的表达量较少,未达到对花梗细胞产生影响。离层品种(08052、09872、09874)间的细胞壁降解酶的活性个别有差异性,这是品种所特有的差异造成的。但这并不影响与无离层品种的对照研究,PG、纤维素酶和果胶甲酯酶的活性在离层品种中是在无离层品种中活性的5倍左右,正是由于离层品种中有如此高活性的酶作用于离区细胞,所以能够清晰看到与周围细胞不同的离层。此外研究者认为,花梗离层是由复杂的细胞壁降解酶系统共同作用结果,非由少数几种酶单独完成[19],了解这个酶系统的成员及其作用顺序是了解离层特性的必要步骤。
本试验所测的有无离层品种可溶性蛋白含量的变化趋势完全与酶活含量相反,可溶性蛋白的含量与细胞壁降解酶的活性呈负相关,其原因有待于进一步研究。
[1]Taylor J E,Whitelaw C A.Signals in abscission[J].Newphytol,200l,151:323-339.
[2]Van G W.Stead A D.Abscission of flower sand floral parts[J].Journal of Experimental Botany,1997(48):821-837.
[3]Gawadi A G,Avery G S.leaf abscission and the so called abscission layer[J].America Tournal of Botany,1950,37:172-180.
[4]Mackenzie K A D.The structure of the fruit of the red raspberry in relation to abscission[J].Annals of Botany,1979,43:355-362.
[5]Sexton R,Redshaw A J.The role of cell expension in the abscission of impatiens sultani leaves[J].Annals of Botany,1981(48):745-756.
[6]Clements J C,Atkins C A.Characterization of a non-abscission mutant in Lupinus angustifolius L.:Physiological aspects[J].Annals of Botany,2001,88(4):629-635.
[7]Bonghi C,Rascio N,Ramina A,et al.Cellulase and polygalacturonase involvement in the abscission of leaf and fruit explants of peach[J].Plant Molecular Biology,1992,20(5):839-848.
[8]王彦昌,李天来.园艺植物花器官脱落研究进展[J].园艺学报,2002(增):613-618.
[9]Osborne D J.Acceleration of abscission by a factor produced in senescent leaves[J].Nature,1955,176:1161-1163.
[10]Abeles F B,Rubinstein B.Regulation of ethylene evolution and leaf abscission by auxin[J].Plant Physiology,1964,39(6):963-969.
[11]胡宝忠,常缨.植物学实验[M].北京:中国农业出版社,2003.
[12]Riov J.A polygalacturonase from citrus leaf explant[J].Plant Physiology,1974,53:312-316.
[13]Artes F,Cano A,Fern T.Pectolytic enzyme activity during intermittent warming storage of peaches[J].J Food Sci,1996,61(2):311-313.
[14]田渊俊人.の小花柄における离层の形成と[J].达园学杂,1999(68):993-999.
[15]Tabuchi T,Ito S.Development of the abscission zones in j22 in pedicels of galapages wild tomatoes[J].Japan Soc Hort Sci,2000(69):443-445.
[16]Del C E,Bennett A B.Pedicel break strength and cellulase gene expression during tomato flower abscission[J].Plant Physiology,1996,111(3):813-820.
[17]Evensen K B,Page A M,Stead A D.Anatomy of ethyleneinduced petal abscission in Pelargonium×Hortorum[J].Annals of Botany,1993,71(6):559-566.
[18]Roberts J A,Schindler,Lewis L N,et al.Ethylene promoted tomato flower abscission and the possible involvement of an inhibitor[J].Planta,1984(160):159-163.
[19]Osborne D J.Acceleration of abscission by a factor produced in senescent leaves[J].Nature,1955,176:1161-1163.

