分蘖洋葱ISSR-PCR扩增体系的建立
刘淑芹,吴凤芝,刘守伟,潘 凯
(东北农业大学园艺学院,哈尔滨 150030)
分蘖洋葱(Allium cepa L.var.multiplcans Bailey syn.var.Agrogatum Don)为葱科(Alliaceae)葱属(Allium)草本植物,又称毛葱、珠葱,一年生草本葱蒜类蔬菜,是洋葱种质资源重要组成部分[1]。鳞茎中含有特殊辛辣味的挥发性硫化物,具有杀毒消菌作用[2],种植面积逐年增加。但是现有栽培的分蘖洋葱多为表现良好的品系或农家品种,应用于生产推广的品种很少,加之分蘖洋葱为营养体繁殖,每年种用毛葱的存贮问题,费工费力,效果不佳,在生产上也限制其大面积推广[3]。因此,加速分蘖洋葱的品种筛选与鉴定,促进新品种的繁育以及杂交亲本合理选择选配,进而实现分蘖洋葱种子繁殖是解决问题的关键。而了解分蘖洋葱的遗传背景和DNA指纹图谱构成,确定不同品种的遗传多样性,明确分蘖洋葱资源的亲缘关系和分类地位,是实现这一目标的必要前提。
ISSR(Inter simple sequence repeat)是利用一条包含简单重复序列,并在3'或5'端锚定的寡聚核苷酸引物,对SSR(微卫星)之间一段短DNA序列进行PCR扩增的一种新型分子标记技术[4-7]。由Zietkiewicz等提出并逐渐应用开来,为显性标记,符合孟德尔式遗传规律。相对SSR等其他分子标记方法,操作技术比较简单,获得结果快、成本低[7],加之其具有分布广泛且变异快的特点,ISSR标记较其他分子标记方法可获得更多基因位点的差异。这些特点使其产生后迅速发展,近年来在多种作物中都有应用,例如水稻、茄子、小麦、柑橘、松树等[8-12],为作物的DNA指纹图谱构建、遗传多样性分析、特殊基因定位、核心种质保存利用等提供强有力的分子生物学理论基础和技术支撑。
ISSR技术在分蘖洋葱上的应用尚未见报道。本研究以分蘖洋葱叶片DNA为研究对象,对ISSR-PCR扩增体系中退火温度、Mg2+浓度、dNTP浓度、Taq酶含量以及引物浓度等各因素进行筛选和优化,以期明确适用于分蘖洋葱ISSR分析的最佳反应体系,为ISSR分子标记技术在分蘖洋葱遗传多样性分析、遗传图谱构建、核心种质保存利用等方面的应用提供技术支撑和理论基础。
1 材料与方法
1.1 材料
分蘖洋葱品种来自依安、五常、绥化,2010年10月16日在东北农业大学园艺实验站日光温室进行盆栽试验。选择成熟度好、大小均匀一致,无病虫害的分蘖洋葱鳞茎,用10 cm×10 cm的营养钵栽植,每钵栽1株,每品种10株,3次重复,置于全光温室中培养,昼温28℃,夜温15°C,常规栽培管理。于幼苗期(出苗后10~15 d)取分蘖洋葱幼嫩筒状叶片,液氮速冻后于超低温-80℃保存。
ISSR引物由上海生工合成,序列来自加拿大哥伦比亚大学,分别为840:GAGAGAGAGAGAGA GAYT; 809: AGAGAGAGAGAGAGAGG。 Marker采用DL2000,Mg2+、Taq酶等试剂,均为MBI公司产品。
1.2 方法
1.2.1 基因组DNA提取
采用植物基因组DNA试剂盒(北京TIANGEN试剂公司)提取植物DNA。分别在260和280 nm处检测所提取基因组DNA的OD值,根据OD260/OD280值判断其纯度,然后再用1.2%琼脂糖凝胶对其进行电泳,在紫外检测仪上观察其纯度并判断DNA分子的大小及浓度一致性[13]。
1.2.2 ISSR-PCR反应参数的优化
以ISSR引物840的Tm值为基础,设置4个退火温度(54、56、58、60℃),采用分蘖洋葱叶片DNA为模板进行PCR扩增,并依据PCR扩增谱带有无和清晰度确定最适引物退火温度。
采用筛选出来的适宜退火温度,对影响ISSR-PCR反应各因素进行优化,进而确定适宜PCR扩增条件。引物为ISSR 809和840,反应总体积为25 μL。其中,DNA模板量设置6个水平:10、20、30、40、50、60 ng;5 mmol·L-1引物浓度设置3个添加量水平:1、2、3 μL;2.5 mmol·L-1dNTP 添加量设置 5个水平:1、2、3、4、5 μL;25 mmol·L-1MgCl2添加量设置5个水平:1.5、2.0、2.5、3.0、3.5 μL;5 U·μL-1Taq酶用量也设置5个水平:0.2、0.3、0.4、0.5、0.6 μL。
1.2.3 ISSR-PCR产物扩增条件及检测方法
PCR产物扩增条件:94℃预变性5 min,随后45个循环,每循环94℃变性30 s,57.5℃退火30 s,72℃延伸90 s,最后1个循环后72℃延伸10 min。扩增产物在1.2%琼脂糖凝胶(含有机染料Goldenview 0.5 μg·mL-1)中以5 V·cm-1的电压电泳分离,经全自动凝胶成像系统Syngene Gene Genius观察、照像。
2 结果与分析
2.1 引物退火温度对ISSR-PCR扩增反应的影响
试验设置4个退火温度(54、56、58、60℃),进行PCR扩增(见图1)。结果表明,随着引物840退火温度升高,扩增谱带亮度明显提高,其中在54℃时,发生部分条带的缺失;而58和60℃时则出现扩增结果弥散、背景增强的现象。为保证ISSR扩增结果的稳定性和特异性,确定引物最适退火温度为56℃。
2.2 不同PCR参数对ISSR-PCR扩增反应的影响
2.2.1 引物剂量
采用引物809、840对三个分蘖洋葱品种进行PCR扩增,筛选引物(5 mmol·L-1)在体系中最佳剂量。结果表明,在25 μL反应条件下,2~3 μL引物添加量,均可扩增出全部产物,但引物剂量小于2 μL时,PCR扩增产物量很少,谱带带型较弱,而3 μL时扩增产物PCR谱图清晰,扩增完全,多态性好,效果最佳,因此引物在反应体系中最适添加量确定为3 μL(见图2)。

图1 引物退火温度对ISSR-PCR的影响Fig.1 Effect of primer annealing temperature on ISSR-PCR

图2 引物浓度对ISSR-PCR的影响Fig.2 Effect of primer concentration on ISSR-PCR
2.2.2 模板剂量
采用引物840对三个分蘖洋葱品种进行PCR扩增,筛选DNA模板量在体系中最佳用量。结果如图3所示,10~60 ng的DNA模板用量均有PCR扩增结果,但低于20 ng的DNA模板所扩增出来的产物逐渐变少,而高于40 ng的DNA模板未对PCR扩增结果产生本质影响,所以在保证试验结果的前提下,考虑到经济原则,尽量缩减DNA用量,最终确定最适DNA模板量为40 ng。
2.2.3 dNTP剂量
采用引物809、840对三个分蘖洋葱品种进行PCR扩增,筛选dNTP(2.5 mmol·L-1)在体系中最佳用量。高浓度的dNTP易产生错误扩增片段掺入,浓度过高还将出现不扩增现象;但过低的dNTP量,则出现扩增产物量降低的现象。由图4可看出,1~5 μL的添加量中,3 μL的dNTP即可扩增出全部产物,且条带清晰,无拖尾等问题。最终确定最适dNTP量为3 μL。
2.2.4 Mg2+浓度的确定
Mg2+浓度是影响PCR扩增的重要因素,它的含量多少直接影响PCR扩增的特异性和产量[11]。通常情况下,Mg2+浓度的增加可提高PCR产物量,且伴有非特异性扩增的产生,最终降低结果的真实性。
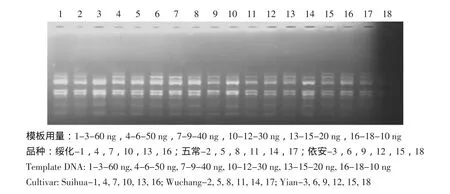
图3 DNA模板量对ISSR-PCR的影响Fig.3 Effect of DNA concentration on ISSR-PCR
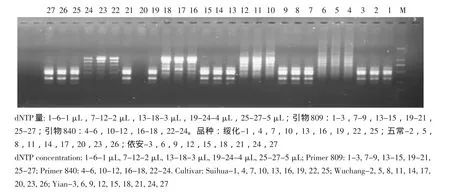
图4 dNTP浓度对ISSR-PCR的影响Fig.4 Effect of dNTP concentration on ISSR-PCR
图5为Mg2+浓度在体系中不同添加量的筛选结果,1.5 μL的Mg2+浓度,PCR扩增不完全,谱带少,产量低;随Mg2+添加量的不断增加,扩增样品的背景也不断加深,引物840在3.0 μL的Mg2+浓度时出现了明显的带型弥散现象。为保证结果确定2.0 μL的Mg2+为最适用量。
2.2.5 Taq酶用量的确定
Taq酶用量是影响PCR反应的另一个重要因素,其对扩增产物的产量有直接影响[11]。本试验中Taq酶用量设置为0.2~0.6 μL。扩增结果见图6,从0.2~0.6 μL各用量Taq酶均可扩增出谱带,且随着酶用量的增多,扩增产物清晰度和产量均有所升高。但高浓度(0.5、0.6 μL)Taq酶用量反而扩增出较弱的带型。本着确保最佳效果和最低成本原则,确定Taq酶最佳用量为0.4 μL。
2.3 ISSR-PCR优化体系的应用
将筛选后的各条件进行组合,采用引物809和840对三个分蘖洋葱品种进行PCR扩增,检测优化体系的适用性。结果见图7,两个ISSR引物对三个分蘖洋葱品种扩增出的条带清晰、重复性好,而且只采用ISSR 809即可将三个分蘖洋葱品种加以区别,表明优化后的PCR反应体系稳定可靠,可在分蘖洋葱品种的遗传多样性分析、遗传图谱构建等研究中应用。
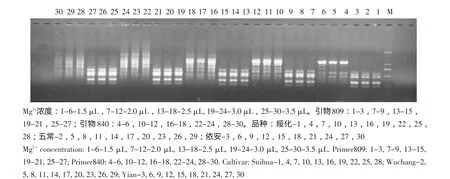
图5 Mg2+浓度对ISSR-PCR的影响Fig.5 Effect of Mg2+concentration on ISSR-PCR
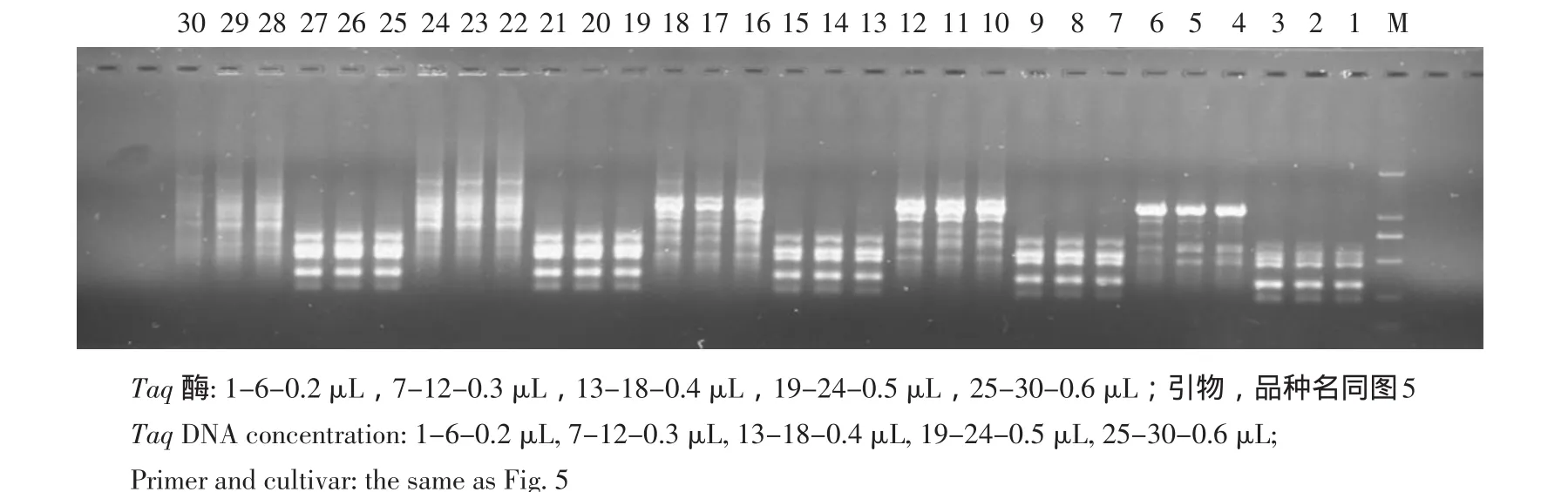
图6 Taq酶用量对ISSR-PCR的影响Fig.6 Effect of Taq DNA polymerase on ISSR-PCR
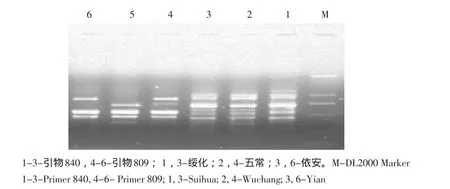
图7 引物809和840的PCR扩增结果Fig.7 ISSR-PCR results of prime 809 and 840
3 讨论与结论
合适的体系反应参数是进行良好ISSR-PCR扩增的首要前提[11]。其中,DNA模板量是影响反应条件的重要因素之一,具有纯度高、质量好的DNA模板才能有效进行PCR扩增。一般认为具有1.6~1.9吸光值(A260/A280)DNA才能符合基本扩增需要,需注意的是DNA提取后存放时间过久,DNA的降解会导致扩增失败;Mg2+浓度是第二个重要因素,它对Taq酶活性具有绝对性的影响,从而制约着PCR扩增产物量,其浓度对Taq酶具有双重作用,低浓度时,不能对酶起到活化作用,高浓度反而会使酶活性产生抑制作用;引物浓度为第三个因素,总体原则是适量使用,因其在体系中量过少,会引起PCR扩增产物少,并出现扩增谱带弱,亮度不达标现象,而量过多时将会产生非特异性谱带;第四个重要因素是dNTP的浓度,作用效果类似于引物浓度,dNTP的浓度过低,扩增产物偏少,条带亮度不够,扩增不完全,浓度过高时,产生错误扩增条带的渗入,干扰正常的PCR结果。为此,要本着确保扩增完全,谱带清晰,多态性良好,且具有较好重复性,兼顾低成本的原则,构建合适的ISSR-PCR反应体系。
本试验对影响ISSR-PCR扩增反应的Mg2+浓度、dNTP浓度、Taq酶含量、引物浓度、模板DNA量和退火温度的最佳条件进行筛选和优化,初步建立适合分蘖洋葱植物ISSR反应体系,即DNA模板量40 ng(2 μL), 10 × PCR Buffer 3 μL, Mg2+(2.5 mmol·L-1)2.0 μL,dNTPs(2.5 mmol·L-1) 3 μL,引物(5 mmol·L-1)3 μL,Taq 酶(5 U·μL-1)0.4 μL,最适退火温度为56℃。扩增反应条件为:94℃预变性5 min,随后45个循环,每循环94℃变性30 s,57.5℃退火30 s,72℃延伸90 s,最后1个循环后72℃延伸10 min。
[1]巴红梅,赵研.洋葱的保健功能和产品开发[J].农产品资源,2008(2):39-41.
[2]杨晓红,刘银燕,刘丽娟,等.分蘖葱头中新黄酮苷的结构鉴定[J].药学学报,2000,35(10):752-755.
[3]徐启江,闫海芳,张旸.分蘖洋葱脱毒种苗繁育技术[M].哈尔滨:东北林业大学出版社,2009:1-5.
[4]Zietkiewicz E,Rafalski A,Labuda D,et al.Genome fingerprinting by simple sequence repeat(SSR)anchored polymerase chain reaction amplification[J].Genomics,1994,20:176-183.
[5]Gupta P K,Varshney R K.The development and microsatelite markers for genetic analysis and breeding with emphasis on bread wheat[J].Euphytica,2000,113:163-185.
[6]钱韦,葛颂,洪德元,等.采用RAPD和ISSR标记中国疣粒野生稻的遗传多样性[J].植物学报,2000(7):741-750.
[7]齐靖.鸭梨ACC氧化酶基因克隆及反义转化与枣遗传连锁图谱加密的研究[D].保定:河北农业大学,2009.
[8]Reddy M P,Sarla N,Siddiq E A.Inter simple sequence repeat(ISSR)polymorphixm and itsapplication plantbreeding[J].Euphytica,2002,128:9-17.
[9]Taamalli W,Geuna F,Banfi R,et al.Agronomic and molecular analyses for the characterization of accessions in Tunsisiano live germplasm collections[J].Electronic Journal of Biotechnology,2006,9(5):467-481.
[10]Semagn K,Ndjiondjo P N,Cissoko M.Microsatellites and agronomic traits for assessing genetic relationships among 18 new rice for Afica(NERICA)varieties[J].African Journal of Bio technology,2006,5(10):800-810.
[11]齐靖,董祯,申连英,等.枣ISSR扩增体系的建立[J].华北农学报,2008,23(增):209-212.
[12]李延龙,张明,曹秀敏,等.韭菜ISSR-PCR反应体系的优化[J].河北农业科学,2009(1):91-99.
[13]张维铭.现代分子生物学实验手册[M].北京:科学出版社,2003:249-252.

