Cd(Ⅱ)胁迫对盐藻生长、抗氧化系统及线粒体膜电位的影响
向蓓,赵文,王媛,田丹
(大连海洋大学辽宁省水生生物学重点实验室,辽宁大连116023)
镉 (Cd)是一种毒性很强的重金属污染物,主要来源于冶炼、电镀、蓄电池、采矿等工业排放的废水中,对微生物、植物、动物和人体产生强烈的毒害作用。在Cd(Ⅱ)胁迫下,植物体发生生理应激和防御反应,如合成植物螯合肽 (phytochelatin),以降低Cd(Ⅱ)对机体的伤害[1]。海洋微藻是海洋初级生产力的重要组成者,对水体环境的变化非常敏感,进入水中的重金属等污染物首先作用于藻类,通过食物链传递与富集作用而危害生物健康[2]。已有研究表明,Cd(Ⅱ)能影响藻类的生长代谢,抑制藻类的光合作用,胁迫藻体内产生大量活性氧自由基,导致膜质过氧化,也可诱导藻体内超氧化物歧化酶、过氧化物酶等抗氧化酶活性的升高,在一定程度上清除活性氧自由基,降低细胞的受损程度[3-5]。
Kerr等[6]首次提出了细胞凋亡的概念,人们对细胞凋亡的研究也开始逐渐深入。细胞凋亡在形态学上主要表现为染色质凝聚和片段化、细胞质减少、核片段化、细胞膜发泡形成凋亡小体,死亡细胞很快被邻近细胞吞噬而不留痕迹[7-8]。已有研究表明,Cd(Ⅱ)胁迫能引起烟草悬浮细胞凋亡,这可能是由Cd(Ⅱ)胁迫产生的活性氧物质 (ROS)所导致的[9]。衣藻能在UV-C胁迫后发生凋亡,并克隆得到凋亡基因dad1序列[10]。目前对细胞凋亡的研究多集中在多细胞的动物和植物,对单细胞藻类凋亡的研究还很少,且线粒体作为凋亡调控中心越来越受到人们的重视。盐藻Dunaliella salina是一种独特的单细胞绿藻,无细胞壁,耐盐能力强,培养条件便利,是十分重要的藻类资源。为此,本试验中,作者以盐藻为材料,研究了不同浓度的Cd(Ⅱ)胁迫对盐藻生长、抗氧化系统及线粒体膜电位的影响,旨在为进一步探索重金属胁迫对单细胞藻类的凋亡机理提供参考资料。
1 材料与方法
1.1 材料
试验所用盐藻取自大连海洋大学辽宁省水生生物学重点实验室。海水取自大连市黑石礁近岸海域,沉淀后经0.45 μm筛网过滤,煮沸消毒,冷却曝气后配制培养液,培养液选用f/2营养盐配方。
试验所用重金属镉以CdCl2·2.5H2O形态加入。Rhodamine 123购自Sigma公司。
1.2 方法
1.2.1 Cd(Ⅱ)胁迫处理 试验前,将三角锥瓶预先用高压灭菌锅在120℃下灭菌20 min。用培养液对盐藻进行预培养,当盐藻密度达到1×106个/mL后,将其分装到12个250 mL的三角锥瓶中,每瓶加入100 mL。向藻液中加入已配制好的Cd(Ⅱ)母液,使 Cd(Ⅱ)的终浓度分别为0、0.01、0.10、1.00 mmol/L,分别记为对照组和低、中、高浓度组,每组设3个重复。将三角锥瓶置于光照培养箱中连续培养7 d,温度为 (25±1)℃,光照强度为2 500 lx,光暗周期为12 h∶12 h。
1.2.2 细胞密度的测定 用碘液固定藻液,用血球计数板计数,每瓶藻液取样3次进行计数。
试验进行到第7天,收集藻样并对生理生化指标进行测定。
1.2.3 叶绿素a含量的测定 采用以丙酮为萃取液的分光光度法测定叶绿素a的含量[11],用UV-6300 PC型分光光度计分别测定750、664、647、630 nm波长处的吸光值,并分别用波长664、647、630 nm下测得的吸光值减去750 nm下的吸光值,得到校正后的吸光值E664nm、E647nm、E630nm,按下式计算叶绿素a的含量ρ:
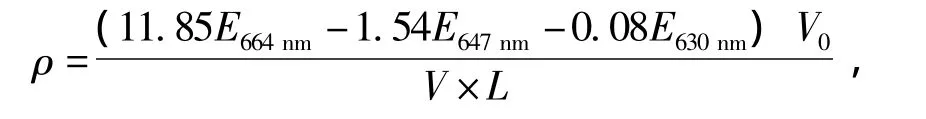
式中:V0为样品提取液的体积 (mL);V为藻液样品实际用量 (L);L为测定池光程 (cm)。
1.2.4 丙二醛、超氧化物歧化酶、总抗氧化力及可溶性蛋白含量的测定 将藻液浓缩40倍后,对收集的藻细胞在冰浴中超声破碎5 min,4℃下以10 000 r/min离心10 min,保留上清液,待测。按照南京建成生物工程研究所生产的试剂盒上注明的方法测定丙二醛 (MDA)、超氧化物歧化酶(SOD)、总抗氧化力活性及可溶性蛋白含量。
1.2.5 用流式细胞术检测线粒体的膜电位 取1 mL藻液,加入5 μL Rhodamine 123(Rh 123,浓度为500 μg/mL),室温下孵育30 min,用海水洗两遍,以去除液体中的Rh 123,用流式细胞仪测定其荧光强度。Rh 123的激发波长为488 nm,发射波长为530 nm。
1.3 数据处理
采用SPSS 16.0统计分析软件对数据进行方差分析,并用LSD法进行多重比较。所有数据均用平均值±标准差来表示。
2 结果与分析
2.1 Cd(Ⅱ)胁迫对盐藻生长的影响
从图1可见:随着时间的延长,各试验组盐藻细胞数均不断增长,在低浓度 Cd(Ⅱ)(0.01 mmol/L)胁迫下,盐藻生长与对照组无显著差异(P>0.05);当Cd(Ⅱ)浓度为0.10 mmol/L时,前5 d与对照组差异不显著,但后两天细胞生长明显受到抑制,与对照组有显著差异 (P<0.05);当Cd(Ⅱ)浓度达到1.00 mmol/L时,盐藻生长明显低于对照组 (P<0.05),说明高浓度的Cd(Ⅱ)能抑制盐藻的生长。
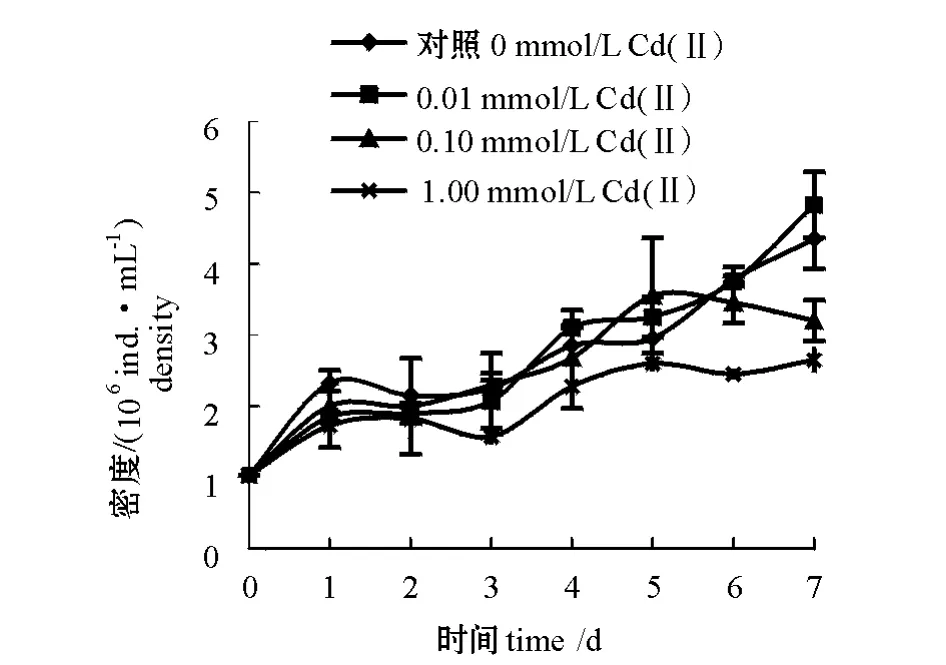
图1 Cd(Ⅱ)胁迫对盐藻生长的影响Fig.1 Effects of Cd(Ⅱ)stress on the growth of alga Dunaliella salina
2.2 Cd(Ⅱ)胁迫对盐藻叶绿素a和可溶性蛋白含量的影响
从表1可见:低、中浓度Cd(Ⅱ)处理组盐藻的叶绿素a含量分别比对照组极显著增加4.57%、48.57%(P<0.01),而高浓度Cd(Ⅱ)组却比对照组极显著降低32.11%(P<0.01);中浓度Cd(Ⅱ)处理组可溶性蛋白含量比对照组极显著增加83.97%(P<0.01),而高浓度Cd(Ⅱ)组却比对照降低4.85%,但差异不显著 (P>0.05)。
2.3 Cd(Ⅱ)胁迫对盐藻SOD活性的影响
经Cd(Ⅱ)处理7 d后,盐藻超氧化物歧化酶活性的变化如图2所示。从图2可见:随着Cd(Ⅱ)浓度的增大,盐藻SOD活性显著增强,中、高浓度Cd(Ⅱ)处理组SOD活性比对照组分别升高70.16%和21.89%,且差异极显著 (P<0.01);而低浓度Cd(Ⅱ)组与对照组差异不显著 (P>0.05)。
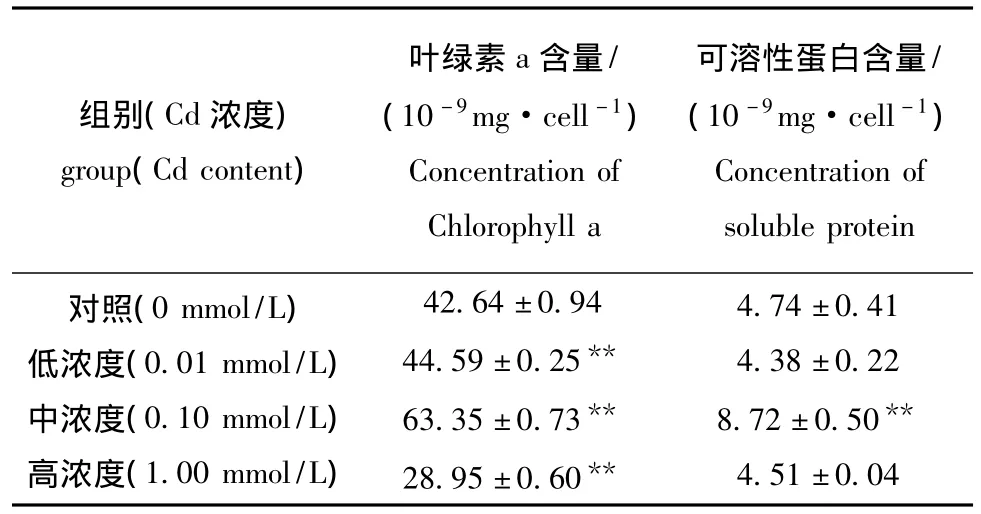
表1 Cd(Ⅱ)胁迫对盐藻叶绿素a和可溶性蛋白含量的影响Tab.1 Effects of Cd(Ⅱ)stress on the concentration of Chl a and soluble protein in Dunaliella salina

图2 Cd(Ⅱ)胁迫对盐藻超氧化物歧化酶活性的影响Fig.2 Effects of Cd(Ⅱ)stress on SOD activities in alga Dunaliella salina
2.4 Cd(Ⅱ)胁迫对盐藻丙二醛含量的影响
经Cd(Ⅱ)处理7 d后,盐藻中丙二醛含量的变化如图3所示。从图3可见:低、中、高浓度Cd(Ⅱ)处理组盐藻中丙二醛含量分别比对照组升高61.98%、125.00%、35.94%,且差异极显著(P<0.01),表明Cd(Ⅱ)能引起盐藻细胞膜质过氧化损伤。
2.5 Cd(Ⅱ)胁迫对盐藻总抗氧化力的影响
经Cd(Ⅱ)处理7 d后,盐藻总抗氧化力的变化如图4所示。从图4可见:低浓度Cd(Ⅱ)处理组盐藻总抗氧化力低于对照组,但差异不显著 (P>0.05);中浓度Cd(Ⅱ)处理组总抗氧化力极显著高于对照组 (P<0.01);高浓度Cd(Ⅱ)处理组的总抗氧化力与对照组无明显差异 (P>0.05)。

图3 Cd(Ⅱ)胁迫对盐藻丙二醛含量的影响Fig.3 Effects of Cd(Ⅱ)stress on concentration of MDA in alga Dunaliella salina
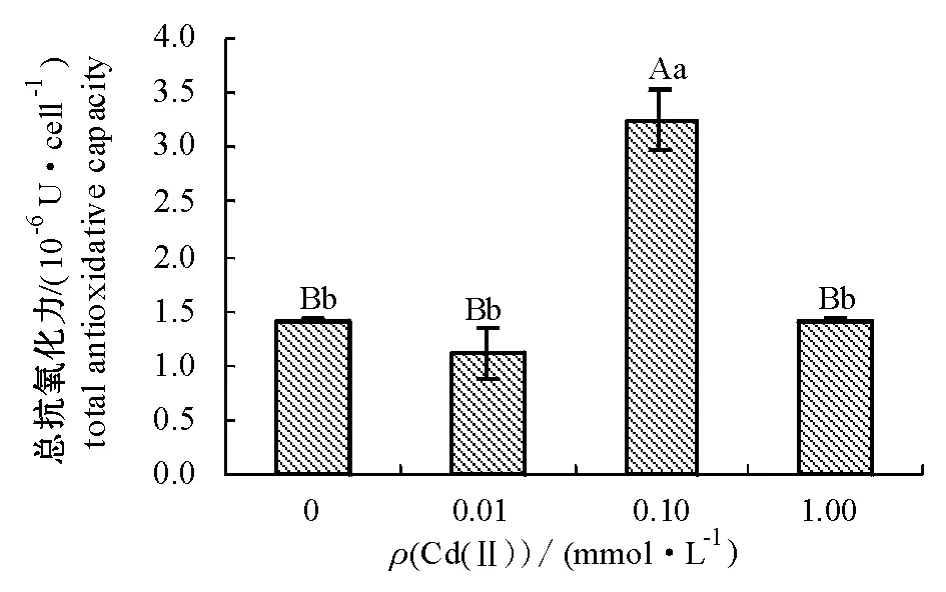
图4 Cd(Ⅱ)胁迫对盐藻总抗氧化力的影响Fig.4 Effects of Cd(Ⅱ)stress on total antioxidative capacity in alga Dunaliella salina
2.6 Cd(Ⅱ)胁迫对盐藻线粒体膜电位的影响
经Cd(Ⅱ)处理7 d后,盐藻线粒体的膜电位变化如图5所示。由图5可见,经Cd(Ⅱ)胁迫后盐藻细胞线粒体膜电位有下降趋势,但差异不显著(P >0.05)。
3 讨论
随着Cd(Ⅱ)浓度的升高,盐藻单位细胞内叶绿素a和可溶性蛋白含量均呈现先升高再下降的趋势。0.10 mmol/L的Cd(Ⅱ)处理组盐藻叶绿素a含量显著升高,可能是由于较低浓度的Cd(Ⅱ)在一定程度上刺激了藻体叶绿素的合成。而1.00 mmol/L的Cd(Ⅱ)处理组盐藻叶绿素a含量急剧下降,其机理可能是:经高浓度Cd(Ⅱ)胁迫后能引起叶绿体膨胀破裂,类囊体膜解体,从而导致叶绿素从组织中流失[5];也可能是与Cd(Ⅱ)抑制叶绿素酸酯还原酶活性和影响氨基-γ-戊酮酸的合成有关,而这两种物质分别是叶绿素合成所必需的酶和前体[12]。可溶性蛋白含量是植物体代谢过程中的重要指标,可反映细胞内蛋白质的合成、变性及降解等信息[13]。本研究结果表明,0.10 mmol/L Cd(Ⅱ)处理组盐藻可溶性蛋白含量比对照组显著升高。这可能是较低浓度的Cd(Ⅱ)诱导细胞产生一些抗性蛋白,如金属硫蛋白等,而这些抗性蛋白能吸附重金属离子,降低重金属离子对生物体的毒害[14]。但当Cd(Ⅱ)达到1.00 mmol/L时,可溶性蛋白含量下降,蛋白质被破坏。这可能是Cd(Ⅱ)与蛋白相结合的直接作用,也可能是以DNA为靶点,限制基因表达,从而影响蛋白质的合成[15]。
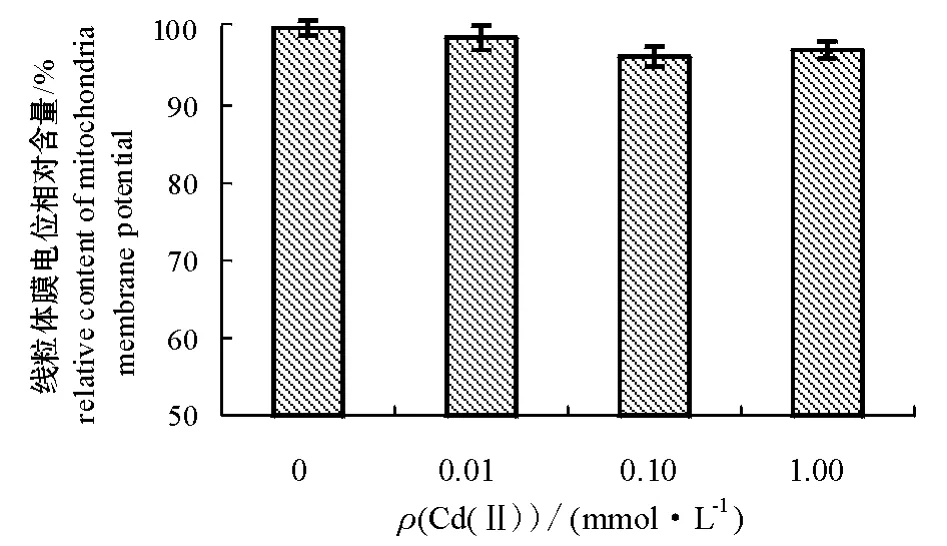
图5 Cd(Ⅱ)胁迫对盐藻线粒体膜电位的影响Fig.5 Effects of Cd(Ⅱ)stress on mitochondrial membrane potential in alga Dunaliella salina
丙二醛是多不饱和脂肪酸过氧化产物之一,其含量的变化可以反映膜氧化的损伤程度。丙二醛对细胞有毒性,能引起细胞膜功能紊乱,且对许多功能分子有破坏作用,因此,丙二醛含量的增加是细胞损伤的直接原因[16]。本试验中丙二醛含量先随Cd(Ⅱ)浓度的增大而升高,说明Cd(Ⅱ)浓度越大对细胞膜系统的损伤也越大。之后当Cd(Ⅱ)浓度达到1.00 mmol/L时,丙二醛含量下降但仍高于对照组,可能是盐藻受到不可逆损伤,导致细胞内代谢速率大幅度下降[17]。
细胞受到胁迫后会产生活性氧物质 (ROS),如超氧根 (·)、氢氧根 (OH-)、羟自由基(·OH)、过氧化氢 (H2O2)等,这些活性氧物质能破坏脂膜类物质、蛋白质以及核酸,而超氧化物歧化酶是生物体内清除超氧阴离子自由基 (·)的唯一酶类[18-19]。本试验中,在 Cd(Ⅱ)胁迫下,盐藻超氧化物歧化酶活性均高于对照组,且随着Cd(Ⅱ)浓度的升高呈上升趋势,表明盐藻对Cd(Ⅱ)的胁迫有一定的耐受性。这与田丹等[20]的研究结果不同,可能是因为盐藻比普通小球藻和湛江等鞭金藻耐受Cd(Ⅱ)的能力更强。在本试验中Cd(Ⅱ)的设定浓度范围内,盐藻的超氧化物歧化酶活性可被诱导而升高。Cd(Ⅱ)进入盐藻细胞后会导致丙二醛的含量升高,而·与丙二醛含量变化具有相关性[17],因此,细胞内产生了较多的·,而·可诱导超氧化物歧化酶的活性,即超氧化物歧化酶清除·的能力增强,因而使·能得到及时清除,从而降低·对细胞的氧化损伤。
总抗氧化力是用于衡量机体氧化系统功能状况的综合性指标,其变化可以反映机体抗氧化酶系统和非酶系统性能的状态,从总体上反映机体防御体系抗氧化能力的高低[21]。本试验结果表明,当Cd(Ⅱ)达到0.10 mmol/L时,盐藻的总抗氧化力增强。其原因可能是较低浓度的Cd(Ⅱ)诱导细胞产生过多的活性氧物质,进而启动细胞防御反应,使得总抗氧化力暂时升高。当Cd(Ⅱ)的浓度增大到1.00 mmol/L时,对一些抗氧化酶类产生抑制,从而使细胞的总抗氧化力降低。
近年来,线粒体作为细胞凋亡的调控中心越来越受到人们的重视。线粒体跨膜电下降被认为是细胞凋亡的共同途径。在正常情况下,机体内活性氧的产生和清除系统处于一种动态平衡状态,当这种平衡被打破时,活性氧水平较高,线粒体通透性转运孔开放,导致膜电位丢失,各种凋亡促进因子释放到胞质中,激活caspase,诱导凋亡发生[22-24]。本试验结果表明,随着Cd(Ⅱ)浓度的增加,盐藻细胞线粒体膜电位呈下降趋势,但各处理组与对照组差异不显著。这可能是因为本试验中Cd(Ⅱ)的胁迫浓度较低,盐藻对较低浓度的Cd(Ⅱ)表现不十分敏感。
综上所述,一定浓度的Cd(Ⅱ)能抑制盐藻的生长,抑制叶绿素 a及可溶性蛋白的合成;Cd(Ⅱ)进入细胞后,使细胞产生过多的活性氧,导致膜氧化的损伤程度加重,丙二醛含量升高,而活性氧又能诱导超氧化物歧化酶活性升高,超氧化物歧化酶歧化·生成O2和H2O2,从而保护细胞不受到自由基的氧化损伤;细胞活性氧的水平升高,促进了总抗氧化能力提高,从而降低活性氧对细胞的伤害,保护线粒体膜的完整性,维持线粒体膜电位,抑制细胞凋亡的发生。
[1]Tsuji N,Hirayanaqi N,Iwabe T,et al.Regulation of phytochelatin synthesis by zinc and cadmium in marine green alga,Dunaliella tertiolecta[J].Phytochemistry,2003,62(3):453-459.
[2]王文雄,潘进芬.重金属在海洋食物链中的传递[J].生态学报,2004,24(3):599-604.
[3]李春娣,马福俊,龙爱民,等.Cd胁迫对受驯杜氏盐藻生长影响的研究[J].海洋环境科学,2007,26(6):557-560.
[4]Nishikawa K,Yamakoshi Y,Uemura I,et al.Ultrastructural changes in Chlamydomonas acidophila(Chlorophyta)induced by heavy metals and polyphosphate metabolism[J].FEMS Microbiology E-cology,2003,44(2):253-259.
[5]徐勤松,施国新,杜开和,等.Cd(Ⅱ)处理对菹草叶片保护酶活性和细胞超微结构的毒害影响[J].水生生物学报,2003,27(6):584-586.
[6]Kerr J F,Wyllie A H,Currie A R.Apoptosis:A basic biological phenomenon with wideranging implications in tissue kinetics[J].British Journal of Cancer,1972,26(4):239-257.
[7]周晓舟,陈国平.植物细胞程序化死亡的形态学和生理生化特征[J].广西植物,2007,27(3):522-526.
[8]Mittler R,Lam E.Identification,characterization,and purification of a tobacco endonuclease activity induced upon hypersensitive response cell death[J].The Plant Cell,1995,7(11):1951-1962.
[9]支立峰,余涛,朱英国,等.镉胁迫引起烟草悬浮细胞程序性死亡[J].武汉植物学研究,2006,24(5):403-407.
[10]Moharikar S,D’Souza J S,Rao B J.A homologue of the defender against the apoptotic death gene(dad1)in UV-exposed Chlamydomonas cells is downregulated with the onset of programmed cell death[J].Journal of Biosciences,2007,32(2):261-270.
[11]赵文.水生生物学[M].北京:中国农业出版社,2005:519-526.
[12]Stobart A K,Griffiths W T,Bukhari I A,et al.The effect of Cd(Ⅱ)on the biosynthesis of chlorophyll in leaves of barley[J].Physiologia Plantarum,1985,63(3):293-298.
[13]邵世光,阎斌伦,许云华,等.Cd(Ⅱ)对条斑紫菜毒害作用的研究[J].河南师范大学学报,2006,34(2):113-116.
[14]Shaw J R,Colbourne J K,Daavey J C,et al.Gene response profiles for Daphnia pulex exposed to the environmental stressor cadmium reveals novel crustacean metallothioneins[J].BMC Genomics,2007(8):477-497.
[15]王焕校.污染生态学[M].北京:高等教育出版社,2000.
[16]翟彩霞,马春红,王立安,等.玉米在诱导抗病过程中丙二醛(MDA)含量的变化[J].玉米科学,2005,13(1):77-78,82.
[17]常福辰,施国新,丁小余,等.Cd2+,Hg2+复合污染下金鱼藻的细胞膜脂过氧化和抗氧化酶活性的变化[J].南京师范大学学报,2002,25(1):44-48.
[18]Li M,Zhu Q,Hu C W,et al.Cobalt and manganese stress in the microalga Pavlova viridis(Prymnesiophyceae):Efects on lipid peroxidation and antioxidant enzymes[J].Journal of Environmental Sciences,2007,19(11):1330-1335.
[19]Chernikova T,Robinson J M,Lee E H,et al.Ozone tolerance and antioxidant enzyme activity in soybean cultivars[J].Photosynthesis Research,2000,64(1):15-26.
[20]田丹,赵文,王媛,等.镉胁迫对两种海洋微藻生长和抗氧化系统的影响[J].大连海洋大学学报,2010,25(5):417-421.
[21]庞战军,周玫,陈瑗.自由基医学研究方法[M].北京:人民卫生出版社,2000:259-271.
[22]Gulbins E,Dreschers S,Bock J.Role of mitochondria in apoptosis[J].Experimental Physiology,2003,88(1):85-90.
[23]Hengartner M O.The biochemistry of apoptosis[J].Nature,2000,407:770-776.
[24]Liu G W,Gong P S,Zhao H G,et al.Effect of low-level radiation on the death of male germ cells[J].Radiation Research,2006,165(4):379-389.

