超声波辅助提取扁核木叶蛋白的工艺优化
梁丽琴 魏学智 段江燕 张晓俊 安 娜
(山西师范大学生命科学学院,临汾 041004)
蛋白质是供给必需的氨基酸以维持生理健康的重要物质,随着食品工业的快速发展及生活水平的提高,全球蛋白质资源紧缺现象日益严重。动物蛋白生产成本较高,且含有胆固醇,不适于高血压及心脏病等病人。植物蛋白营养丰富,必需氨基酸组成与比例均优于动物蛋白,尤其是它不含胆固醇,因而深受食品科学家的青睐。近年来,农产品价格不断上涨,其中豆类产品价格的上涨使得种子蛋白的生产加工成本也逐渐提高。而植物叶蛋白资源丰富,其必需氨基酸的数量和比例均优于大豆饼蛋白[1],因而开发植物叶蛋白具有重要意义。
扁核木(Prinsepia uniflora Batal)为蔷薇科扁核木属的落叶灌木,在山西、陕西、内蒙古、东北等地均有分布。扁核木枝繁叶茂,果实可以食用,种子可以榨油也可以入药,因而在生产、生态和造景观赏方面均有很好的开发应用前景[2]。目前,有关扁核木的开发研究主要集中在育种栽培方面,而关于扁核木的果实及叶的开发研究未见报道。因而,本试验将对扁核木叶蛋白的提取方法进行研究。传统的酸加热法提取叶蛋白效率低,纯度低,且耗时。酶法虽然可以提高效率,但酶价格昂贵,易失活,提取过程也较难控制。超声波能够产生增溶作用[3],提取效率高,提取时间短,且其成本低、设备简单、操作容易,现已被用于大豆蛋白[4-6]、玉米醇溶蛋白[7]、荞麦蛋白[8]、棉籽蛋白[9]、小麦胚芽蛋白[10]及花生蛋白[11]等的辅助提取,因此,本试验将探讨超声波辅助酸加热法提取扁核木叶蛋白,以期为扁核木叶蛋白的食品开发利用提供理论依据。
1 材料与方法
1.1 试验材料
扁核木叶:采自山西临汾龙寺镇;所用试剂均为分析纯。
1.2 仪器与设备
pHS-3C酸度计、HJ-6A数显多头磁力恒温搅拌器:金坛市荣华仪器制造有限公司;HAP-300超声波处理仪:宁波新芝生物科技股份有限公司;LG-24A型高速离心机:北京医用离心机厂;LG10-2.4A型高速冷冻离心机:上海安亭科学仪器厂;数显恒温水浴锅:常州国华电器有限公司;UV-7504c紫外可见分光光度计:上海欣茂仪器有限公司。
1.3 试验方法
1.3.1 扁核木叶的处理
取新鲜的无病虫害扁核木叶,放于洁净的培养皿中,用自来水冲洗3次后,再用蒸馏水洗3次,用滤纸吸去多余水分。
1.3.2 标准曲线的绘制
准确称取10 g扁核木叶,将其剪成0.5 cm长的小段,加石英砂充分研磨后,加入50 mL pH 3.6的磷酸盐缓冲液中,搅拌均匀后于40℃下超声波提取30 min,然后在4 000 r/min离心20 min,取上清液并测定体积,取部分上清液进行半微量凯氏定氮法测定其蛋白质含量,剩余上清液用于制作标准曲线。用考马斯亮蓝法在595 nm波长下测定提取液的吸光度Y[12]。以提取液蛋白质含量为横坐标X,吸光度Y为纵坐标绘制标准曲线,最小二乘法拟合得方程:

1.3.3 扁核木叶蛋白的酸加热提取及超声波辅助提取方法
准确称取2 g新鲜的扁核木叶,将其剪成0.5 cm长的小段,加石英砂充分研磨,按一定液料比加入一定温度下预热的pH磷酸盐缓冲液,在一定温度下搅拌一定时间(超声波处理,功率为50 W),4 000 r/min离心15 min,再将离心液用快速滤纸过滤除去漂浮物,定容至30 mL,用考马斯亮蓝法595 nm波长下测定滤液的吸光值,并计算扁核木叶蛋白含量[13]。
1.3.4 扁核木叶蛋白提取率计算[8]

1.3.5 扁核木叶基本化学成分测定[14]
蛋白质含量测定:凯氏定氮法测定。粗脂肪含量测定:索氏抽提法。水分测定:常压烘干法。
1.4 数据处理
采用Excel软件对单因素试验结果进行数据处理,正交试验结果采用极差分析。
2 结果与分析
2.1 扁核木叶基本化学成分
由表1可知,扁核木叶蛋白占叶片鲜重的5.36%。据资料报道[15],叶蛋白主要包括溶解性好的细胞质蛋白和叶绿体内基质蛋白、线粒体蛋白、难溶的叶绿体结构蛋白、线粒体结构蛋白、核蛋白及细胞壁蛋白、另外还有脱氢酶过氧化物酶及多酚氧化酶等多种酶组成的蛋白质混合体。其中,核酮糖-1,5-二磷酸羧化酶占细胞质蛋白质的70%~80%。

表1 扁核木叶基本化学成分/%
2.2 处理时间对扁核木叶蛋白提取率的影响
设定液料比1∶10,pH 3.6,温度40 ℃为不变因素,处理时间分别为 10、20、30、40、50 min,时间对扁核木叶蛋白提取率的影响如图1。
由图1可知,处理时间在10~50 min之内,用超声波辅助酸溶法提取扁核木叶蛋白,其提取率均远高于传统的酸溶法。在处理时间为10~20 min之间,用超声波辅助法提取时,随着时间的延长,扁核木叶蛋白的提取率与时间呈正相关,超过20 min后,提取率增加不再明显,且逐渐趋于稳定。这可能是由于在10~20 min之内,随着时间的延长,形成的气泡逐渐增多,高频振荡逐渐剧烈,吸收的声能逐渐增大,破壁的效果逐渐增强,蛋白质溶出也逐渐增多。而超过20 min后,随着时间的延长,提取率反而不断下降,这可能是由于超声波的强烈振动及热效应作用导致蛋白变性,从而使叶蛋白水溶性变差。

图1 处理时间对扁核木叶蛋白提取率的影响
2.3 温度对扁核木叶蛋白提取率的影响
设定液料比1∶10,pH 3.6,处理时间30 min 为不变因素,温度分别为30、35、40、45、50 ℃,温度对扁核木叶蛋白提取率的影响如图2。
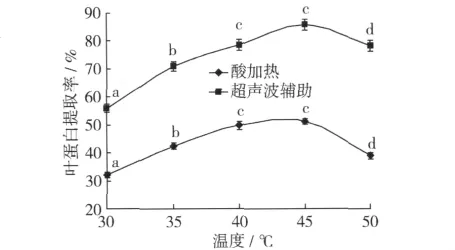
图2 温度对扁核木叶蛋白提取率的影响
由图2可知,在30~45℃之间,随着温度的升高,扁核木叶蛋白的提取率也逐渐增加,当温度为45℃时,无论是传统的酸加热法还是加以超声波辅助,叶蛋白的提取率均最高,此时,用超声波辅助酸溶法提取叶蛋白的提取率可达85.72%。当温度超过45℃时,叶蛋白提取率开始下降,这可能是由于此时蛋白质开始变性,蛋白质分子展开导致疏水基团的暴露及蛋白质分子相互缠绕,从而使溶解度降低。整体看来,不同温度下,用超声波辅助酸加热法提取扁核木叶蛋白的提取率也均高于传统的酸加热法的提取率。
2.4 液料比对扁核木叶蛋白提取率的影响
设定pH 3.6,温度40℃,处理时间30 min为不变因素,液料比分别为 6、8、10、12、14,液料比对扁核木叶蛋白提取率的影响如图3。

图3 液料比对扁核木叶蛋白提取率的影响
由图3可知,在液料比为6~14之间时,随着液料比的增加,提取率逐渐增高,当液料比为12时,扁核木叶蛋白的提取率达到最高,当液料比超过12时,叶蛋白的提取率趋于稳定,说明此时蛋白质已被最大程度的溶解出来。整体看来,在不同液料比下,用超声波辅助酸加热法提取扁核木叶蛋白的提取率也均远高于传统的酸加热法的提取率。
2.5 pH对扁核木叶蛋白提取率的影响
设定液料比1∶10,温度40℃,处理时间30 min为不变因素,pH 分别为 3.0、3.6、4.2、4.8、5.4,pH对扁核木叶蛋白提取率的影响如图4。

图4 pH对扁核木叶蛋白提取率的影响
由图4可知,在pH 3.0~5.4之间,扁核木叶蛋白的提取率与pH呈负相关,在pH为3.0时扁核木叶蛋白提取率最高。当提取液pH逐渐增大时,扁核木叶蛋白的提取率也逐渐下降。这是由于蛋白质是一种两性电解质,当溶液pH小于蛋白质的等电点时,酸性溶液中大量的氢离子使蛋白质氢离子化而带有大量正电荷,这些带有正电荷的基团会与周围溶液中的水分子发生结合,在蛋白质周围形成一层水化层,从而使得蛋白质更稳定的存在于溶液中,即增加了蛋白质的溶解度。在pH 3.0~5.4酸性范围内,扁核木叶中的蛋白质带有正电荷,且随着pH的逐渐增大,叶蛋白质所带正电荷逐渐减少,蛋白质的溶解度也逐渐降低。整体看来,在pH 3.0~5.4之间,用超声波辅助酸溶法提取扁核木叶蛋白的提取率也均远高于传统的酸加热法的提取率。
2.6 正交试验
在单因素试验的基础上,以节约生产成本为原则,对温度、时间、pH、液料比4个因素各取3个水平进行正交试验,以扁核木叶蛋白的提取率为指标,探索酸加热法及超声波辅助酸加热法提取扁核木叶蛋白的最佳提取条件。正交试验因素-水平设计见表2,正交试验结果与极差分析见表3。
通过表3极差分析结果可知,酸溶法提取扁核木叶蛋白的最佳工艺为A3B3C1D2,即时间25 min、温度45℃、液料比8、pH 3.6,各因素对扁核木叶蛋白提取率影响的显著次序为A>C>D>B,即时间>液料比>pH>温度;超声波辅助酸加热法提取扁核木叶蛋白的最佳工艺为B>C>D>A,即时间20 min、温度40℃、液料比12、pH4.2,各因素对扁核木叶蛋白提取率影响大小的次序为B>C>D>A,即:温度>液料比>pH>时间。
2.7 验证试验
利用上述最佳工艺条件分别进行验证试验,实测得用酸加热法提取扁核木叶蛋白,其提取率为70.37%,用超声波辅助酸加热法提取扁核木叶蛋白,其提取率为87.90%,超声波辅助酸加热法较传统的酸加热法提取扁核木叶蛋白的提取率提高了17.53%。
2.8 酸沉淀扁核木叶蛋白
用0.1 mol/L的HCl调节扁核木叶蛋白超声波提取液至 pH 5.4,4 000 r/min 离心 15 min,脂肪、叶绿素、糖类及有机物等杂质留于上清液中,去上清液,沉淀则为纯化的扁核木叶蛋白。

表3 正交试验结果与极差分析
3 结论
3.1 采用酸加热法提取扁核木叶蛋白的最佳工艺条件:时间 25 min、温度 45 ℃、液料比 8、pH 3.6,此时,扁核木叶蛋白的提取率为70.37%。
3.2 采用超声波辅助酸加热法提取扁核木叶蛋白的最佳工艺条件:时间20 min、温度40℃、液料比12、pH 4.2,此时,扁核木叶蛋白的提取率为87.9%。
3.3 相对于传统的酸溶法,用超声波辅助酸溶法提取扁核木叶蛋白,节省了时间,降低了温度,并增大了pH,这大大降低了生产成本。
3.4 采用超声波辅助酸溶法提取可以提高扁核木叶蛋白的提取率,与单纯酸溶法提取法相比,扁核木叶蛋白提取率提高了17.53%。
3.5 将扁核木叶蛋白超声波提取液调至pH 5.4,对扁核木叶蛋白进行酸沉淀,可将扁核木叶蛋白从提取液中分离出来。
[1]邱业先,彭济特.植物叶蛋白的开发与利用研究[J].江西农业大学学报,1990,12(2):41 -44
[2]杨晓盆,张超,王文梅.扁核木光合特性的研究[J].中国生态农业学报,2008,16(4):909 -913
[3]严伟,李淑芬,田松江.超声波协助提取技术[J].化工进展,2002,21(9):649 -651
[4]WANG L C.Ultrasonic extraction of proteins from autoclaved soybean flakes[J].Journal of Food Science,1975,40(3):549-551
[5]WANG L C.A pilot-plant study of continuous ultrasonic extraction of soybean protein[J].Journal of Food Science,1982,47(4):1127 -1129
[6]Liang Qi,Li Ronghe,Qi Bin.A Study on Increasing Solubility of Soy - protein by Ultrasonic Waves[J].Soybean Science,2001,20(2):102 -104
[7]黄国平,温其标,杨晓泉,等.超声波法提取玉米醇溶蛋白的研究[J].食品与发酵工业,2002,28(10):49 -51
[8]米宏伟,唐传核,杨晓泉,等.超声波协助提取荞麦蛋白的研究[J].食品工业,2005(4):38-40
[9]崔志芹,王志祥,史美仁.超声波对棉籽蛋白萃取过程的强化[J].中国油脂,2006,31(6):60 -62
[10]袁道强,王丹丹.超声波法提取小麦胚芽蛋白的研究[J].食品研究与开发,2007,28(1):1 -4
[11]张会翠,于丽娜,宫清轩.花生分离蛋白超声波辅助提取工艺的优化[J],花生学报,2011,40(1):6 -12
[12]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社:197-198
[13]舒友琴,梁丽琴,扶庆权,等.菠菜叶蛋白的提取研究[J],食品科学,2005,26(10):124 -127
[14]黄伟坤.食品检验与分析[M].北京:中国轻工业出版社,1989
[15]刘晓庚.叶蛋白的资源、加工、特性和综合利用(二)[J],林产化工通讯,1998(5):39 -41.

