转化生长因子β1降低大鼠自发性癫痫发作并抑制胶质细胞活化*
韩远远, 刘益民, 王 玉
(安徽医科大学第一附属医院神经内科,安徽合肥230022)
癫痫是一种以自发性发作为主要特征的常见神经系统疾病,大约影响0.5% ~2%的人群。颞叶癫痫(temporal lobe epilepsy,TLE)是人类最常见的癫痫类型,TLE的发生进程通常包括3个阶段:由最初的脑损伤事件(如脑缺血,感染,肿瘤,创伤性脑损伤等)引起(急性期),进而促使脑细胞、组织和结构的改变(沉默期),最终引起促癫痫环路重建导致自发性反复性惊厥的发生(慢性期)[1]。目前最常用的TLE动物模型是通过系统注射匹罗卡品(pilocarpine,Pilo)引起癫痫持续状态,进而引发一系列促癫痫事件的改变,最终引起慢性自发性癫痫的发作[2]。
转化生长因子β1(transforming growth factor beta 1,TGF-β1)作为多效性的因子,在缺血性脑损伤中已被证实具有控制细胞的生长、分化、转移,以及抗氧化、调节炎症反应和阻止细胞凋亡的作用,对兴奋毒性、化学毒性、缺氧等引起的神经元损伤具有直接保护功效[3-5]。作为内源性免疫细胞,小胶质细胞和星形胶质细胞对脑新陈代谢、细胞外离子的动态平衡、血脑屏障的完整性、免疫功能及保护神经元的正常功能起到至关重要的作用,同时胶质细胞的激活为TLE的一个重要特征,激活的胶质细胞会出现结构和功能的改变,这些改变可以促进慢性期自发性惊厥的发生[6-7],所以激活的胶质细胞既是癫痫的结果又是促进其原因。实验研究表明左乙拉西坦的抗癫痫作用是通过增加TGF-β1的分泌,经TGF-β1介导而实现的[8],但是其抗癫痫具体机制尚不确切,因此本实验通过Pilo建立大鼠癫痫持续状态模型,通过滴鼻给予TGF-β1,进一步验证其抗癫痫作用,并探讨TGF-β1可能的抗癫痫机制及神经保护作用。
材料和方法
1 动物
选用成年健康雄性 SD大鼠,220~250 g,SPF级,由安徽医科大学实验动物中心提供。置于安静、避光、自由摄取食水的室温环境下饲养2周,以适应环境。
2 主要试剂
重组人TGF-β1蛋白购自Peprotech,Pilo及东莨菪碱购自Sigma,免疫组化用小胶质细胞标志物——离子钙结合接头分子1(ionized calcium-binding adaptor molecule 1,Iba1)多克隆兔抗购自Wako,胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体购自北京博奥森公司。
3 主要方法
3.1 动物模型的建立 腹腔注射(ip)东莨菪碱1mg/kg以拮抗外周胆碱反应,30 min后,大鼠给予新鲜配制的Pilo 320 mg/kg ip,每30 min追加30 mg/kg直至癫痫持续状态出现。正常对照组给予同剂量的生理盐水注射。注射15 min后观察大鼠行为,癫痫发作严重程度根据Racine标准进行分级:Ⅰ级:面部阵挛,包括眨眼、动须、节奏性咀嚼等;Ⅱ级:Ⅰ级加节律性点头;Ⅲ级:Ⅱ级加前肢阵挛;Ⅳ级:Ⅲ级加后肢站立;Ⅴ级:Ⅳ级加摔倒或伴全身性阵挛发作。本研究以发作达4或5级痫性发作为诱导癫痫持续状态成功的标准。出现癫痫持续状态的大鼠,自出现惊厥性痫性发作后50 min,给予10%水合氯醛350 mg/kg ip终止发作。
3.2 TGF-β1滴鼻及实验分组 建立癫痫持续状态模型前24 h对实验组大鼠给予滴鼻处理。重组蛋白TGF-β1(Pepro-Tech)溶于无菌PBS液中,使其浓度达到50 mg/L。具体给药方法如下:大鼠经10%水合氯醛腹腔麻醉后,取仰卧位,并将头颈背用4 cm×4 cm的纱布卷稍稍垫高以有利于药物进入后鼻腔。应用滴鼻器经鼻均速滴入20 μL TGF-β1(每只1 μg),两侧鼻腔交替滴入,平均每只大鼠滴鼻用时约15 min。Pilo和正常对照组应用相同方法给予等容量的PBS溶液。
3.2.1 实验一 癫痫模型建立后7 d,通过12 h视频观察大鼠自发性癫痫活动,28 d时结束。
3.2.2 实验二 胶质细胞免疫组化大鼠分别于建模后1、7、14、28 d取材。尼氏染色14 d取材。每组每个时点大鼠数量为5只。
3.3 动物取材及固定 实验动物分别在癫痫持续状态后1 d、7 d、14 d及28 d行断头取脑。大鼠腹腔麻醉后固定,开胸经升主动脉插管,0.9%氯化钠注射液100 mL快速灌注以冲净血液,后用4%多聚甲醛100 mL先快后慢灌注固定全身,后断头取脑,固定于4%多聚甲醛中48 h,流水冲洗标本18 h后常规脱水、石蜡包埋。冠状面连续切片以观察海马,厚6 μm,每隔5张取1张,共收集6张,进行染色处理。
3.4 免疫组化 切片常规脱蜡至水,按SABC法进行免疫组化染色,DAB显色,苏木精复染,脱水透明,中性树胶封片后镜检。阴性对照实验:免疫组化染色过程中以0.02 mol/L PBS代替GFAP和Iba1蛋白Ⅰ抗孵育切片。
3.5 尼氏染色甲苯胺蓝法 切片入0.1%甲苯胺蓝溶液2 min,保持40℃,蒸馏水冲洗后梯度乙醇分化,自然风干,二甲苯透明,中性树胶封片。
4 统计学处理
采用SPSS 13.0统计软件分析,数据以均数±标准差(±s)表示,实验一部分两组间比较采用两组独立样本的t检验,实验二部分多样本间均数比较采用单因素方差(Oneway ANOVA)分析,以P<0.05为差异有统计学意义。
结 果
1 TGF-β1具有明显的抗癫痫作用
正常对照(control)组大鼠无癫痫发作,Pilo组大鼠癫痫持续状态后第9 d出现自发性癫痫发作,TGF-β1治疗组大鼠第12 d出现,TGF-β1治疗组大鼠癫痫发作次数、等级分数及持续时间均较Pilo组有明显减少,见表1。
表1 自发性癫痫发作的平均频率、程度及持续时间Table 1.Average frequency,severity and duration of spontaneous seizures(±s.n=5)

表1 自发性癫痫发作的平均频率、程度及持续时间Table 1.Average frequency,severity and duration of spontaneous seizures(±s.n=5)
*P <0.05,**P <0.01 vs Pilo group.
Group Frequency(d-1) Seizure score Seizure duration(s)Pilo 6.37 ±0.44 3.21 ±0.14 53.20 ±10.03 TGF-β1+Pilo 2.32 ±0.66** 1.90 ±0.21* 37.57 ±9.20*
2 TGF-β1抑制癫痫持续状态后星形胶质细胞的激活
在正常组大鼠海马区星形胶质细胞有基础表达,数量较少,形态学表现为胞体较薄,周围突起较少,为未活化的星形胶质细胞。癫痫持续状态后GFAP阳性细胞数量增加,1 d与正常对照组相比未见明显差异,7 d左右数量达到高峰,14 d后逐渐减少,28 d时仍处相对较高水平。TGF-β1治疗组GFAP阳性细胞数量较Pilo组显著降低,14 d左右降至正常水平。激活的星形胶质细胞形态学表现为胞体肥大,突起增大增粗,并可能出现极化等,见表2、图1。
表2 不同时点海马CA3区GFAP阳性细胞数Table 2.The number of GFAP(+)cells in hippocampal CA3 region at different time points(±s.n=5)

表2 不同时点海马CA3区GFAP阳性细胞数Table 2.The number of GFAP(+)cells in hippocampal CA3 region at different time points(±s.n=5)
*P <0.05 vs control group;#P <0.05 vs Pilo group.
Group 1 d 7 d 14 d 28 d Control 25.35 ±10.38 27.62 ±9.89 24.57 ±13.4526.94 ±5.72 Pilo 37.38 ±7.64 117.52 ±23.01* 84.48 ±18.24* 49.67 ±9.79*TGF-β1+pilo 33.82 ±12.61 103.89 ±19.45* 49.20 ±15.91#32.77 ±13.19

Figure 1.The expression of GFAP 14 d after status epilepticus.Bar:100 μm.A:control;B:Pilo;C:TGF-β1+Pilo.图1 癫痫持续状态14 d后海马CA3区GFAP的表达
3 TGF-β1抑制小胶质细胞的活化数目
与星形胶质细胞相似,正常组Iba1(+)数量较少,形态学表现为胞体较薄,周围有大量树枝状突起,为未活化小胶质细胞。在Pilo组Iba1(+)数量迅速增加,7 d达到高峰,14 d后逐渐下降,28 d降至正常水平。TGF-β1治疗组Iba1阳性细胞数变化趋势与GFAP相似,14 d左右较Pilo组有显著降低,基本降至正常水平。活化的小胶质细胞表现为胞体肥大变圆,周围突起减少,变短增粗,见表3、图2。
表3 不同时点海马CA3区Iba1阳性细胞数Table 3.The number of Iba1(+)cells in hippocampal CA3 region at different time points(±s.n=5)

表3 不同时点海马CA3区Iba1阳性细胞数Table 3.The number of Iba1(+)cells in hippocampal CA3 region at different time points(±s.n=5)
*P <0.05 vs control group;#P <0.05 vs Pilo group.
Group 1 d 7 d 14 d 28 d Control 19.38 ±6.52 21.22 ±8.02 20.29 ±4.71 17.61 ±7.44 Pilo 48.45 ±8.38* 112.65 ±11.81* 104.11 ±9.36* 25.98 ±5.17 TGF-β1+pilo 43.36 ±7.57* 97.17 ±9.45* 32.28 ±8.31#21.49 ±6.72
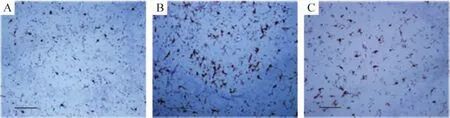
Figure 2.The expression of Iba1 14 d after status epilepticus.Bar:100 μm.A:control;B:Pilo;C:TGF-β1+Pilo.图2 癫痫持续状态14 d后海马CA3区Iba1的表达
4 TGF-β1减少神经元死亡
正常组大鼠CA3区见大量致密的椎体细胞,排列整齐,形态完整,胞浆内尼氏小体丰富;癫痫持续状态14 d后Pilo组细胞形态不完整,细胞肿胀,破裂,轮廓模糊,排列紊乱,细胞间距加大,胞浆内尼氏小体减少;TGF-β1治疗组存活神经元较Pilo组明显增多,见图3。正常组CA3区神经元数目为104.56 ±12.33;,Pilo组为39.47 ±10.89;TGF-β1治疗组为87.62±8.57;TGF-β1治疗组与 Pilo组相比差异有统计学意义(P <0.01)。

Figure 3.Nissl-stained sections of hippocampal CA3 region 14 d after status epilepticus.Bar:100 μm.A:control;B:Pilo;C:TGF-β1+Pilo.图3 癫痫持续状态14 d后海马CA3区Nissl染色结果
讨 论
TGF-β1是多功能的转化生长因子,其生物作用依据细胞类型和环境而发生变化。它在免疫调节、细胞生长分化、细胞外基质的合成及贮存、胚胎发育、创伤修复、骨骼重建和中枢神经系统发育等方面发挥着十分重要的作用。目前大量实验表明TGF-β1可以通过多种途径促进缺血缺氧性脑损伤所引起的神经细胞的康复,并在阿尔茨海默病、帕金森病、AIDS脑病等多种神经系统疾病中发挥神经保护作用[9-10]。但是外源性TGF-β1相对分子质量较大,不易通过血脑屏障到达中枢。经鼻给药作为一种无创的,非侵入性的,相对比较方便的途径可使药物分子通过嗅部黏膜沿包绕在嗅神经束周围的连接组织或嗅神经元轴突到达脑脊液或脑部,因而可绕过血脑屏障进入中枢神经系统,发挥治疗作用。实验表明经鼻TGF-β1可以在迅速进入嗅球、纹状体、丘脑和大脑皮层等脑区[11]。
星形胶质细胞对脑细胞外环境的控制中起关键作用,具有限制胞外钾离子和兴奋性氨基酸谷氨酸盐堆积的作用。活化的星形胶质细胞在其分子、细胞结构、形态学及功能学方面会发生改变,包括:(1)降低了钾离子通道(Kir4.1)和水通道蛋白4(aquaporin 4,AQP4)的表达,损害了胶质细胞对脑组织内钾离子的缓冲能力,促使神经元兴奋阈值降低,增加同步化放电和突触的可塑性,最终使神经元去极化,同时可激活N-甲基-D-天冬氨酸(NMDA)受体等;(2)使谷氨酸盐的代谢受阻,胶质细胞可表达谷氨酸盐受体,并能促进谷氨酸盐的吸收和代谢,活化的胶质细胞对谷氨酸盐清除能力降低,造成谷氨酸盐蓄积可使细胞的兴奋性增加。导致神经元同步去极化放电及自发性癫痫发作;(3)降低缝隙连接,星形胶质细胞通过彼此缝隙连接共同形成大的细胞网络以促进对脑内小分子蛋白的缓冲能力[12-14],活化的胶质细胞对蛋白的缓冲能力降低。同时激活的星形胶质细胞可增加血脑屏障的渗透性,促使血液中钾离子渗透入脑组织,钾离子的蓄积本身可以作为癫痫发作的一个诱因[13],所以星形胶质细胞的激活可增加神经元的兴奋性,癫痫的易感性。因此抑制星形胶质细胞的活化数量,可使神经元的兴奋性降低并可在一定程度上改善血脑屏障的通透性。
小胶质细胞是中枢神经系统中固有的免疫源性细胞和免疫监视细胞并在免疫炎症反应中起着重要作用,在中枢神经系统感染、肿瘤、外伤、中毒等情况下小胶质细胞可快速激活,表现为阿米巴样,吞噬死亡的细胞,并释放生长因子促进组织恢复。但过量活化的小胶质细胞可分泌和释放如基质金属蛋白酶(MMPs)、氧自由基、NO、IL-1β、TNF-α等炎症因子和神经毒性因子,并激活经典和旁路补体途径,可导致脑氧化应激,神经毒性,神经元损伤、破坏和死亡,同时激活的小胶质细胞可促进星形胶质细胞的活化[15]。目前大量实验表明炎性因子可直接诱导癫痫的发作[16],因此活化的小胶质细胞可直接损害脑神经细胞并可间接促进神经元的兴奋性。本实验观察到经鼻滴入TGF-β1可抑制小胶质细胞的过量活化,14 d达到高峰,同时癫痫持续状态后14 d时尼氏染色显示存活神经元较Pilo组明显增加,因此我们认为与TGF-β1抑制小胶质细胞的过度活化而发挥神经保护作用有关。同样在缺血缺氧性脑损伤的基础实验中亦观察到TGF-β1可显著抑制小胶质细胞的活化[17]。因此TGF-β1通过抑制小胶质细胞的活化可以改善脑组织炎症因子和神经毒性因子的表达发挥神经保护作用。
综上所述,本实验观察到经鼻滴入TGF-β1有效降低了自发性癫痫发作,抑制胶质细胞活化和阻止了癫痫所引起的神经元死亡,同时我们认为TGF-β1抑制慢性期自发性癫痫的发作和发挥神经保护作用是通过抑制胶质细胞活化实现的。
[1] Simonato M,Zucchini S.Are the neurotrophic factors a suitable therapeutic target for the prevention of epileptogenesis?[J].Epilepsia,2010,51(Suppl 3):48-51.
[2] Curia G,Longo D,Biagini G,et al.The pilocarpine model of temporal lobe epilepsy[J].J Neurosci Methods,2008,172(2):143-157.
[3] Zhu Y,Yang GY,Ahlemeyer B,et al.Transforming growth factor-β1increases bad phosphorylation and protects neurons against damage[J].J Neurosci,2002,22(10):3898-3909.
[4] Ruocco A,Nicole O,Docagne F,et al.A transforming growth factor-β antagonist unmasks the neuroprotective role of this endogenous cytokine in excitotoxic and ischemic brain injury[J].J Cereb Blood Flow Metab,1999,19(12):1345-1353.
[5] Henrich-Noack P,Prehn JH,Krieglstein J.TGF-β1protects hippocampal neurons against degeneration caused by transient global ischemia.Dose-response relationship and potential neuroprotective mechanisms[J].Stroke,1996,27(9):1609-1614;discussion 1615.
[6] Wetherington J,Serrano G,Dingledine R.Astrocytes in the epileptic brain[J].Neuron,2008,58(2):168-178.
[7] Marin-Teva JL,Cuadros MA,Martin-Oliva D,et al.Microglia and neuronal cell death[J].Neuron Glia Biol,2011,7(1):25-40.
[8] Stienen MN,Haghikia A,Dambach H,et al.Anti-inflammatory effects of the anticonvulsant drug levetiracetam on electrophysiological properties of astroglia are mediated via TGFβ1 regulation[J].Br J Pharmacol,2011,162(2):491-507.
[9] Ma M,Ma Y,Yi X,et al.Intranasal delivery of transforming growth factor-β1 in mice after stroke reduces infarct volume and increases neurogenesis in the subventricular zone[J].BMC Neurosci,2008,9:117.
[10] Caraci F,Spampinato S,Sortino MA,et al.Dysfunction of TGF-β1 signaling in Alzheimer's disease:perspectives for neuroprotection[J].Cell Tissue Res,2012,347(1):291-301.
[11] Ma YP,Ma MM,Ge S,et al.Intranasally delivered TGF-β1 enters brain and regulates gene expressions of its receptors in rats[J].Brain Res Bull,2007,74(4):271-277.
[12] Oliet SH,Piet R,Poulain DA.Control of glutamate clearance and synaptic efficacy by glial coverage of neurons[J].Science,2001,292(5518):923-926.
[13] Friedman A,Kaufer D,Heinemann U.Blood-brain barrier breakdown-inducing astrocytic transformation:novel targets for the prevention of epilepsy[J].Epilepsy Res,2009,85(2-3):142-149.
[14] Wallraff A,Kohling R,Heinemann U,et al.The impact of astrocytic gap junctional coupling on potassium buffering in the hippocampus[J].J Neurosci,2006,26(20):5438-5447.
[15] Najjar S,Pearlman D,Miller DC,et al.Refractory epilepsy associated with microglial activation[J].Neurologist,2011,17(5):249-254.
[16] Li G,Bauer S,Nowak M,et al.Cytokines and epilepsy[J].Seizure,2011,20(3):249-256.
[17] McNeill H,Williams C,Guan J,et al.Neuronal rescue with transforming growth factor-β1 after hypoxic-ischaemic brain injury[J].Neuroreport,1994,5(8):901-904.

