EF-hand对钙调磷酸酶B同源蛋白2的生物学功能影响
张洪菊 李庆华 王立洪 蔺亚妮 常国强 庞天翔
中国医学科学院北京协和医学院血液学研究所血液病医院实验血液学国家重点实验室,天津 300020
钙调磷酸酶B同源蛋白 (calcineurin B homologous protein,CHP)是具有多个 EF-hand 结构的钙离子(Ca2+)结合蛋白。目前报道该家族拥有3个成员,分别被命名为CHP1、CHP2、CHP3[1]。其中CHP1 广泛表达于各种组织,CHP3 特异性表达在一些正常组织,而CHP2 与这两个成员不同,它主要表达在一些肿瘤组织中[2]。最初因发现其在肝癌组织中高表达而命名为肝细胞癌抗原520(hepatocellular carcinoma antigen520,HCA520)[3],因此被认为是一种肿瘤相关抗原。CHP2 已被证明在肿瘤细胞的增殖、转移等方面具有重要作用[4],目前的研究表明CHP2 主要是通过调节钠氢离子交换蛋白 1(Na+/H+exchanger 1,NHE1)活性而发挥功能,通过与NHE1 结合而激活NHE1,发挥其调控细胞内离子转运及细胞酸碱的功能[5-6]。但是,CHP2 作为一个Ca2+结合蛋白,EF-hand是其分子中结合Ca2+的关键序列,对CHP2 发挥正常功能具有重要作用,目前国内尚缺乏EF-hand对CHP2 细胞内定位、功能以及与NHE1的相互作用中的影响的报道,本研究将对这些内容进行探讨。
1 材料与方法
1.1 实验试剂及材料
45CaCl2购自美国Dupont-NEN公司。NHE表达缺陷的PS120 细胞系、CHP2 和NHE1的兔抗人多克隆抗体及野生型人NHE1的真核细胞表达质粒pECE均由日本国立循环系统疾病中心研究所馈赠。E.Coli(BL21-star)、LipofectamineTM2000 Reagent kit购自美国Invitrogen公司。DMEM培养基、胎牛血清购自美国GIBCO公司。本实验中所用到的其他质粒均为本实验室保存。
1.2 细胞培养
PS120 及相应的转染子按常规方法在(含25mmol/L NaHCO3、体积分数为10%的小牛血清、50 U/mL青霉素和50 μg/mL链霉素)DMEM培养基中培养于37℃,含5%CO2,饱和湿度的培养箱中。
1.3 CHP2 cDNA的克隆及其表达载体的构建
提取人类血液细胞的总RNA,逆转录成cDNA,采用PCR扩增CHP2的全长cDNA序列,将其在合适的酶切位点克隆进含有绿色荧光蛋白标记基因的载体pEGFP-N1,对此重组质粒命名为CHP2-GFP。同时采用基于PCR突变的方法,将四个EF-hand的-Z点的氨基酸替换为脂肪族的非极性氨基酸丙氨酸(Ala,A),这些突变EF-hand的重组质粒分别命名为 CHP2-EF1m、CHP2-EF2m、CHP2-EF3m、CHP2-EF4m。
1.4 重组质粒的转染
应用LipofectamineTM2000将上述重组质粒转染PS120细胞,转染完成24 h后利用G418 筛选两周,采用流式细胞仪,根据GFP荧光标记分选得到含有相关重组质粒的单克隆细胞株。
1.5 重组蛋白的制备
将CHP2 及其突变体的全长cDNA序列克隆到pET11(重组蛋白末端将带有6个组氨酸的标记)载体中,转化大肠杆菌 E.Coli(BL21-star)制备重组蛋白 His tagged-CHP2。重组蛋白利用Ni+离子交换型树脂分离纯化重组蛋白。
1.6 SDS-PAGE蛋白质电泳检测CHP2 蛋白的表达及利用GFP荧光观察蛋白定位
将分离纯化后的重组CHP2 蛋白进行SDS-PAGE凝胶电泳,利用考马斯亮蓝染色法,检测纯化的重组蛋白的分子量及其在聚丙烯酰胺凝胶上的泳动速度。
将共转染由GFP标记的CHP2 或其突变体重组质粒及野生型人NHE1的真核细胞表达质粒的PS120 细胞采用爬片法培养,待细胞长至合适密度后,采用4%多聚甲醛固定,制片,采用激光共聚焦显微镜观察GFP荧光在细胞内的分布。
1.7 Ca2+结合特征常数的测定
将分离纯化得到的CHP2 及其突变体的重组蛋白与不同浓度的45Ca2+在25℃共同孵育60 min。孵育完成后将反应的溶液体系经过0.2 μm的滤膜过滤,以不含重组蛋白的反应溶液体系作为阴性对照,待滤膜干燥后,采用放射性检测仪计量45Ca2+的在膜上的残留程度。以加入反应体系的Ca2+含量为横坐标,以膜上残留的45Ca2+为纵坐标作图,制作Ca2+平衡曲线。比较CHP2 野生型及不同的突变体45Ca2+结合特征常数的异同。
1.8 蛋白质免疫共沉淀(Co-Immunoprecipitation,Co-IP)
1.8.1 细胞裂解 收获过表达NHE1的1 ×107PS120 细胞,用预冷的PBS洗两次,用细胞刮刮下细胞置于1.5mL离心管里,加入1 mL IP细胞裂解液,之后4 000 r/min离心5min,吸取上清。
1.8.2 免疫沉淀 (IP)将上述的含蛋白提取物的上清液中加入30 μL的Protein G agarose,同时加入 4 μg特异抗体 (抗CHP2 或 NHE1),4℃轻微摇动 1 h,2 000 r/min 离心,弃上清,用预冷的IP细胞裂解液洗沉淀3次,加入2 ×蛋白上样缓冲液,沸水煮3 min,吸上清。
1.8.3 电泳和转膜 将所得到的上清上样,先用SDS-PAGE电泳,再用半干法电转移至硝酸纤维素膜。再用另一种蛋白的抗体杂交,如果能得到特异的带,而阴性对照(IgG)没有带,证明两种蛋白相互结合。
1.8.4 蛋白免疫印记 (IB)分别在室温下用含5%脱脂奶粉的TBST封闭1 h,一抗(抗NHE1 或CHP2)孵育1 h,二抗孵育1 h,ECL化学发光法显色,每个样本至少重复3次。
1.9 血清饥饿实验
相同数量的共表达NHE1/野生型CHP2(NHE1/CHP2)或NHE1/CHP2-EF3m/4m的PS120 细胞接种于培养瓶内,分别观察在有血清或无血清培养条件下细胞状态及数量变化。
1.10 统计学方法
采用统计软件SPSS 11.0 对实验数据进行分析,计量资料数据以均数±标准差(±s)表示,以P<0.05 为差异有统计学意义。45Ca2+结合平衡采用公式:45Ca2+=最大45Ca2+结合量/(1+Kd-[Ca2+]n)(Kd=Ca2+显性解离常数,n=Hill系数)计算。
2 结果
2.1 EF-hand调节CHP2 蛋白的构象
经生物信息学方法分析表明CHP2 蛋白结构内含有4个可能的 EF-hand 结构,分别命名为 EF1、EF2、EF3、EF4。 本研究分别成功构建了CHP2 蛋白的4个EF-hand突变体CHP2-EF1m、CHP2-EF2m、CHP2-EF3m、CHP2-EF4m,突变点位于EF-hand的-Z点(图1A)。将大肠杆菌产物表达纯化后得到的CHP2 及其突变体蛋白采用SDS-PAGE检测,发现已突变的CHP2-EF3m、CHP2-EF4m在凝胶上的电泳速度减慢,表明突变这两个EF-hand可能使CHP2 蛋白构象的发生改变(图1B)。结果提示EF-hand3 和EF-hand4 对维持CHP2的正常构象发挥重要的作用。
2.2 CHP2 结合Ca2+平衡曲线的测定
使用膜截留法测定了EF-hand突变对CHP2 钙结合能力的影响。结果显示突变EF-hand3 和EF-hand4 中任意一个,CHP2 结合钙能力下降为正常的1/2;同时突变EF-hand3和EF-hand4,CHP2 不能结合Ca2+(图2)。证实 CHP2 作为一个钙结合蛋白,其Ca2+离子的结合依赖于其分子结构中的EF-hand3 和EF-hand4 模体结构。
2.3 Ca2+影响CHP2 和NHE1 蛋白的相互结合
免疫共沉淀实验表明,在Ca2+存在的条件下,NHE1 和CHP2 能够得到很好的共沉淀,但当利用螯合剂EDTA剥夺细胞内的Ca2+之后,CHP2 和NHE1的相互结合减少,表明CHP2 结合Ca2+对其与NHE1的结合是至关重要的。见图3。
2.4 EF-hand3 和EF-hand4 调节CHP2 在细胞膜上的定位
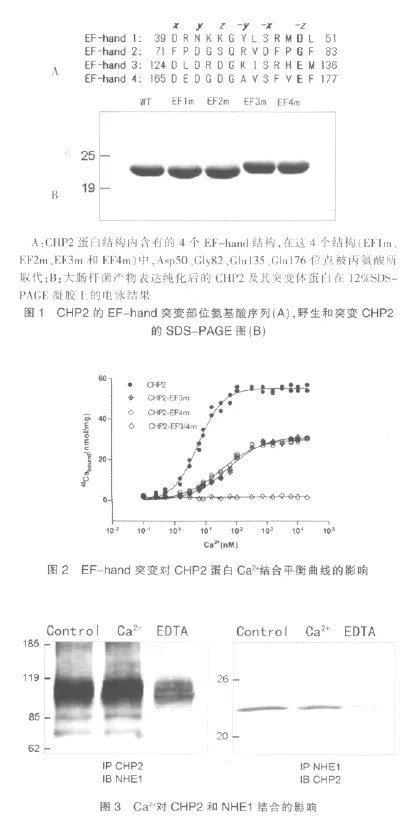
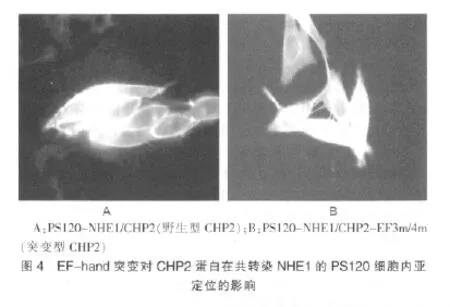
通过激光共聚焦显微镜观察GFP标记的蛋白定位,我量明显较共表达NHE1/野生型CHP2 组减少,细胞死亡数目增多。见图5。们可以发现在共转染NHE1的PS120 细胞中野生型的CHP2蛋白主要定位在细胞膜上,而EF-hand突变的CHP2 蛋白分布在细胞膜的量相对减少(图4)。当EF-hand被突变,CHP2不能与Ca2+结合,CHP2 与NHE1的结合能力减弱,观测到其在细胞膜上的定位减少。表明EF-hand是否结合Ca2+能够影响CHP2 与NHE1的结合及其在细胞膜上定位。
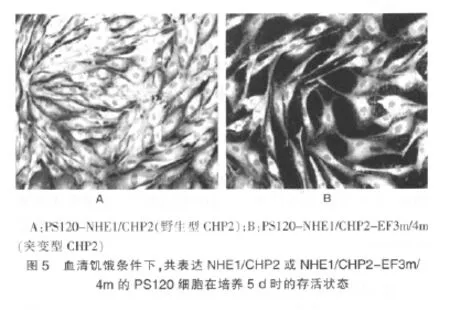
2.5 不同培养条件共表达NHE1/CHP2 或NHE1/CHP2-EF3m/4m的PS120 细胞的生长状态观察
在正常有血清培养条件下,共表达NHE1/CHP2 或NHE1/CHP2-EF3m/4m的PS120 细胞的生长状态无明显差异,但在去除血清即血清饥饿条件下,笔者发现共表达NHE1/CHP2-EF3m/4m的PS120 细胞随着培养时间的延长,细胞的存活数
3 讨论
Ca2+是参与人体各种生命活动与生理过程的重要离子,是细胞内功能最为广泛的第二信使[7]。Ca2+作为生命活动中的重要调节因子,在某些细胞信号传导通路如活化T细胞核因子信号通路(nuclear factor of activated T cells,NFAT)中发挥着着重要的作用[8-9]。CHP2 作为Ca2+结合的蛋白,EF-hand及Ca2+对CHP2 构象、功能和活性的影响尚缺乏报道,值得我们认真研究。
笔者的研究表明,CHP2 蛋白结构中有EF-hand3、EF-hand4这两个与Ca2+结合的功能性结构。在突变EF-hand3、EF-hand4 以后,CHP2 电泳速度变慢,表明EF-hand对于维持CHP2的正常构象非常重要。免疫共沉淀实验证明Ca2+影响CHP2 和NHE1的结合,Ca2+的存在促进CHP2 与NHE1 相结合;激光共聚焦显微镜观察发现,在过表达NHE1的PS120细胞内转染的GFP标记的野生型CHP2 蛋白主要定位在细胞膜上,而EF-hand3、EF-hand4 突变的CHP2 在细胞膜上的亚定位减少,在胞浆中的亚定位增加,提示结合Ca2+及蛋白构象改变对CHP2 细胞内分布有重要影响,在活细胞中证实了突变CHP2的EF-hand后与NHE1的结合减少。
CHP2 在多种肿瘤组织中被发现有异常高表达,如肝癌、卵巢癌、白血病等[3,10-11],提示CHP2 在肿瘤的发生中具有重要作用。CHP2 作为一种肿瘤相关蛋白,也是膜蛋白NHE1的活性调节亚单位,可能通过与NHE1 相互作用在肿瘤发生与发展中发挥重要功能。已有研究证实肿瘤细胞内NHE1 常常处于过度激活的状态,NHE1的过度激活与肿瘤细胞的异常增殖,迁移与侵袭功能明显相关[12]。研究表明,CHP2 可结合于NHE1 胞浆部分的近膜区,定位于细胞膜上,激活NHE1,促进离子转运,升高细胞内的pH值,有利于细胞的生存和增殖,从而减少细胞在血清饥饿的条件下的死亡[13]。本实验也观察了血清饥饿条件下共表达NHE1/CHP2 或NHE1/CHP2-EF3m/4m的PS120 细胞的存活状态,结果显示CHP2突变组细胞在血清饥饿下随培养时间的延长细胞存活数目明显较野生CHP2 组减少,死亡细胞增加,而野生CHP2 组细胞死亡数量明显较少,与Pang等[13]的研究结果一致,表明EF-hand突变后的CHP2 使细胞抵抗血清饥饿诱导的死亡的能力明显减弱。本研究结果进一步证明了EF-hand模体结构是CHP2 蛋白结构中的关键结构,当其发生突变后CHP2失去Ca2+结合能力,同时也减弱了与其靶蛋白NHE1的正常结合能力,维持细胞在血清饥饿条件下存活的能力也下降。EF-hand的正常结构及Ca2+的结合状态在CHP2的功能调控中发挥着重要作用。
笔者的研究进一步明确了CHP2 发挥作用的机制,EF-hand的正确结构及与Ca2+的结合,对于NHE1 与CHP2的结合具有重要作用,有助于我们更好地理解CHP2 在肿瘤发生发展中的作用。然而,对于CHP2 在肿瘤中表达的具体调节机制仍然研究有限,如CHP2 上游的基因表达调控模式如何,什么因素开启了CHP2 蛋白在肿瘤中的异常表达等,这些都值得我们去继续探索,以进一步明确CHP2 在肿瘤中的重要作用。
[1] Di SF,Vadnagara K,Moe OW,et al.Calcineurin homologous protein:a multifunctional Ca2+-binding protein family [J].Am J Physiol Renal Physiol,2012,303(2):165-179.
[2] Zaun HC,Shrier A,Orlowski J.Calcineurin B homologous protein 3 promotes the biosynthetic maturation,cell surface stability,and optimal transport of the Na+/H+exchanger NHE1 isoform[J].J Biol Chem,2008,283(18):12456-12467.
[3] Wang Y,Han KJ,Pang XW,et al.Large scale identification of human hepatocellularcarcinoma-associatedantigensbyautoantibodies[J].J Immunol,2002,169(2):1102-1109.
[4] Li GD,Zhang X,Li R,et al.CHP2 activates the calcinerurin/nuclear factor of T cells signaling pathway and enhances the oncogenic potential of HEK293 cells[J].J Biol Chem,2008,283(47):32660-32668.
[5] Pang T,Su X,Wakabayashi S,et al.Calcineurin homologous protein as an essential cofactor for Na+/H+exchangers[J].J Biol Chem,2001,276(20):17367-17372.
[6] Ammar YB,Takeda S,Hisamitsu T,et al.Crystal structure of CHP2 complexed with NHE1-cytosolic region and implication for pH regulation[J].EMBO J,2006;25(11):2315-2325.
[7] Bootman MD,Lipp P,Berridge MJ.The organisation and function of local Ca2+signals[J].J Cell Sci,2011,114(12):2213-2222.
[8] Kim MS,Usachev YM.Mitochondrial Ca2+cycling facilitates activation of the transcription factor NFAT in sensory neurons[J].J Neurosci,2009,29:12101-12114.
[9] Crabtree GR,Olson EN.NFAT signaling:choreographing the social lives of cells[J].Cell,2002,109(suppl):67-79.
[10] Jin Q,Kong B,Yang X,et al.Overexpression of CHP2 enhances tumor cell growth,invasion and metastasis in ovarian cancer [J].In Vivo,2007,21(4):593-598.
[11] 李彬,李庆华,马丽,等.肿瘤相关基因CHP2 在白血病细胞中表达的研究[J].中国实验血液学杂志,2008,16(4):734-737.
[12] Loo SY,Chang MK,Chua CS,et al.NHE-1:a promising target for novel anti-cancer therapeutics[J].Curr Pharm Des,2012,18(10):1372-1382.
[13] Pang T,Wakabayashi S,Shigekawa M.Expression of calcineurin B homologous protein 2 protects serum deprivation-induced cell death by serum-independent activation of Na+/H+exchanger[J].J Biol Chem,2002,277(46):43771-43777.

