饲粮NFC/NDF对奶山羊瘤胃上皮细胞胰岛素样生长因子Ⅰ及其受体的基因表达的影响
周向丽 刘大程* 孙 鸽 高 民 胡红莲
(1.内蒙古农业大学兽医学院,呼和浩特 010018;2.内蒙古农牧业科学院,呼和浩特 010030)
近些年随着高精料饲粮的大量使用,反刍动物的生产性能得到了极大的提高。这种以淀粉为能量来源高精料饲粮的大量使用极易导致瘤胃酸中毒等代谢性疾病的发生[1]。正常情况下,反刍动物瘤胃发酵产生的挥发性脂肪酸(VFA)大多被瘤胃上皮细胞吸收[2],而瘤胃对VFA的吸收是一个被动过程,位于瘤胃壁上的瘤胃乳头可增强此被动吸收过程[3],因此,增加瘤胃乳头长度和表面积可增强其对VFA的吸收,在一定程度上避免了VFA堆积。饲粮的营养水平会影响胰岛素样生长因子Ⅰ(insulin-like growth factor Ⅰ,IGF-Ⅰ)的基因表达和浓度。高营养饲粮能够增加瘤胃上皮细胞胰岛素样生长因子Ⅰ受体(IGF-Ⅰ receptor,IGF-ⅠR)的基因表达,同时血液中IGF-Ⅰ的浓度也显著高于低营养饲粮组[4]。与此同时许多体内外试验研究发现反刍动物瘤胃上皮生长发育受IGF-Ⅰ等激素或生长因子的调节。IGF-Ⅰ具有调节细胞代谢,促进细胞生长、分化和分裂以及抑制细胞死亡的作用。此外,IGF-Ⅰ又可促进体外培养的山羊瘤胃上皮细胞DNA合成[4]。因此一些学者推断高营养饲粮可经IGF-Ⅰ系统增加瘤胃上皮乳头的数量及大小[5]。目前,关于亚急性瘤胃酸中毒(SARA)发生、发展过程中,瘤胃上皮细胞IGF-Ⅰ和IGF-ⅠR的基因表达量变化以及SARA过程中IGF-Ⅰ与瘤胃上皮生长之间存在的联系,鲜见报道。因此,本试验在逐渐增加饲粮非纤维性碳水化合物和中性洗涤纤维比(NFC/NDF)诱导奶山羊发生SARA的基础上,采用实时定量 PCR(qRTPCR)技术研究SARA发生、发展过程中瘤胃上皮细胞IGF-Ⅰ及IGF-ⅠR的基因表达量的变化。
1 材料与方法
1.1 试验动物与试验设计
选用12只体况良好的泌乳期关中奶山羊,平均体重30~35 kg,年龄2~3岁。整个试验期,试验动物单笼饲养,每天06:00和18:00 2次等量饲喂,自由饮水。
试验饲粮参照NRC(1981)山羊营养需求[6]和文献[7]配制,以玉米、豆粕、麦麸、青干草为主要原料。试验分4期进行,每期15 d,依次饲喂NFC/NDF为1.02(Ⅰ期)、1.24(Ⅱ期)、1.63(Ⅲ期)、2.58(Ⅳ期)的4组饲粮诱导奶山羊发生SARA。试验饲粮组成及营养水平见表1。
1.2 样品采集与处理
试验分4期进行,通过观察动物的精神状态、采食量及粪便的变化等判定动物发生酸中毒,SARA诱导成功。在每期试验结束后,选3只奶山羊宰杀取样,每只羊取3个平行样。所有山羊宰杀前禁食12 h,奶山羊屠宰后,迅速打开瘤胃,为了便于定位每次采取后腹盲囊靠近后沟处组织,钝性分离其黏膜,生理盐水洗净表层瘤胃内容物后,剪成糊状装入1支1.5 mL离心管,迅速置于液氮中保存,后转于-80℃冰箱保存,用于qRTPCR定量分析。
表1 试验饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimental diets(air-dry basis) %
1.3 瘤胃上皮细胞总RNA的提取
用总RNA提取试剂盒[天根生化科技(北京)有限公司]提取瘤胃上皮细胞总RNA并用紫外分光光度计测定吸光度,以OD260nm/OD280nm来判断提取总RNA的纯度。
1.4 cDNA第1链的合成
定量取山羊瘤胃组织总RNA为模板,建立反转录PCR检测方法。以oligo(dT)18引物进行反转录,合成 cDNA第1链,采用20 μL反应体系,组成如下:总 RNA 5~500 ng、Anchored Oligo(dT)18(0.5 μg/μL)1 μL、2 × TS Reaction Mix 10 μL、TransScript RT/RI Enzyme Mix 1 μL,加RNase-free Water至 20 μL。
1.5 目标片断的扩增与鉴定
3对特异性引物设计参照文献[8],所有引物均由大连宝生物有限公司合成,引物序列及参数见表2。反应使用反转录PCR试剂盒购自日本TaKaRa公司。25 μL反应体系如下:模板cDNA 3 μL、上游和下游引物(10 μmol/L) 各 0.5 μL、2 × TransTaq-T PCR SuperMix 12.5 μL,加双蒸水至 25 μL。
反转录PCR扩增参数如下:94℃预变性5 min;94℃变性30 s,退火温度(表2)下退火30 s,72℃延伸45 s,32个循环;72℃最终延伸7 min。
产物经2.0%琼脂糖凝胶电泳检测。

表2 引物序列及参数Table 2 Sequences and parameters of primers
1.6 目的片段胶回收、克隆及鉴定
用胶回收试剂盒[天根生化科技(北京)有限公司]对反转录PCR扩增产物进行胶回收,按照pEASY-T1 Cloning Kit试剂盒(北京全式金生物技术有限公司)将3个胶回收片段分别与pEASY-T1载体连接,转化入感受态细胞(Trans1-T1 Phage Resistant),随机挑取几个白色菌落,分别以其裂解液为模板,用上述引物进行反转录PCR扩增,其反应体系和反应条件均与1.5相同,用2.0%的琼脂糖凝胶电泳检测扩增片段的大小以鉴定重组质粒。挑选反转录PCR鉴定阳性菌落分别接种于1 mL含有 1.4 μL 氨苄青霉素(Amp,100 μg/mL)的LB液体培养基中,37℃振荡培养过夜,送至大连宝生物有限公司进行测序。
1.7 重组质粒的提取及qRT-PCR
用质粒提取试剂盒(美国AXYGEN公司)提取含有目的片段的重组质粒,使用微量紫外分光光度计(德国Eppendorf公司)测定质粒DNA溶液的浓度,将提取的质粒进行10倍系列稀释,制备10~105拷贝的反应用模板共5个梯度浓度,用Premix Ex TaqTM试剂盒(日本TaKaRa公司)配制25 μL 反应体系,组成如下:模板 cDNA 3 μL、SYBRB Premix Ex TaqTMⅡ(2 ×)12.5 μL、上游和下游引物(10 μmol/L)各 0.5 μL、8.5 μL 双蒸水。
美国Bio-Rad公司 iQTM5多重 qRT-PCR仪上进行qRT-PCR扩增,反应参数如下:95℃预变性30 s;95℃变性10 s,退火温度(表2)下退火30 s,72℃延伸30 s(收集荧光),40个循环。
反应结束后软件自动绘制以拷贝数的对数为横坐标,以qRT-PCR反应过程中到达荧光阈值的初始循环数(Ct)为纵坐标的标准曲线。
1.8 样品DNA的测定
获得样品Ct,计算相对表达量。计算公式[9]如下:

1.9 数据统计分析
数据统计分析采用SPSS 17.0软件ANOVA过程进行方差分析,多重比较用Duncan氏法。
2 结果与分析
2.1 瘤胃上皮细胞总RNA的提取及质量检测
提取的总RNA经紫外分光光度计检测,其OD260nm/OD280nm在1.8~2.0之间,说明提取的总RNA有较好的纯度。经2.0%的琼脂糖凝胶电泳鉴定样品总RNA的完整性,如图1所示,18S和28S条带清晰,无DNA污染,无明显降解,表明提取的总RNA质量较高。
图1 RNA凝胶电泳图谱Fig.1 Agarose gel image of total RNA
2.2 目标片段扩增与序列分析
用2.0%琼胶糖凝胶电泳检测,反转录PCR扩增产物专一且内参 β-肌动蛋白、IGF-Ⅰ和IGF-ⅠR目标片段大小分别在330、393和215 bp(图2、图3和图4)。每种引物实际扩增片段大小与预期目的片段大小相符。将这3种反转录PCR产物回收、克隆、阳性重组质粒进行反转录PCR,扩增出的条带与目标片段大小一致(图5)。
2.3 熔解曲线分析
内参β-肌动蛋白、IGF-Ⅰ和IGF-ⅠR的基因的熔解曲线各只有1个特异性峰(图6),表明无引物二聚体及非特异性产物形成,说明所设计引物有很好的特异性,PCR反应条件得到了较好的优化。
图2 β-肌动蛋白反转录PCR电泳检测结果Fig.2 Reverse transcription PCR electrophoresis results of β-actin
图3 IGF-Ⅰ反转录PCR电泳检测结果Fig.3 Reverse transcription PCR electrophoresis results of IGF-Ⅰ
图4 IGF-ⅠR反转录PCR电泳检测结果Fig.4 Reverse transcription PCR electrophoresis results IGF-ⅠR
图5 含有目的片段的质粒反转录PCR电泳结果Fig.5 Reverse transcription PCR electrophoresis results of plasmids with target fragments
2.4 质粒标准曲线的构建
经紫外分光光度计测定β-肌动蛋白、IGF-Ⅰ和IGF-ⅠR质粒DNA溶液的浓度分别为31、29和34 μg/mL。qRT-PCR仪中软件自动生成的质粒标准品扩增反应曲线,Ct和拷贝数呈线性关系,所构建的质粒标准品起始模板为10~105,绘制出的拷贝数log值(y)和Ct(x)的标准曲线方程分别为:β-肌动蛋白,y= -3.283x+24.874(R2=0.992);IGF-Ⅰ,y= - 3.637x+29.076(R2=0.995);IGF-ⅠR,y= - 3.935x+22.893(R2=0.997)。表明拷贝数的Log值与Ct之间的线性关系良好,其他非特异性反应产生的双链干扰较少,所建立的标准曲线符合qRT-PCR定量的要求。
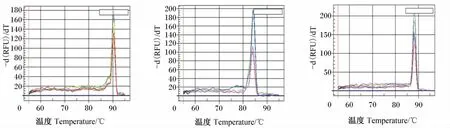
图6 β-肌动蛋白、IGF-Ⅰ和IGF-ⅠR熔解曲线Fig.6 Melting curves of β-actin,IGF-Ⅰ and IGF-ⅠR
2.5 IGF-Ⅰ和IGF-ⅠR定量分析结果
本试验用qRT-PCR分别检测出各组目的基因和内参基因的Ct(表3),代入公式进行相对定量(表4)。随着 NFC/NDF的逐渐增大,IGF-Ⅰ和IGF-ⅠR的基因表达量均呈现不同程度的增加,且二者表达量的变化趋势具有很好的一致性。以Ⅰ期瘤胃中的IGF-Ⅰ和IGF-ⅠR的基因表达量作为对照,Ⅱ期IGF-Ⅰ和 IGF-ⅠR的基因表达量分别是Ⅰ期的1.70和1.88倍,2组之间无显著差异(P >0.05)。Ⅲ期较Ⅱ期相比,IGF-Ⅰ和 IGF-ⅠR的基因表达量出现显著增加(P<0.05),且分别是Ⅰ期的2.71和3.09倍。Ⅳ期(SARA期)较Ⅲ期相比,IGF-Ⅰ和IGF-ⅠR的基因表达量分别出现极显著(P<0.01)和显著(P<0.05)增加,且分别是Ⅰ期的9.61和10.19倍,极显著高于Ⅰ期(P<0.01)。
3 讨论
qRT-PCR技术目前已成为一种被广泛用于对未知模板进行定量分析的必要手段。本试验在测定不同饲粮NFC/NDF条件下,奶山羊瘤胃上皮细胞IGF-Ⅰ和IGF-ⅠR的基因表达量时,通过特异性引物的设计、反应体系的优化等,使目的熔解曲线只有1个特异性峰,由此说明试验过程中没有引物二聚体及其他非特异性产物的生成,进而保证qRT-PCR反应的高质量。试验结果得到的标准曲线R2均在0.990以上,表明拷贝数的log值与Ct之间的线性关系良好,其他非特异性双链干扰较少。结果表明,目的片段成功制备、重组并保持了序列的完整性和特异性,为qRT-PCR表达检测的顺利进行奠定了良好的基础。
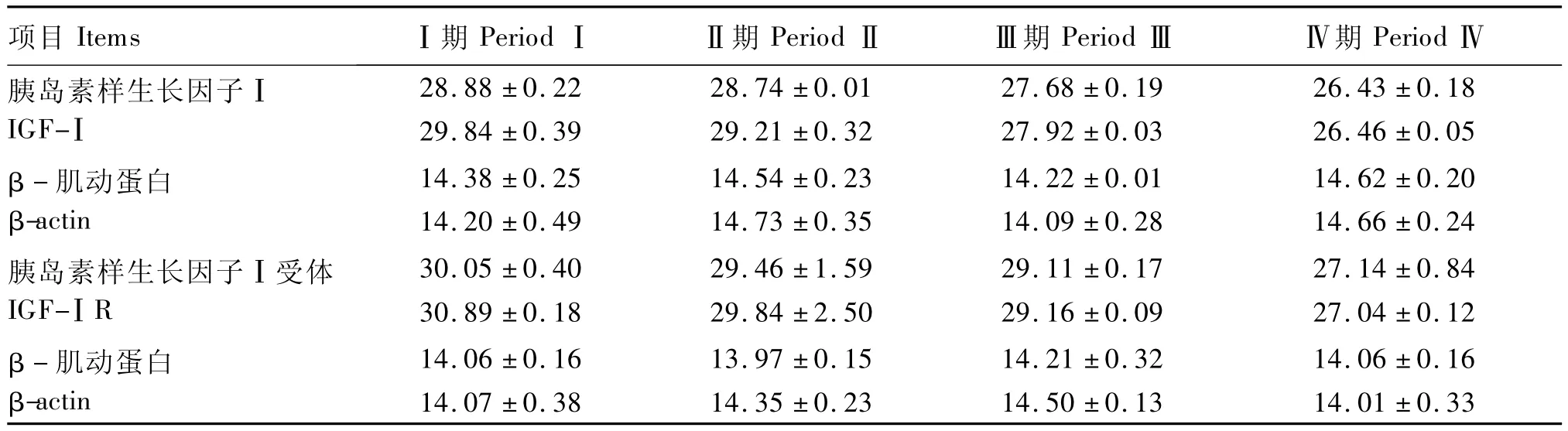
表3 qRT-PCR所测的各样品的CtTable 3 The Ct values of samples determined by the qRT-PCR

表4 IGF-Ⅰ和IGF-ⅠR qRT-PCR定量结果Table 4 The results of qRT-PCR of IGF-Ⅰ and IGF-ⅠR
IGF-Ⅰ是一种合成代谢激素,在动物体内各组织器官中均有该基因的表达产物,可促进细胞对氨基酸和葡萄糖的摄取,增加蛋白质、脂肪和糖原合成,刺激DNA复制和细胞增殖分化,对许多组织细胞增殖、分化起调节作用,是动物生长发育过程中一种重要的生长因子。IGF-Ⅰ的功能主要依靠与IGF-ⅠR结合来执行,IGF-ⅠR广泛分布于多种组织及培养细胞中,在新生犊牛瘤胃上皮细胞[10]和青年山羊瘤胃上皮细胞均存在 IGF-Ⅰ和IGF-ⅠR的基因表达。IGF-Ⅰ的基因表达受到生长激素、营养状态等因素的调控,营养素对IGF-Ⅰ具有直接调控作用,饲粮中蛋白质水平对IGF-Ⅰ的基因表达有显著影响,营养不良时,肝脏、肌肉等组织中 IGF-Ⅰ的基因表达发生变化,血液中IGF-Ⅰ水平降低[11-12]。饲粮蛋白质水平低于生长需要时,大鼠[13]及肥育猪[14]血浆 IGF-Ⅰ浓度均下降。本试验结果显示随着饲粮NFC/NDF增高,即饲粮营养水平逐渐增加时,瘤胃上皮细胞中IGF-Ⅰ和IGF-ⅠR的基因表达量均呈现不同程度的增加,特别是在NFC/NDF为2.58时,IGF-Ⅰ的基因表达量是试验初期的9.61倍,而IGF-ⅠR的基因表达量也是试验初期的10.19倍,这不仅说明高营养饲粮有利于促进瘤胃上皮细胞IGF-Ⅰ的基因表达,同时也说明IGF-Ⅰ和 IGF-ⅠR的基因表达具有很好的一致性,这有助于IGF-Ⅰ更好的发挥其生物学功效。
IGF-Ⅰ对动物胃肠道的发育和更新具有重要的调节作用。口服重组人胰岛素样生长因子Ⅰ(rhIGF-Ⅰ)有助于新生反刍动物胃肠道的生长发育。而体外培养的瘤胃上皮细胞经IGF-Ⅰ处理后,细胞分裂加快,细胞DNA合成增多,促进了细胞增殖。体内外试验都表明IGF-Ⅰ对瘤胃上皮的生长发育具有促进作用。本试验结果中IGF-Ⅰ和IGF-ⅠR的基因表达量随饲粮NFC/NDF的增加而增加。试验过程中,由于瘤胃体积较大,取材部位与取材标准会对试验产生很大影响,因此在取材的过程中为统一定位,每次采取瘤胃后腹盲囊靠近后沟处组织作为研究对象。在此过程中我们发现前2期瘤胃上皮乳头的长度和密度没有明显的区别,瘤胃黏膜上密布着棕褐色扁平而凸起的乳头。到Ⅲ期时,视觉上可见瘤胃上皮乳头长度比Ⅰ、Ⅱ期有所增加,乳头密度没有太大变化,但Ⅳ期时,瘤胃上皮乳头长度与前几期相比变短,乳头密度变稀疏,且在某些部位出现损伤和脱落现象。之前报道IGF-Ⅰ具有促进瘤胃上皮乳头生长的作用,而本试验出现的这种结果与之相反。由课题组前期研究可知出现瘤胃上皮损伤的主要原因是饲粮 NFC/NDF为2.58时,试验动物发生SARA,瘤胃内VFA大量堆积,瘤胃液pH急剧下降[15],瘤胃上皮细胞长时间浸润在高渗和低 pH环境下导致的。而此时瘤胃上皮细胞IGF-Ⅰ和IGF-ⅠR的基因表达量均大大增加,有利于瘤胃上皮细胞对VFA的吸收,也可能是瘤胃内环境稳定性遭到破坏时动物机体的一种代偿表现。同时研究发现,SARA状态时,丁酸浓度显著升高是导致瘤胃总挥发性脂肪酸(TVFA)浓度升高的主要因素,瘤胃中VFA蓄积增多对SARA发生起着决定性作用。当给瘤胃灌注丁酸后,血浆胰岛素浓度升高,瘤胃上皮细胞分裂增强[16]。因此推测丁酸浓度的增加可能会刺激瘤胃上皮细胞IGF-Ⅰ和IGF-ⅠR的基因表达,以促进瘤胃上皮细胞生长并且增加瘤胃上皮细胞对丁酸的吸收,以此来减弱酸性环境对瘤胃的损伤。
4 结论
以提高饲粮NFC/NDF的方法逐渐诱导SARA,IGF-Ⅰ及 IGF-ⅠR 的基因表达量显著提高,SARA发生后,它们的表达量有大幅增加。
[1]OWENS F N,SECRIST D S,HILL W J.Acidosis in cattle:a review[J].Journal of Animal Science,1998,76:275-286.
[2]何军,陈代文.反刍动物瘤胃上皮发育规律及影响因素[J].中国草食动物,2007,27(5):56-58.
[3]BERGMAN E N.Energy contributions of volatile fatty acids from the gastrointestinal tract in various species[J].Physiological Reviews,1990,70:1580 - 1588.
[4]SHEN Z,SEYFERT H M,LOHRKE B,et al.An energy-rich diet causes rumen papillae proliferation associated with more IGF typeⅠreceptors and increased plasma IGF-Ⅰ concentrations in young goats[J].The Journal of Nutrition,2004,134:11 -7.
[5]曾求生.日粮营养水平对山羊瘤胃、瓣胃上皮生长及SCFA浓度的影响[D].硕士学位论文.南京:南京农业大学,2006.
[6]NRC.Nutrient requirements of goats:angora,dairy and meat goats in temperate and tropical countries[S].Washington,D.C.:National Academy Press,1981.
[7]金公亮.奶山羊饲养标准[J].畜牧兽医杂志,1989,2:7-12.
[8]龚虹.羊乳腺中IGF-Ⅰ与其受体基因表达量的相关性研究[D].硕士学位论文.呼和浩特:内蒙古农业大学,2007.
[9]LIVAK K J,SCHMITGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ctmethod[J].Methods,2001,25:402 -408.
[10]ONTSOUKA E C,HAMMON H M,BLUM J W.Expression ofinsulin-like growth factors(IGF)-Ⅰand-Ⅱ,IGF-binding proteins-Ⅱ and -Ⅲ,and receptors for growth hormone,IGF type-Ⅰ and -Ⅱ and insulin in the gastrointestinal tract of neonatal calves[J].Growth Factors,2004,22(l):63 - 69.
[11]BREIER B H.Regulation of protein and energy metabolism by the somatotropic axis[J].Dourest Animal Endocrinol,1999,17(23):209 -218.
[12]SIMMEN F A,BADINGA L,GERRN M L,et al.The porcine insulin-like growth factor system:at the interface of nutrition,growth and reproduction[J].The Journal of Nutrition,1998,128(2):315S -320S.
[13]MACRAE J C.Regulation of protein metabolism[R]//Rowett research institute annual report.[S.l.]:Rowett Research Institute,1992:84 -90.
[14]WHANG K Y,DONOVAN S M,EASTER R A.Effects of protein deprivation on subsequent efficiency of dietary protein utiliza-tion in finishing pigs[J].Asian-Austrilia Journal of Animal Science,2000,13:659-665.
[15]韩昊奇,刘大程,高民,等.日粮不同NFC/NDF比对奶山羊瘤胃微生物及瘤胃pH变化的影响[J].动物营养学报,2011,23(4):597 -643.
[16]NEOGRADY Z,GALFI P,KUTAS F.Effect of intraruminal butyrate infusion on the plasma insulin level in sheep[J].Acta Veterinaria Hungarica,1989,37(3):247-53.

