黄芪多糖对氢化可的松氧化应激状态下肉仔鸡生长性能、脏器指数及抗氧化能力的影响
魏炳栋 陶 浩 于 维 陈 群* 李 林
(1.吉林省农业科学院畜牧分院,公主岭 136100;2.吉林农业大学动物科技学院,长春 130118)
植物多糖是从天然植物中分离而出的高效活性物质,它不仅是植物体的功能和结构物质,而且还参与了生命现象中的各种活动,在提高机体免疫力、抗氧化能力等方面起到了十分重要的作用[1-4]。动物在正常生理状态下,体内活性氧产生和清除处于动态平衡中,但是许多内源或外源性的刺激均可使体内氧化还原状态失去平衡,使机体处于氧化应激状态[5-6]。常见的应激源有:环境、疾病、饲养管理和心理等,应激时动物体内一些理化指标产生变化,这些变化的理化指标也可以作为应激因子,反过来刺激动物产生应激。因为应激均有肾上腺皮质激素的参与,氢化可的松和皮质酮属于糖皮质激素,作用机理相似[7-9]。因此,本试验采用氢化可的松为应激源,诱导产生氧化应激,研究在饲粮中添加黄芪多糖(Astragalus polysaccharide,APS)对氧化应激状态下肉仔鸡生长性能、主要脏器指数和血清、肝脏中氧化还原状态的影响。
1 材料与方法
1.1 试验动物及试验设计
选用1日龄爱拔益加(AA)肉仔鸡256只,随机分为4个组,每组8个重复,每个重复8只鸡,公母各占1/2,重复之间体重接近。对照组(A组)和模型组(B组)饲喂不添加APS的基础饲粮,基础饲粮为参照美国NRC(1994)家禽营养需要配制的粉状配合饲料,其组成及营养水平见表1。试验1组(C组)和试验2组(D组)饲喂在基础饲粮中分别添加0.4%和0.8%APS的试验饲粮。试验预试期7 d,从第8天开始除A组外,其余各组均在饮水中添加20 mg/L氢化可的松造模,连续5 d,A组饮用蒸馏水;同时C组和D组饲喂添加APS的试验饲粮至第21天,具体的试验设计见表2。试验鸡采用笼养,每个重复单独给料,试验期间肉仔鸡自由采食,充足饮水,按正常免疫程序进行免疫接种。
1.2 试验材料
APS购自陕西中鑫生物技术有限公司,为黄色精细粉末,多糖含量50%;氢化可的松购自山西晋新双鹤药业有限责任公司,为白色粉末,纯度≥99%。
1.3 样品采集与制备
分别于肉仔鸡14、21日龄,每重复按平均体重选取3只鸡,颈部采血10 mL/只,3 500 r/min离心10 min制备血清,于-20℃条件下保存,备测血清抗氧化指标。同时,进行屠宰试验,摘取肝脏、胰腺、脾脏、法氏囊和胸腺,除去血液,滤纸吸干,称重,计算脏器指数。另取肝脏0.5 g,加9倍冰冷生理盐水,剪碎,置玻璃匀浆器中研磨,制成10%的组织匀浆液,2 000 r/min离心15 min,取上清液于-20℃条件下保存,备测肝脏抗氧化指标。
1.4 检测指标
分别于肉仔鸡14和21日龄空腹12 h后称重,记录体重,计算平均日增重。
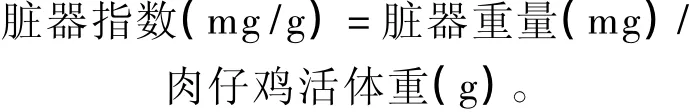
血清和肝脏抗氧化指标的测定:血清和肝脏总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性以及丙二醛(MDA)含量均用Specord S600紫外可见光光度计进行测定,抗氧化指标测定试剂盒购自南京建成生物工程研究所。
1.5 数据处理
结果以平均值±标准差表示,数据处理与分析采用 SPSS 13.0软件的 one-way ANOVA程序进行方差分析,以P<0.05作为差异显著性判断标准,差异显著时,以LSD法进行多重比较。
2 结果
2.1 APS对氢化可的松氧化应激状态下肉仔鸡生长性能的影响
从表2可以看出,C、D组14日龄体重和1~14日龄平均日增重均极显著高于A、B组(P<0.01);D组21日龄体重和1~21日龄平均日增重均显著高于B组(P<0.05)。
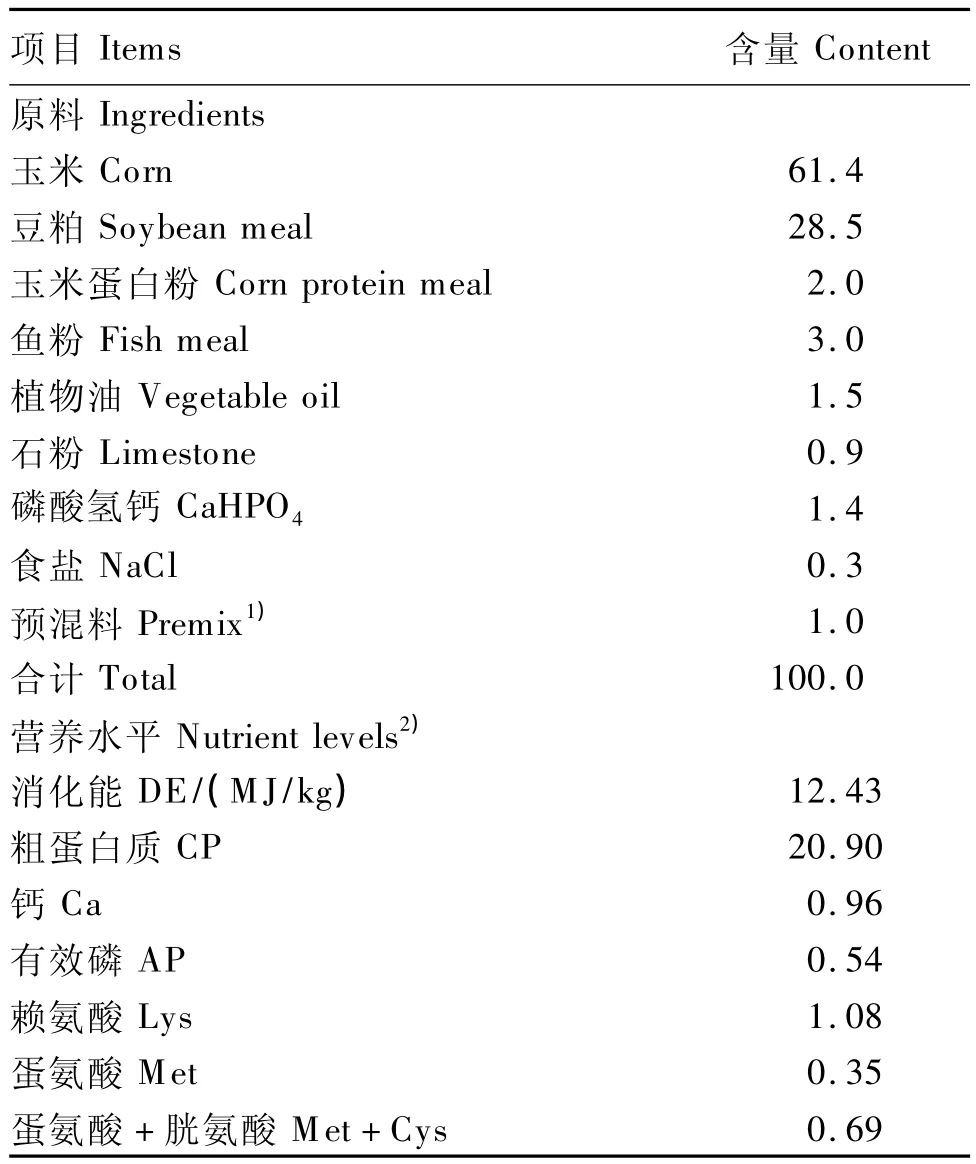
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %

表2 试验设计Table 2 Design of this experiment
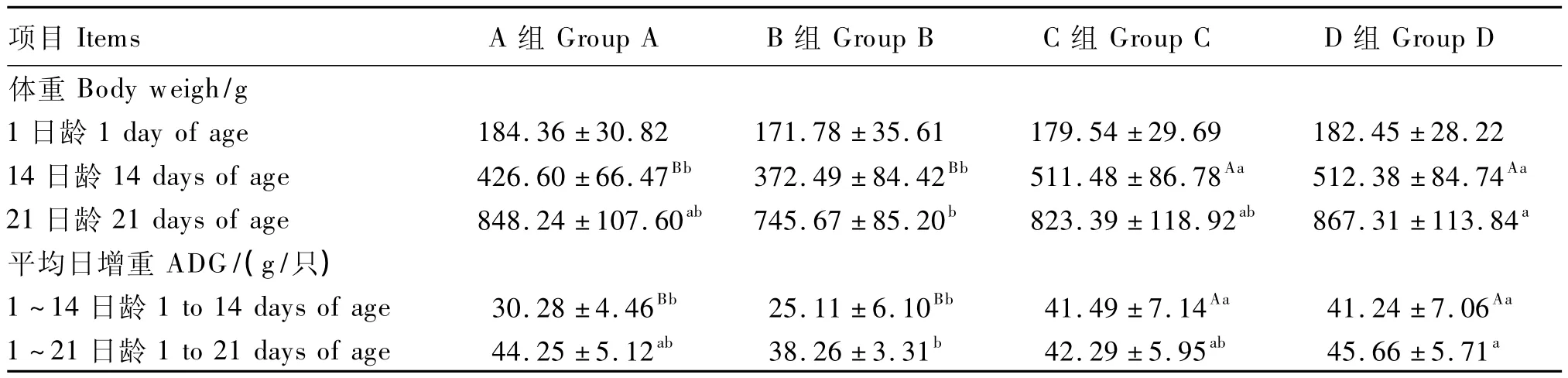
表2 APS对氢化可的松氧化应激状态下肉仔鸡生长性能的影响Table 2 Effects of APS on growth performance of broilers under oxidative stress by hydrocortisone induction
2.2 APS对氢化可的松氧化应激状态下肉仔鸡脏器指数的影响
从表3可以看出,14日龄的肝脏指数A组显著高于其他3组(P<0.05),B、C和D组间差异不显著(P>0.05),胰腺指数A、B组显著高于C组(P<0.05),但与D组差异不显著(P>0.05),脾脏指数B组显著低于A、C组(P<0.05),但与D组差异不显著(P>0.05),法氏囊指数各组间差异均不显著(P>0.05),D组胸腺指数极显著高于A、B组(P<0.01),显著高于 C组(P<0.05),A、C组显著高于B组(P<0.05),A、C组间差异不显著(P>0.05)。21日龄的肝脏指数A、B组显著高于D组(P<0.05),胰腺指数和胸腺指数各组间差异均不显著(P>0.05),C、D组脾脏指数极显著低于 A、B组(P<0.01),且 A、B组间和C、D组间差异均不显著(P>0.05),C组法氏囊指数显著低于D组(P<0.05),而A、B、D组间差异均不显著(P>0.05)。
2.3 APS对氢化可的松氧化应激状态下肉仔鸡血清抗氧化指标的影响
从表4可以看出,14日龄C、D组 T-SOD和GSH-Px活性高于A、B组,但未达到差异显著水平(P>0.05),A、B组MDA含量显著高于D组(P<0.05),但与C组差异不显著(P>0.05)。21日龄各组间T-SOD活性差异不显著(P>0.05),C、D组 GSH-Px活性显著高于 A、B组(P<0.05),且 C、D组 MDA含量极显著低于 B组(P<0.01)。
2.4 APS对氢化可的松氧化应激状态下肉仔鸡肝脏抗氧化指标的影响
从表5可以看出,14日龄肝脏 T-SOD和GSH-Px活性各组间差异不显著(P>0.05),C、D组MDA含量极显著低于A、B组(P<0.01)。21日龄,各组MDA含量各组间差异均不显著(P>0.05),C组 T-SOD活性显著高于 B组(P<0.05),且 A、C、D 组间差异不显著(P >0.05),A组 GSH-Px活性显著高于 B、C、D 组(P<0.05),且B、C、D组间差异不显著(P>0.05)。
3 讨论
3.1 APS对氢化可的松氧化应激状态下肉仔鸡生长性能的影响
当应激发生时,肌肉、血浆中不稳定蛋白质贮存组织分解能力加强,血浆尿酸和尿酸氮含量增加,分解氨基酸通过糖异生作用生成葡萄糖,从而使氮存留受到损害,蛋白质合成降低伴随着肉鸡生长性能下降[10]。大多数研究认为,应激会影响动物的生产性能,Puvadolpirod等[8]报道,促肾上腺皮质激素(ACTH)处理后,4和7 d的增重均低于对照组;柏华[11]的研究结果表明,慢性氧化应激不同程度地降低了肉仔鸡日增重,增加了饲粮的耗料量和料重比,对生产性能有影响,但差异不显著。在本试验结果中,通过在饲粮中添加APS,可显著改善氢化可的松产生的氧化应激状态,促进动物生长。
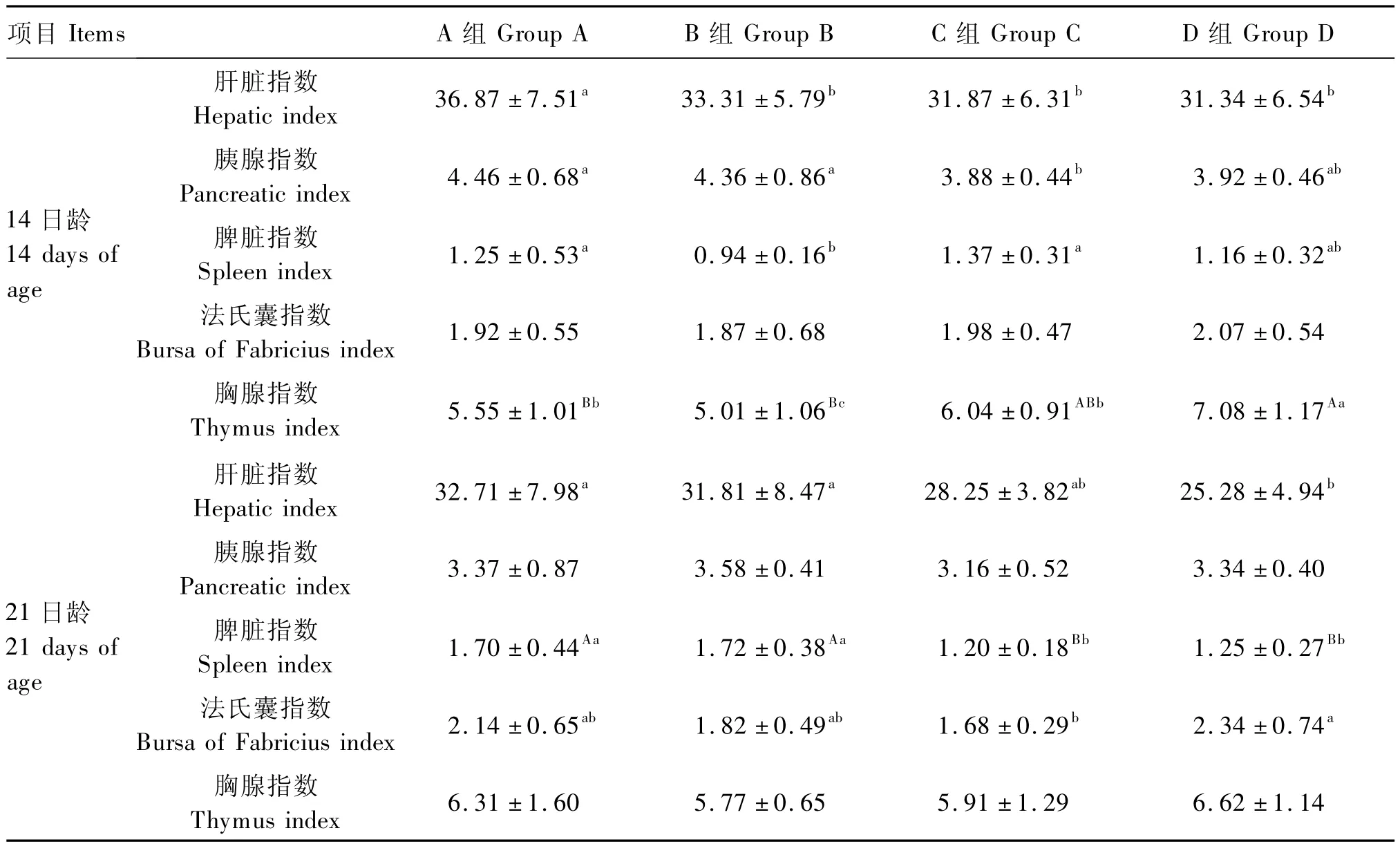
表3 APS对氢化可的松氧化应激状态下肉仔鸡脏器指数的影响Table 3 Effects of APS on viscera indexes of broilers under oxidative stress by hydrocortisone induction mg/g
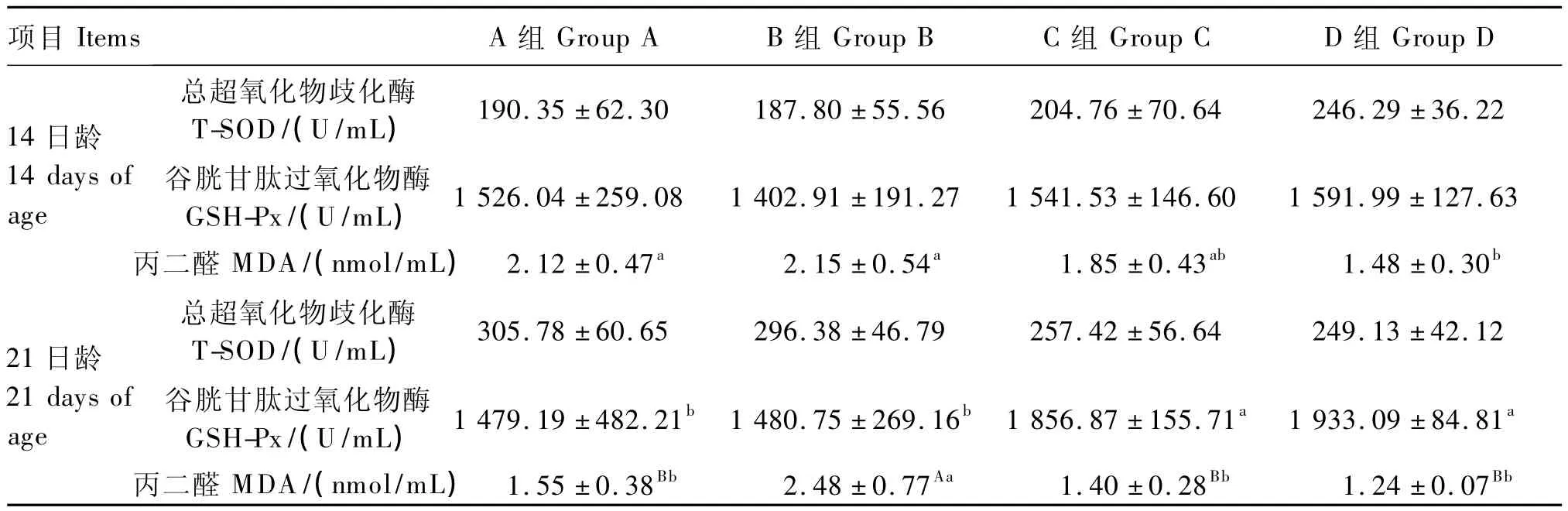
表4 APS对氢化可的松氧化应激状态下肉仔鸡血清抗氧化指标的影响Table 4 Effects of APS on serum antioxidant indices of broilers under oxidative stress by hydrocortisone induction
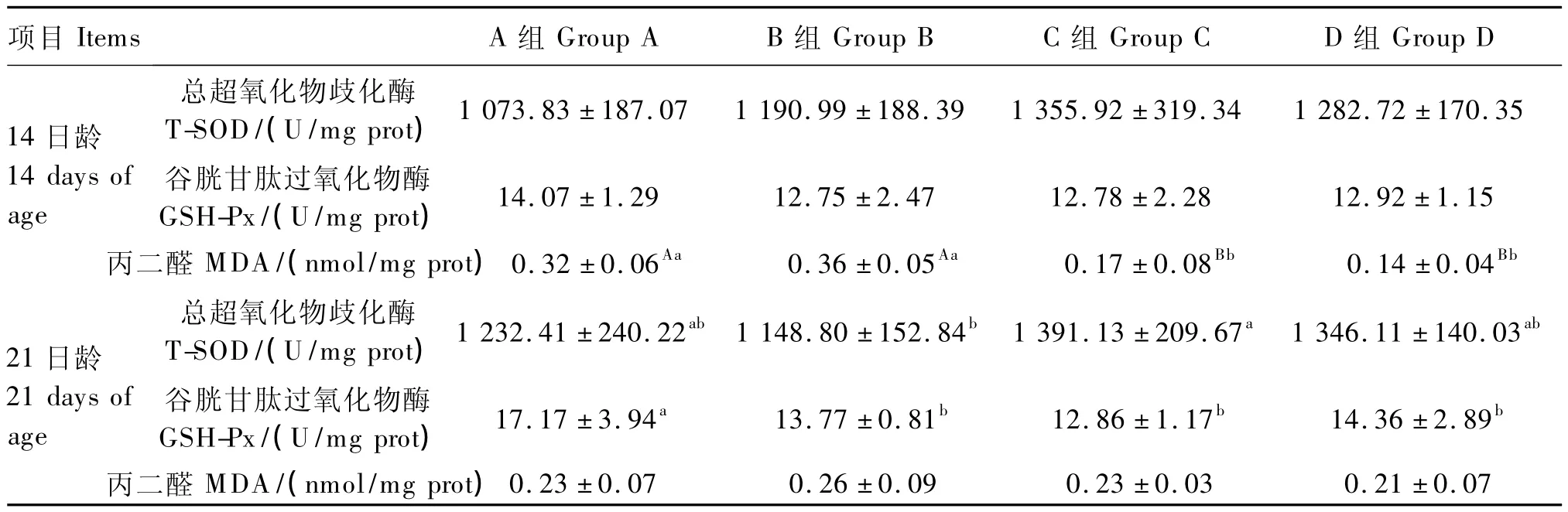
表5 APS对氢化可的松氧化应激状态下肉仔鸡肝脏抗氧化指标的影响Table 5 Effects of APS on hepatic antioxidant indices of broilers under oxidative stress by hydrocortisone induction
3.2 APS对氢化可的松氧化应激状态下肉仔鸡主要脏器指数的影响
动物的脏器指数是其重要的生物学特性指标之一,脏器指数的相对大小,从一定程度上可说明其功能的强弱[12]。肝脏和胰腺是体内重要的代谢器官和消化器官,胸腺、法氏囊和脾脏是重要的免疫器官。一般认为,动物免疫器官重量的增加是由其自身细胞生长发育和分裂增殖所致。
本试验结果说明氢化可的松氧化应激对14日龄的肉仔鸡脏器指数有影响,但是随着试验时间的延长,这种影响逐渐变得不明显。同样,APS对14日龄肉仔鸡应激产生的脏器指数损伤有一定的缓解作用,尤其能改善脾脏和胸腺等免疫器官指数,但是对21日龄的大多脏器指数影响不显著。国内外关于应激对器官指数影响的报道结果也不尽一致。武书庚[6]的研究结果表明,在应激处理10 d之前,可的松饮水对肉仔鸡胸腺指数无显著影响,应激处理10 d后,试验组胸腺指数显著低于对照组,处理2 d后,试验组的脾脏指数显著低于对照组,但是在其他时间未见显著差异,且对肉仔鸡的肝脏指数无显著影响;Puvadolpirod等[8]报道,ACTH诱导的氧化应激处理4和7 d后,降低了肉仔鸡的免疫器官指数,显著增加肝脏的绝对重量和相对重量。
关于APS对肉仔鸡脏器指数的报道较多。魏炳栋[13]报道,在肉仔鸡饲粮中添加 APS对1~7日龄肝脏、胰腺及免疫器官指数的影响显著,但是对1~14日龄影响不显著,这可能是由于肉仔鸡在1~7日龄时内脏器官发育还不完善,功能也不健全,添加APS可促进体内器官细胞的发育和增殖,使得重量增加,而1~14日龄时,器官发育较为完善,添加效果就不明显;李树鹏[14]的研究表明,APS可使肝细胞排列紧密有序、枯否氏细胞核小叶间动静脉增多,有助于增强肝功能;石达友等[15]的研究中指出,黄芪提取浓缩粉能增加粤黄鸡的胸腺、脾脏和法氏囊指数。
3.3 APS对氢化可的松氧化应激状态下肉仔鸡血清和肝脏抗氧化指标的影响
动物处于应激状态时,肾上腺髓质部大量分泌儿茶酚胺,Haggendal等[16]报道,试验性应激(束缚)导致交感-肾上腺系统的反应而大量释放儿茶酚胺类激素,特别是肾上腺素能促使神经末梢释放去甲肾上腺素,可导致自由基产量增加而造成心肌损伤,自由基产生的增加会导致组织细胞内的脂质过氧化现象发生。MDA是脂质过氧化反应的最终产物,能够间接反映细胞的损伤程度;SOD和GSH-Px是自由基损害的主要防御酶,清除自由基,同时,这2种酶之间还能起相互保护作用[6]。
本试验通过测定肉仔鸡血清和肝脏匀浆中TSOD、GSH-Px活性和MDA的含量,间接地反映了细胞的脂质过氧化程度。结果表明,氢化可的松可诱导产生氧化应激,使细胞产生不同程度的氧化损伤,通过在饲粮中添加APS后,可以看出,14日龄C、D组血清T-SOD和GSH-Px活性、21日龄血清GSH-Px活性以及14和21日龄肝脏 T-SOD活性均高于A、B组,且21日龄血清和14日龄肝脏MDA含量极显著低于A、B组,说明APS对氢化可的松诱导的氧化应激有一定的干预作用,能够提高T-SOD和GSH-Px活性,减少脂质过氧化产物MDA的含量。
武书庚[6]研究结果表明,饮用可的松可使肉仔鸡血清MDA含量明显升高,而SOD活性下降,而且还随着可的松浓度的增加,机体发生脂质过氧化反应增强,同样,心脏和肝脏中MDA含量与SOD活性之间存在负相关,且对肝脏的损伤比心脏明显;柏华[11]研究结果表明,慢性氧化应激可显著升高肉仔鸡心脏和肝脏MDA含量,降低SOD和GSH-Px活性;同样,丛杰等[17]和方志宏等[18]相继报道了辐射、冷应激和急性热应激可引起组织中过氧化现象的发生;魏炳栋等[13]报道,在饲粮中添加APS可显著提高1~14日龄肉仔鸡血清和肝脏中T-SOD和 GSH-Px活性,降低 MDA含量,说明APS对1~14日龄肉仔鸡具有较强的抗氧化作用;吕美[19]和徐小芳等[20]的研究中指出,APS 能够提高肉仔鸡血清中GSH-Px和SOD活性,降低MDA含量,具有较强的抗氧化活性。本试验结果与上述报道一致,APS对氢化可的松诱导产生的氧化应激具有一定的干预作用,能够提高血清和肝脏中 T-SOD和 GSH-Px的活性,减少 MDA的含量。
4 结论
APS可通过提高肉仔鸡血清和肝脏中T-SOD和GSH-Px活性,减少MDA的含量,缓解氢化可的松诱导的氧化应激,从而上调肉仔鸡脏器指数,保证动物生长。
[1]冯婷,何聪芬,赵华,等.植物多糖的研究进展[J].北京工商大学学报,2004,22(5):1-4.
[2]丁保全,金丽琴,吕建新.多糖生物活性研究进展[J].中国药学杂志,2004,39(8):561 -564.
[3]唐小红,祝寿芬.国内外对高等植物多糖的研究进展[J].山西医科大学学报,1998,29(1):95 -96.
[4]罗祖友,吴季勤,吴谋成.植物多糖的抗氧化与抗病毒活性[J].湖北民族学院学报,2007,25(1):77-81.
[5]陈群.氧化应激对动物消化道结构功能影响的研究[D].博士学位论文.无锡:江南大学,2007:11-13.
[6]武书庚.肉仔鸡氧化应激模型的研究[D].博士学位论文.北京:中国农业科学院,2007:1-3.
[7]POST J,REBEL M J,TER HUURNE A A.Physiological effects of elevated plasma corticosterone concentrations in broilers chickens.An alternative means by which to access the physiological effects of stress[J].Poultry Sciences,2003,82:1313 - 1318.
[8]PUVADOLPIROD S,THAXTON J P.Model of physiological stress in chickens 1.Response parameters[J]Poultry Science,2000,79:363 -369.
[9]梁礼成,刘建华,金久善,等.ACTH和地塞米松对鸡血浆纤维连接蛋白及血清生化指标的影响[J].中国农业大学学报,2000,5(3):106-110.
[10]刘铀,刘艳芬,林红英,等.VE防治肉鸡热应激机理的初步研究[J].中国家禽,1999,21(6):6 -10.
[11]柏华.慢性氧化应激对肉仔鸡肉品质及消化代谢的影响[D].硕士学位论文.杨凌:西北农林科技大学,2007:40-42.
[12]马得莹,单安山,李群道.中草药添加剂对蛋雏鸡生长性能和免疫功能的影响[J].动物营养学报,2004,16(2):36 -40.
[13]魏炳栋,于维,陶浩,等.黄芪多糖对1~14日龄肉仔鸡生长性能、脏器指数及抗氧化能力的影响[J].动物营养学报,2011,23(3):486 -491.
[14]李树鹏.黄芪多糖益生菌合生元对雏鸡生长和免疫作用的研究[D].硕士学位论文.杨凌:西北农林科技大学,2005:32-41.
[15]石达友,刘汉儒,卓曲,等.中药提取物对鸡免疫器官发育和新城疫抗体水平的影响[J].中兽医杂志,2004(2):4-5.
[16]HAGGENDAL J,JONSSON L,JOHANSSON G,et al.Catecholamine induce free radicals in myocardial cell necrosis on experimental stress in pigs[J].Acta Physiologica Scandinavica,1987,131:447 -452.
[17]丛杰,方允中.应激反应引起的氧化损伤[J].自由基生命学进展,1993,1:28 -34.
[18]方志宏,高应.沙棘油和VE对冷暴露大鼠脂质过氧化物作用的影响[J].营养学报,1995,17:27-31.
[19]吕美.黄芪多糖粗提物对肉仔鸡生长及代谢调控的研究[D].硕士学位论文.郑州:河南农业大学,2005:16-19.
[20]徐小芳,罗燕,赵民,等.中药复方多糖对鸡抗氧化功能的影响[J].中国农业科学,2009,42(2):706 -713.

