柴胡皂苷-d 对大鼠肝癌细胞H4-ⅡE 细胞内Ca2+的影响研究
秦 勇 陈念平 叶冠雄 徐胜前 吴成军 王 世 潘德标
胆汁酸可通过诱导内质网(ER)中Ca2+的释放和(或)钙内流,改变细胞内钙离子浓度([Ca2+]cyt),来加强或抑制胆汁沿着胆道系统进行排泄,调节肝细胞一系列生理功能[1~3]。我国中药柴胡在临床应用中发挥不同的作用,柴胡皂苷是柴胡的主要化学成分,Yang等研究发现10μmol/L柴胡皂苷(I)能诱导大鼠胰腺腺泡细胞内钙库中Ca2+释放,增加细胞内Ca2+浓度,随后又出现胞外Ca2+内流,再次增加胞内Ca2+浓度[4~6]。而在随后的研究中证实,柴胡皂苷(I)通过与大鼠胰腺腺泡细胞膜受体的相互作用转导刺激信号,使[Ca2+]i先后两次达到峰值,从而持续加强柴胡皂苷(I)的促酶分泌功能。日本学者Kodama等[7]对C6型大鼠神经胶质瘤细胞的研究中发现10~100μmol/L柴胡皂苷-d可诱导细胞内钙库中Ca2+释放,使细胞内Ca2+浓度升高。综合上述学者的研究,柴胡皂苷-d可调控细胞内Ca2+浓度的变化,但能否诱导肝细胞系内Ca2+浓度的变化在国内少见报道,本实验在细胞水平上探讨SS-D对H4-ⅡE细胞内Ca2+浓度变化影响作用。
资料与方法
1.细胞株:大鼠肝癌细胞株H4-ⅡE购自上海拜力生物科技有限公司。
2.试剂和仪器:DMEM培养基(广州威佳公司),石胆酸、熊脱氧胆酸(Sigma公司),柴胡皂苷-d(南昌贝塔公司),Fluo-3/AM荧光探针(香港先进技术公司)。
3.细胞培养:大鼠肝癌细胞株H4-ⅡE接种于含10%胎牛血清、100U/L青霉素、100μg/ml链霉素的DMEM高糖培养基中,在37℃、饱和湿度、5%CO2培养箱中常规培养,每1~2天换液传代培养。传代时将原培养液吸出,加入0.25%胰蛋白酶溶液消化45s后,加入5ml左右的新培养液终止消化,然后用培养液吹打制成细胞悬液后传代或接种。
4.实验分组:第一大组:处理组为柴胡皂苷-d样品液加入培养液中,终浓度分别为处理组1(30μmol/L)、处理组2(50μmol/L)、处理组 3(70μmol/L)、处理组 4(100μmol/L),同时每个处理组都加入终浓度为50μmol/L石胆酸(LCA);空白对照组:加入与处理组相同体积完全培养液(大鼠肝癌细胞H4-ⅡE);阴性对照组:终浓度为50μmol/L LCA加入与处理组相同体积培养液中;阳性对照组:终浓度为300μmol/L熊脱氧胆酸(UDCA)与终浓度为50μmol/L LCA同时加入与处理组相同体积培养液中。第二大组又分别设立空白对照组、终浓度为50μmol/L的LCA为阴性对照组、300μmol/L的UDCA为阳性对照组及50μmol/L的SS-D为处理组。
5.噻唑蓝(MTT)比色实验:取对数生长期生长良好的H4-ⅡE肝癌细胞以6×103/孔的密度接种于96孔培养板,每组设5个平行孔,培养箱中培养12h后(待完全贴壁),换含有不同浓度的柴胡皂苷-d及对照组的H4-ⅡE肝癌细胞培养液,继续培养12h后,后进行MTT染色分析
6.荧光指示剂Fluo-3/AM结合流式细胞仪测定细胞内钙离子浓度:①将浓度为5×105个/毫升的H4-ⅡE肝癌细胞接种于培养基中,培养24h后换液,第一大组及第二大组各实验组同时作用细胞12h后,无Ca2+的D-Hank's离心洗涤1000r/min×5min×3次,弃上清液,收集细胞(2~3)×106个细胞;②第一大组避光加入1ml终浓度为2.4mmol/L的Ca2+及5μmol/L荧光染料Fluo-3/AM孵育缓冲液悬浮细胞;37℃、5%CO2的培养箱中避光孵lh;③第二大组避光先加入lm l无Ca2+、pH值为8.8、终浓度为20mmol/L的乙二醇双四乙酸(EGTA)及5μmol/L荧光染料Fluo-3/AM孵育缓冲液悬浮细胞;37℃、5%CO2的培养箱中避光孵育1h。选用各实验分组作用于大鼠肝癌细胞株H4-ⅡE12h后,按照试剂盒上的说明书结合流式细胞仪检测H4-ⅡE细胞内Ca2+浓度的变化。
结 果
1.噻唑蓝(MTT)比色实验选择药物实验浓度:不同浓度的SS-D处理H4-ⅡE肝癌细胞12h后,SS-D对肝癌细胞的抑制作用不大,最大抑制率不超过11.12%;说明10~100μmol/L SS-D 对细胞的生长无明显影响(表1)。SS-D不同浓度时细胞的存活率见表1,为避免药物浓度过大所致的细胞毒性作用,应选择对细胞生长无明显影响即细胞存活率在90%以上的浓度。
表1 柴胡皂苷-d组对H4-ⅡE肝癌细胞活性的影响(±+s)
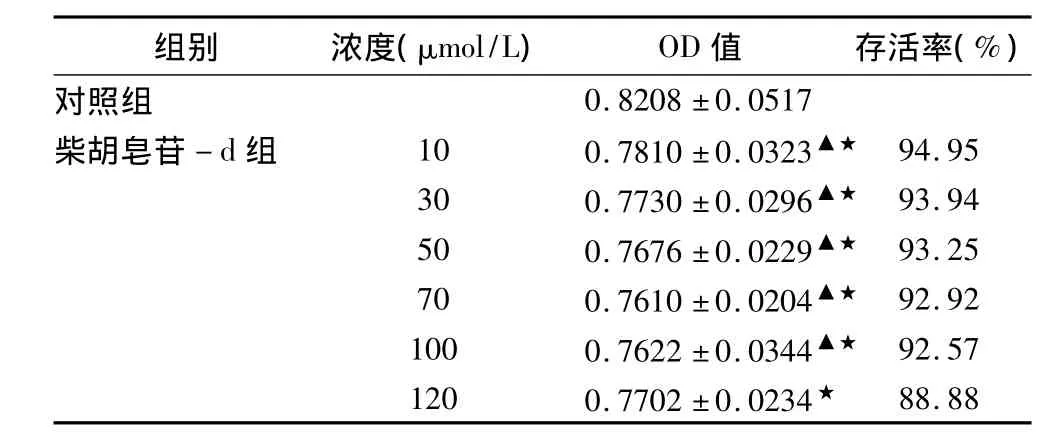
表1 柴胡皂苷-d组对H4-ⅡE肝癌细胞活性的影响(±+s)
与对照组比较,★P<0.05;与120μmol/L柴胡皂苷 -d组比较,▲P <0.05
组别 浓度(μmol/L) OD值 存活率(%)88.88 0.8208 ±0.0517柴胡皂苷 -d组 10 0.7810 ±0.0323▲★ 94.95 30 0.7730 ±0.0296▲★ 93.94 50 0.7676 ±0.0229▲★ 93.25 70 0.7610 ±0.0204▲★ 92.92 100 0.7622 ±0.0344▲★ 92.57 120 0.7702 ±0.0234★对照组
2.荧光指示剂Fluo-3/AM测定细胞内钙离子浓度:分析结果以1万个细胞平均荧光强度 (mean fluorescence intensity,MFI)表示细胞内钙离子的相对含量,结果显示第一大组中阴性对照组处理H4-ⅡE细胞12h后可引起细胞内Ca2+的MFI升高,阳性对照组可使细胞内Ca2+的MFI大幅度升高,两组比较差异有统计学意义(P<0.05)。处理组也可使细胞内钙离子的MFI不同程度升高,并且与SS-D呈浓度依赖性,与阴性对照组比较有差异(P<0.05);处理组1、处理组3、处理组4与阳性对照组比较有差异(P<0.05),并且与SS-D呈浓度依赖性。第二大组中阴性、阳性及处理组都能使细胞内Ca2+的MFI增加,说明SS-D、LCA及UDCA都能诱导钙库中钙离子释放到胞质中。
3.流式细胞仪图观察各实验组Ca2+的变化情况:图1 中 A、B、D、E、F、G 各波峰代表进入区域的荧光数目,横线代表荧光强度;A组未见进入荧光强度区域内的波峰,G及C组也可见不同程度进入荧光强度区域内的波峰,而随着处理组浓度的增加,进入横线区域的波峰也增多,说明荧光强度及量呈不同程度

图1 石胆酸、熊脱氧胆酸、柴胡皂苷-d对H4-ⅡE细胞内钙离子浓度的影响
讨 论
钙离子是细胞内的主要第二信使,参与调控许多细胞和组织的生理活动,近期研究胆汁酸对大鼠肝癌细胞H4-ⅡE和原代正常的鼠肝细胞的作用,发现UDCA及其他的利胆胆汁酸,能诱导内质网钙库中Ca2+释放,激活 Ca2+内流[3,8]。而预培养 12h 的 LCA及其他淤胆胆汁酸也可诱导内质网钙库中Ca2+释放,但抑制Ca2+内流,利胆胆汁酸牛磺脱氧胆酸(TDCA)与淤胆胆汁酸LCA同时行细胞培养12h后,细胞内Ca2+浓度明显升高,这提示TDCA能抵消预培养12h的LCA对钙池操作性钙通道(SOC)的抑制作用,说明利胆胆汁酸能中和淤胆胆汁酸对细胞的毒害作用[3]。柴胡皂苷-d是柴胡化学成分中最具有活性的成分,能否诱导肝细胞系内Ca2+的变化,在国内研究甚少[4]。
本实验通过30~100μmol/L柴胡皂苷-d(SSD)加50μmol/L LCA作为处理组、UDCA加LCA作为阳性对照组及LCA作为阴性对照组同时孵育大鼠肝癌细胞 H4-ⅡE 12h后,结果显示 LCA可引起[Ca2+]cyt升高,UDCA可使其大幅度升高,不同浓度的SS-D也可使其不同程度升高,并且与SS-D呈浓度依赖性,而50μmol/L的LCA、300μmol/L的UCDA及50μmol/L的SS-D作用于大鼠肝癌细胞H4-ⅡE 12h后都能使[Ca2+]cyt增加,说明SS-D与利胆胆汁酸具有相同作用,而有研究在胆汁淤积症鼠模型中证实,利胆胆汁酸能预防胆管细胞受损,维持其正常的功能活动[9]。又有研究表明,肝细胞内胞质中游离Ca2+浓度的升高是由于胞外Ca2+内流和胞内钙库中Ca2+的释放所致,而这又是胆管收缩,促使胆汁酸沿着胆小管移动的必需的部分机制。而SSD对乙醇损伤大鼠肝细胞研究表明,SS-d能增强机体抗氧化防御能力[10]。抑制自由基的产生,促进肝细胞增殖,防止肝细胞损伤和坏死。这更进一步说明SS-D可能通过影响细胞内Ca2+变化来刺激胆汁流量,在分子水平上减少氧自由基的产生,从而起到保护肝细胞内能量代谢、减轻肝脏损伤的作用。
综上所述,结合本次实验,是否可推测SS-D可能作为一种“天然的利胆药”,在胆汁淤积症中或肝内外胆道梗阻解除的情况下,通过诱导细胞内钙库中Ca2+的释放来提高胞质中钙离子浓度,加强胆汁排泄。但SS-D在调控细胞内Ca2+浓度的变化是否与膜上的钙信号通路有关,值得更进一步研究。
1 Lau BW,Colella M,RuderWC,etal.Deoxycholic acid activates protein kinase C and phospholipase C via increased Ca2+entry at plasma membrane[J].Gastroenterology,2005,128(3):695 -707
2 Gerasimenko JV,Flowerdew SE,Voronina SG,et al.Bile acids induce Ca2+release from both the endoplasmic reticulum and acidic intracellular calcium stores through activation of inositol trisphosphate receptors and ryanodine receptors[J].JBiol Chem,2006,281:40154 - 40163
3 Aromataris EC,Castro J,Rychkov G,et al.Storeoperated Ca2+channels and stromal interaction molecule 1(STIM1)are targets for the actions of bile acids on liver cells[J].Biochim Biophys Acta Mol Cell Res,2008,1783(5):874 -885
4 史群云,高丽丽.柴胡的研究现状[J].医护论坛,2009,6(3):158-159
5 YangWX,Yu Y,ZhangWZ,et al.Inhibitory role of GDP on saikosaponin(I)stimulated enzymes secretion and rising of[Ca2+]i in rat pancreatic acini[J].Acta Pharmacol Sin,2001,22(7):669 - 672
6 Yu Y,Yang WX,Wang H,et al.Characteristics and mechanism of enzyme secretion and increase in[Ca2+]i in Saikosaponin(I)stimulated rat pancreatic acinar cells[J].World JGastroenterol,2002,8(3):524-527
7 Kodama Y,Xiaochuan L,Tsuchiya C.Dual effect of saikogenin D:in vitro inhibition of prostaglandin E2 production and elevation of intracellular free Ca2+concentration in C6 rat glioma cells[J].Planta Med,2003,69(8):765 -767
8 Joel C,Edoardo C,Grigori Y,et al.A small component of the endoplasmic reticulum is required for store-operated Ca2+channel activation in liver cells:evidence from studies using TRPV1 and tauro-deoxycholic acid[J].Biochem J.2009,418:553 -566
9 Marco M,Heather F,Antonio B,et al.Ca2+- dependent cytoprotective effects of ursodeoxycholic and tauroursodeoxycholic acid on the biliary epithelium in a ratmodel of cholestasis and loss of bile ducts[J].American Journal of Pathology,2006,168,(2):398 -409
10 李素婷,周晓慧,杨鹤梅,等.柴胡皂苷-d对乙醇损伤原代培养大鼠肝细胞的保护作用[J].承德医学院院报,2007,24(4):352-354

